杜仲总多糖EOP高调肺癌LLC细胞中caspase3表达来抑制肿瘤细胞增殖的机制研究
李 晖 骆志国
肺癌是目前发病率和死亡率均居首位的恶性肿瘤,其中以非小细胞肺癌为多见,约占肺癌所有病例的80%~85%。由于肺癌具有很强的侵袭迁移能力,所以是恶性肿瘤较高的肿瘤之一,且具有多种多样的生物学特性[1-2]。现有大量的研究证实Caspase3是一切凋亡信号传导的共同通路,前期查阅大量文献未见有杜仲通过激活caspase3途径来诱导肿瘤细胞凋亡的相关报道[3-4]。此外,虽然有证据表明在非小细胞癌中Caspase3可通过切断PARP途径,裂解DNA引起细胞凋亡,对抗Surivin基因抑制凋亡作用从而诱导肿瘤细胞凋亡[5-7],但国内外关于EPO通过激活caspase3途径抑制肺癌细胞侵袭的研究亦未见报道。本研究中一是研究杜仲总多糖(EOP)对Lewis肺癌小鼠LLC细胞体外生长的抑制作用:检测EOP、CDDP对LLC及KMB-17的细胞毒作用,证明其能否抑制肺癌细胞生长。二是探讨杜仲总多糖(EOP)抑制Lewis肺癌小鼠LLC细胞的可能作用机制:检测EOP、CDDP作用LLC细胞前后细胞中Caspase3 mRNA表达水平和蛋白表达水平的变化,证明其是否通过激活Caspase3 途径诱导肺癌细胞凋亡。
1 材料与方法
1.1 细胞株试剂与仪器
1.1.1 细胞株 小鼠Lewis肺腺癌LLC细胞株和人胚肺组织KMB-17二倍体细胞株购于西安交通大学。
1.1.2 主要试剂 caspase3 抗体(兔抗人多克隆抗体,NEB 原装),pYSTAT3 抗体(兔抗人多克隆抗体,PharMigen 原装),新生牛血清(杭州四季青生物工程材料有限公司),RPMI-1640培养基(Gibco公司,货号:22400-071),PBS(江苏恒瑞)。
1.1.3 主要实验仪器 流式细胞仪(美国BD公司);CO2培养箱、漩涡振荡仪(美国Thermo公司);高速低温离心机(德国Ependoff公司);倒置光学显微镜(奥林巴斯);酶标仪(北京伯辉生物科技有限公司);电泳仪、电转移仪、垂直电泳槽(杭州汇尔仪器设备有限公司)。
1.2 实验方法
1.2.1 细胞培养 将冻存的LLC细胞和KMB-17细胞从-150 ℃冰箱取出,37 ℃水浴锅中快速融解后,用75%酒精消毒,在超净工作台中移至干净的15 ml离心管中,补充9 ml新鲜的1640培养基。3 000 r/min,离心10 min。弃掉培养基,加入5 ml新鲜的1640+10%FBS悬浮沉淀,转移至细胞培养瓶中,置于37 ℃,5%CO2培养箱中培养。细胞培养基变黄后,换液,继续培养。
1.2.2 四甲基偶氮唑蓝(MTT) 比色法测定EOP和CDDP抑制LLC、KMB-17细胞生长的最佳作用浓度 选择细胞状态良好的LLC和KMB-17细胞,调整细胞悬液浓度,每孔加入100 μl,铺板使待测细胞调密度至1×104/孔。96孔板置于5%CO2,37 ℃孵育48 h,分别加入200 μl含有0.5 μg/ml,1.0 μg/ml,2.0 μg/ml,4.0 μg/ml,8.0 μg/ml EOP和CDDP继续培养48 h。48 h后用每孔加入180 μl无血清培养基和20 μl MTT溶液,继续培养4 h,4 h后弃掉上清培养液,每孔中加入150 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪OD490 nm处测量各孔的吸光值。选择EOP和CDDP刺激LLC细胞和KMB-17细胞的的最佳作用浓度。
1.2.3 细胞划痕法观察EOP及CDDP对LLC细胞迁移的影响 ①先用Maker笔在六孔板背后,用直尺比着,均匀的划出横线,大约每隔0.5~1 cm一道,横穿过孔。②在孔中加入5×105个细胞。③次日用枪头比着直尺,尽量垂直于背后的横线划痕,枪头要垂直,不能倾斜。④用PBS洗细胞3次,洗掉划下的细胞,加入新鲜的无血清培养基培养。⑤置于37 ℃5%CO2的培养箱中培养,24 h拍照,观察细胞迁移情况。
1.2.4 Realtime PCR法检测caspase3 mRNA表达 Trizol法提取细胞总RNA,Nanodrop 2000微量核酸分析仪检测RNA的纯度及浓度。用5 μg RNA样品进行逆转录,根据测定的RNA浓度,计算5 μg反转录所需RNA的量,加入0.2 mLEP管中;加入Oligo dT(18)1 μL;补加无RNA酶水至11 μL,轻弹管壁混匀,瞬离;PCR仪上65 ℃变性5 min后迅速置于冰上,使之冷却,防止二级结构的产生;然后加8 μL 的MIX,体系如下:Transcript Reversase 1 μL,Transcript Reversase Inhibitor 1 μL,5×reaction Buffer 4 μL,10 mM dNTP 2 μL,总体积为20 μL,轻弹管壁混匀,瞬时离心将液体甩至管底,设置PCR仪孵育42 ℃反应60 min,70 ℃ 5 min终止反应,-20 ℃保存待用。Real time PCR加样体系如下:2×SYBR Green 10 μL,上下游引物各1 μL,cDNA 5 μg,补无菌双蒸水至20 μL。加完样后上荧光定量PCR仪反应。反应程序如下:94 ℃ 5 min,(94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s)40个循环,72 ℃10 min。
1.2.5 Western blotting法检测caspase3蛋白表达 按照100 μL 细胞裂解液RIPA加1 μL蛋白酶抑制剂PMSF来提取脑肿瘤细胞总蛋白,采用BCA法检测胞总蛋白浓度。取30 μg蛋白样品经SDS-PAGE电泳后,100 V恒压电泳2 h,待目的条带分离开后300 mhA横流转膜1 h,将凝胶中蛋白质转移至固相载体PVDF膜上。PVDF膜在TBST中洗5 min以洗掉膜上的transbuffer,然后在含5%脱脂奶粉的TBST中以800 rpm/min,室温封闭2 h,孵育一抗,小鼠抗人caspase3抗体稀释比例为1∶1 000,鼠抗β-actin抗体稀释比例为1∶1 000,稀释液为5%BSA,放入湿盒中在4 ℃冰箱孵育过夜。次日,TBST洗膜4次,每次15 min。山羊抗小鼠IgG二抗1∶5 000,室温孵育2 h,用化学发光凝胶成像系统进行ECL化学发光显色。
1.3 统计学分析
2 结果
2.1 MTT比色法测定EOP及CDDP抑制LLC、KMB-17细胞生长的最佳作用浓度
分别将含有0.5 μg/ml、1.0 μg/ml、2.0 μg/ml、4.0 μg/ml、8.0 μg/ml EOP和CDDP培养基200 μL加入单层LLC和CDDP细胞培养,MTT法检测EOP及CDDP抑制LLC、KMB-17细胞生长的最佳作用浓度,结果显示:实验组中,与对照组相比,2.0 μg/ml,4.0 μg/ml,和8.0 μg/ml EOP均可不同程度的抑制LLC细胞核KMB-17细胞的生长,其中4.0 μg/ml的EOP可明显抑制LLC和KMB-17细胞的增殖,具有显著性差异(P<0.01)。同样,阳性对照组也有相同的结果,与对照组相比,2.0 μg/ml,4.0 μg/ml,和8.0 μg/ml CDDP均可不同程度的抑制LLC细胞核KMB-17细胞的生长,其中4.0 μg/ml的CDDP可明显抑制LLC和KMB-17细胞的增殖,具有显著性差异(P<0.01)。因此4.0 μg/ml 作为后续实验EOP和GDPP的最佳刺激时间,具体结果见图1。
2.2 细胞划痕法观察EOP及CDDP对LLC细胞迁移的影响
4 μg/ml EOP和4 μg/ml CDDP分别作用于小鼠Lewis肺腺癌LLC细胞株48 h,结果显示,与对照组相比,4 μg/ml EOP和4 μg/ml CDDP均可显著抑制LLC细胞的增殖迁移,划痕部分覆盖率下降,肿瘤细胞侵袭程度明显降低,说明EOP可抑制肺腺癌LLC肿瘤细胞的迁移,具有显著的抑癌效果。见图2。
2.3 Western blot法检测caspase-3蛋白水平的表达
采用RIPA法提取正常对照组、EOP作用组和CDDP作用组的LCC细胞总蛋白,BCA定量法进行DNA定量,取30 μg蛋白变性后经SDS-PAGE凝胶电泳检测3种细胞中caspase3蛋白水平的表达。结果显示:EOP组和CDDP组caspase3的mRNA与对照组相比,显著增加,P<0.01,具体结果见图3。
2.4 RT-PCR法检测caspase-3mRNA水平的表达
TRIZOL法提取正常对照组和EOP作用组,CDDP作用组的LLC细胞总RNA,反转录为cDNA,实时荧光定量RCR检测3种细胞中caspase3 mRNA水平的表达。结果显示:EOP组和CDDP组caspase3 mRNA的表达水平与对照组比较,显著增高,P<0.01,具体结果见图4。
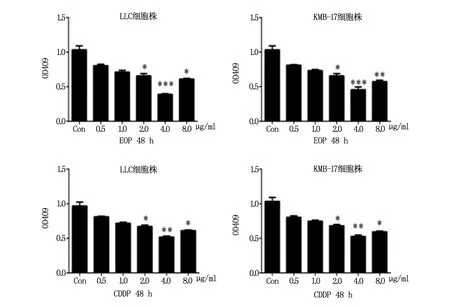
图1 MTT法检测不同浓度EOP和CDDP对LLC和KMB-17细胞的抑制作用
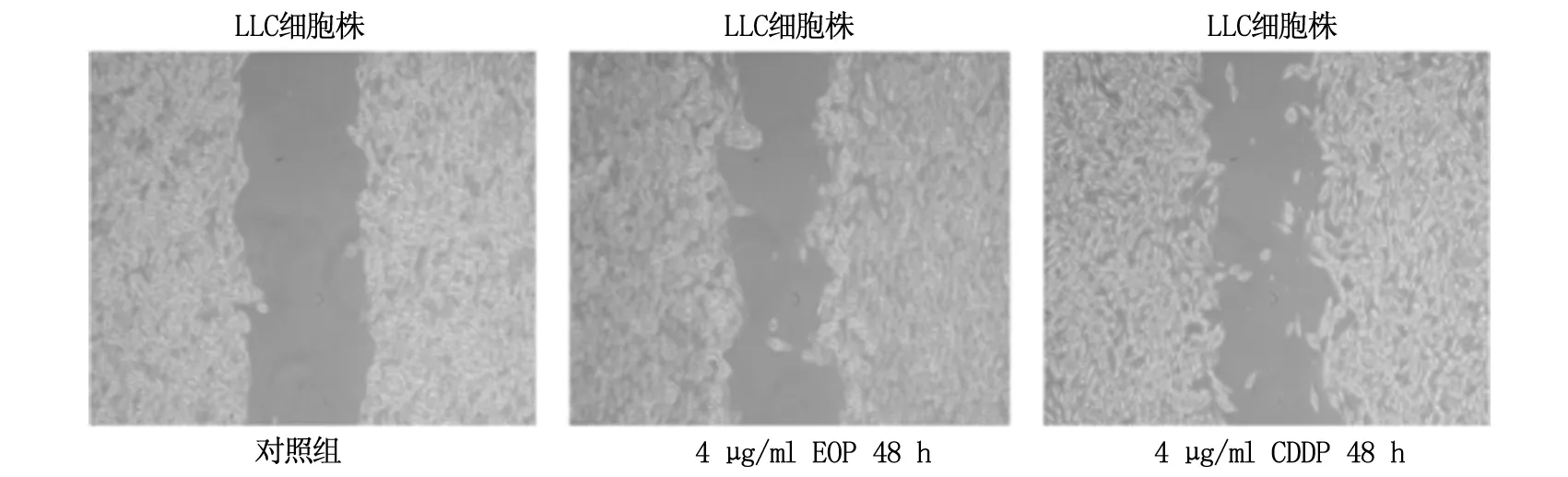
图2 细胞划痕法
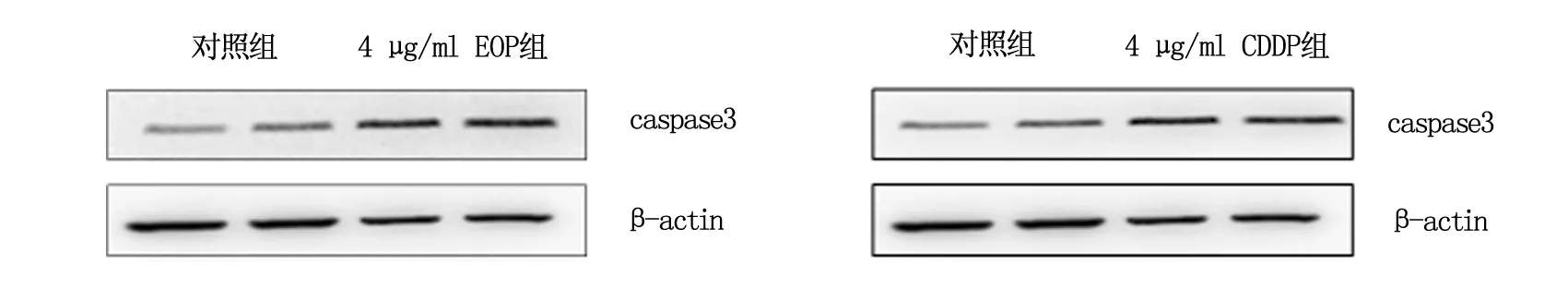
图3 Western blot法检测caspase-3蛋白表达水平
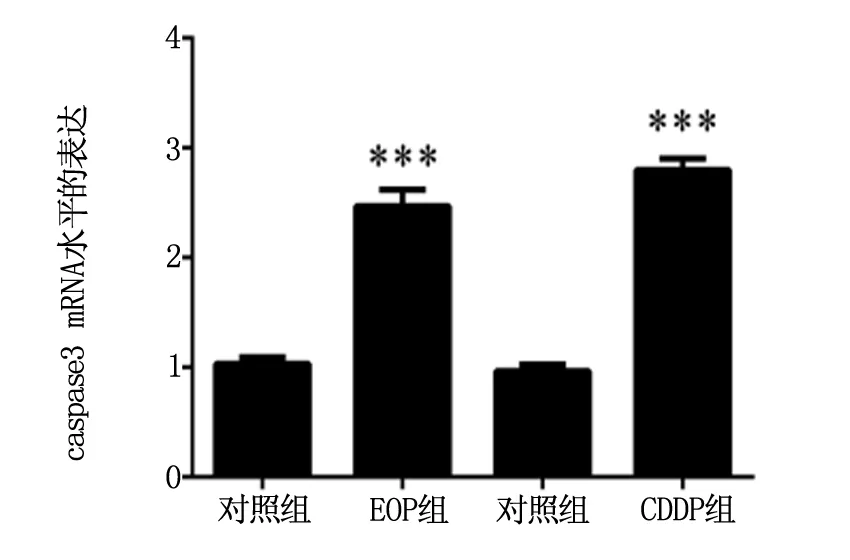
图4 RT-PCR法
3 讨论
肺癌是近年来严重威胁人类生命和健康的恶性肿瘤,它的发病率居重症疾病首位,也是死亡率极高的恶性肿瘤。近50年来肺癌的发病率和死亡率明显增高,发达国家更为明显,我国肺癌发病也呈增长趋势,近20年来每年肺癌新发病例以大约0.5%的速度增长,死亡率增加了近1.5倍,是增长最快的恶性肿瘤。
恶性肿瘤在化疗上的风险在于一旦治疗方案失败,将产生多药耐药,患者生存期将减少,生活质量下降。然而杜仲在抗肿瘤作用的具体作用机制目前尚不清楚。现有的研究仅表明,EOP具有清除氧自由基,提高机体的抗氧化能力,减轻细胞损伤,减少过氧化产物丙二醛(MDA)的产生、增强超氧化物歧化酶(SOD)、谷胱甘肽(GSH)的作用。其具体机制尚有待深入研究[8-9]。
细胞凋亡过程的紊乱与肿瘤的发生发展密切相关。凋亡的调控基因很重要的家族是Caspase3超家族[10]。Caspase3在许多恶性肿瘤中高表达,抑制肿瘤细胞凋亡,研究Caspase3的表达情况对肿瘤的治疗和预后有重要意义[11-12]。
本研究中发现:EOP和CDDP抑制LLC细胞和KMB-17细胞增殖的最佳作用浓度为4.0 μg/ml,最佳作用时间为48 h。细胞划痕实验结果显示,EOP和CDDP均可显著抑制肿瘤细胞LLC的侵袭迁移,划痕细胞覆盖率降低。RT-PCR和western blot 结果显示,EOP组的caspase3的mRNA水平和蛋白水平的表达均显著高于对照组。与王强等[6]的发现一致,caspase3在肺癌组织中表达升高,杜仲总多糖EOP可抑制肺癌细胞LLC的增殖,并且是通过诱导caspase3途径活化,促进细胞凋亡,从而抑制肿瘤的继续扩增,为杜仲总多糖在临床的应用提供了扎实的理论研究基础。

