高营养全谷物燕麦浓浆的复合酶解工艺优化
刘先隆,刘磊,赖婷,魏振承,马永轩,张名位
(1.华南师范大学生命科学学院,广东广州 510631)(2.广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广东广州 510610)
燕麦又称为野麦、雀麦,是一种营养健康和医疗价值突出的谷物,其含有丰富的β-葡聚糖、纤维素和混合交联阿拉伯木聚糖等膳食纤维成分[1],还富含酚类化合物、不饱和脂肪酸、蛋白质、矿物质和维生素[2]。燕麦胚乳细胞壁多糖的一个重要结构是β-葡聚糖,能降低血中胆固醇含量和血脂含量,有效减缓糖尿病症状[3],其主要有葡萄糖分子以β-(1,4)和β-(1,3)糖苷键连接而成[4]。燕麦中的可溶性β-葡聚糖与人体的M细胞、肠道细胞和集散控制系统有着非常密切的联系,进而改善肠道免疫功能,维持肠道稳态[5]。燕麦中的酚类物质主要包括酚酸、燕麦蒽酰胺和类黄酮素等[6],已有大量研究表明酚类物质具有抗氧化活性,可以预防慢性疾病,具有降血糖、降血脂等生理功能[7]。
燕麦是富含可溶性β-葡聚糖的谷物,目前已有许多关于燕麦加工的前处理工艺、风味的研究。已有报道证明,酶解处理能提高谷物中的可溶性膳食纤维含量和游离酚含量[8,9]。因此,可以利用酶解处理的方法来提高燕麦中的可溶性膳食纤维含量及游离酚含量,从而更充分地提高燕麦中营养成分的生物利用率。陈中伟等[10]研究了β-葡聚糖和酚酸在燕麦麸皮(果皮+种皮+糊粉层)和胚乳中的分布,发现β-葡聚糖富集在麸皮中,达8.57%,约是胚乳中浓度的4.5倍;麸皮中p-香豆酸和阿魏酸的含量分别达 0.098和 1.00 mg/g,分别是胚乳中相应含量的24倍和48倍。蛋白质和淀粉及其他物质与纤维素相连接组成细胞壁,降低了可溶性膳食纤维的含量[11]。付晓燕等[12]人采用中温α-淀粉酶和有机溶剂提取燕麦多酚物质,结果表明和有机溶剂提取法相比较,经过中温α-淀粉酶辅助提取的多酚提取率提高58.38%。徐康[13]通过糖化酶和淀粉酶水解燕麦,显著增加了燕麦饮料中可溶性固形物含量,但没有考察燕麦酶解后酚类物质和β-葡聚糖的含量变化。
燕麦饮料的研制过程中发现,燕麦浓浆不利于溶解,而通过酶解处理能够很好的降低燕麦溶解的稠度,还能提高燕麦的营养价值,因此,本研究比较了不同前处理后燕麦可溶性β-葡聚糖含量的影响;以游离酚含量和可溶性β-葡聚糖含量为综合考察指标,比较经不同酶处理对燕麦酶解效果的影响;通过响应面实验设计优化,以综合模糊评判值为指标,燕麦复合酶解的工艺条件,旨在为开发全谷物燕麦浓浆性饮料提供指导。
1 材料与方法
1.1 原材料与试剂
燕麦从广州市天河区的超市采购。β-葡聚糖标品、刚果红购买自广州市齐云生物技术有限公司;没食子酸、福林酚试剂均购自美国Sigma公司;中温α-淀粉酶(100000 U/g,最适pH 6.5)、高温α-淀粉酶(100000 U/g,最适pH 5.8~6.8)、酸性蛋白酶(50000 U/g,最适pH 3.0)、中性蛋白酶(50000 U/g,最适pH 7.0)、纤维素酶(5000 IU/g,最适pH 4.5)购自尤特尔生物技术有限公司,等级均为食品级;其它试剂均为国产分析纯。
1.2 主要仪器设备
UV-1800型紫外可见分光光度计,日本岛津公司;Eyelan-1100旋转蒸发仪,东京理化器械株式会社;TD6离心机,长沙湘智离心机仪器有限公司;M200型多功能酶标仪,瑞士Tecan科技有限公司;DS30-Ⅱ型双螺杆膨化机,山东赛信膨化机械有限公司;XFB-1000中药粉碎机,吉首市中诚制药机械厂;XDW-6BI超微粉碎机,济南达微机械有限公司。
1.3 实验方法
1.3.1 不同前处理对燕麦中可溶性β-葡聚糖含量的影响
将燕麦磨成粉后过60目筛。筛选出提取可溶性β-葡聚糖含量最大的前处理工艺。条件如下:
(1)烘烤工艺条件:燕麦经150 ℃烘烤40 min至呈现均匀的黄色。烘烤时经常翻动燕麦,使燕麦烘烤均匀并防止烤焦。燕麦烘烤后水分含量约为5~6%。
(2)挤压膨化工艺条件:参考张冬媛[14]等人的方法并稍有改动。挤压膨化机前端、中端和末端温度分别60 ℃、95 ℃和130 ℃,螺杆转速为300 r/min。燕麦挤压烘烤之后水分含量约为6%~7%。
(3)高温α-淀粉酶耦合挤压膨化工艺条件:酶添加量为0.3%,挤压膨化条件同上。
(4)超微粉碎工艺条件:燕麦于超微粉碎机中粉碎时间为60 s/次,共2次,温度-4 ℃,燕麦超微粉碎后水分含量约为13%~15%。
1.3.2 不同酶处理对燕麦中可溶性β-葡聚糖和酚含量的影响
以可溶性β-葡聚糖含量和游离酚含量为指标,考察不同酶(酸性蛋白酶、中性蛋白酶、中温α-淀粉酶和纤维素酶)处理燕麦中β-葡聚糖含量和游离酚含量的影响。酶解前,燕麦中可溶性β-葡聚糖含量和游离酚含量分别为 2.12±0.02 mg/g DW 和 51.28±0.04 mg/100 g DW。酶解温度为50 ℃、酶解时间2 h,以下为不同酶的添加量:
(1)中性蛋白酶添加量(pH=7)为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%。
(2)酸性蛋白酶添加量(pH=3)为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%。
(3)中温α-淀粉酶(pH=6.5)为0.05%、0.1%、0.15%、0.2%、0.25%、0.3%。
(4)纤维素酶(pH=4.5)为0.02%、0.04%、0.06%、0.08%、0.12%、0.14%。
1.3.3 不同酶解条件对复合酶解燕麦中β-葡聚糖和酚含量的影响
(1)酶解温度:设定酶解pH为7,酶解时间为2 h,料液比为1∶10,酶解温度:35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃。
(2)酶解pH:设定酶解温度为50 ℃,酶解时间为2 h,料液比为1∶10,酶解pH:5.5、6、6.5、7、7.5、8。
(3)酶解时间:设定酶解温度为50 ℃,酶解pH为6.5,料液比为1∶10,酶解时间:0.5、1、1.5、2、2.5、3。
(4)料液比:设定酶解温度为50 ℃,酶解pH为 6.5,酶解时间为 2 h,料液比:1∶5、1∶10、1∶15、1∶20、1∶25、1∶30。
1.3.4 复合酶酶解燕麦工艺优化试验
在单因素实验基础上,选择影响显著的单因素pH、温度、料液比和时间为自变量,β-葡聚糖含量和游离酚含量计算得到的模糊评判值为响应值,设计响应面分析实验。其因素水平编码表见表1。
1.3.5 计算模糊综合评判值Y的方法
参考李杨等[15]人方法。采用模糊综合评判法对燕麦复合酶酶解工艺进行双指标综合评判,评价因素集U={β-葡聚糖含量、游离酚含量}={Z1、Z2},评价函数为Y。
Z1、Z2的函数关系如下:

将实验数据带入相应的评价函数,得到评价矩阵,评价函数Y为:

注:Y2-模糊评价结果;γj-权重系数;i=1,2,3…,j-权重编号,j=1,2。
综合考虑实验指标的重要程度,分配权重选取为γ={0.50,0.50},即γ1表示游离酚含量权重系数,γ1=0.50,γ2表示β-葡聚糖含量权重系数,γ2=0.50。
1.3.6 测定方法
1.3.6.1β-葡聚糖含量测定
参考张娟等[16]人的方法并稍做改动。称取1 g燕麦+10 mL蒸馏水→搅拌均匀→70 ℃水浴 30 min→5000 r离心5 min→取上清液1 mL+1 mL蒸馏水+4 mL刚果红溶液→室温下反应10 min。蒸馏水做空白对照,配制不同浓度梯度的β-葡聚糖标准品制作标准曲线。测定重复3次。刚果红溶液的配制方法:称取0.02 g刚果红并溶解于0.1 mol/L的磷酸缓冲液中(pH=8),定容至200 mL。
1.3.6.2 游离态含量测定
参考Xu等人[17]的方法并稍做改动。准确称取50 g酶解液,5000 r/min离心10 min,取上清定容至50 mL,然后用6 mol/L盐酸调pH至3.0,上清液用乙酸乙酯萃取(1∶2,V/V),合并5次乙酸乙酯萃取相,在45 ℃条件下旋蒸至干,用超纯水溶解残余物,定容至10 mL。取0.125 mL游离酚提取液装入10 mL试管中,加入福林酚试剂0.125 mL和蒸馏水0.5 mL,混匀后在室温下静置反应6 min,之后加蒸馏水1 mL和7%(m/V)Na2CO3溶液1.25 mL,混匀后室温避光静置反应90 min,760 nm处测定吸光值。采用不同浓度梯度的没食子酸标准品制作标准曲线,重复测定3次。总酚含量以每100 g燕麦(干基)中所含没食子酸当量(mg gallic acid equivalents/100 g dry weight)表示,简写为mg GAE/100 g DW。
1.3.7 数据统计分析
采用SPSS 19软件检验分析比较实验各组间均值差异显著性(p<0.05),响应面试验采用Design expert软件处理。
2 结果与分析
2.1 不同前处理对燕麦中可溶性β-葡聚糖含量的影响
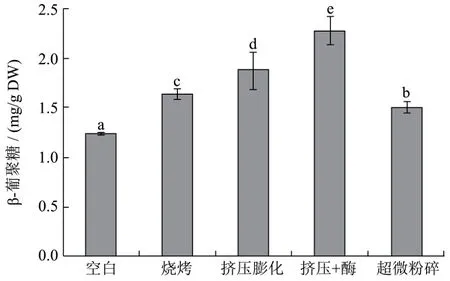
图1 不同前处理工艺对燕麦中β-葡聚糖含量的影响Fig.1 The effect of different pretreatment methods on the contents of β-glucan in oat
由图1可以看出,空白组燕麦的可溶性β-葡聚糖含量为1.23±0.02 mg/g DW,经四种前处理后均显著提高可溶性β-葡聚糖含量(p<0.05)。其中,高温α-淀粉酶耦合挤压膨化效果最好,燕麦中可溶性β-葡聚糖含量增加 83.73%;超微粉碎处理增长最低为21.13%。四种前处理方式效果显著大小顺序为:高温α-淀粉酶耦合挤压膨化>挤压膨化>烘烤>超微粉碎。
2.2 不同酶处理对燕麦中β-葡聚糖和游离酚含量的影响

图2 不同酶处理对燕麦中β-葡聚糖含量和游离酚含量的影响Fig.2 The effect of different enzymes on the contents of β-glucan and free phenolics
由图2可以看出,随着中性蛋白酶的增加,燕麦中β-葡聚糖含量和游离酚含量都逐渐增加,添加量增加至0.4%维持稳定;中温α-淀粉酶增加时,游离酚含量逐渐增加,添加量至0.2%以后维持稳定,β-葡聚糖含量并无显著性变化,综合模糊评判值呈上升趋势。添加酸性蛋白酶后β-葡聚糖含量和游离酚含量并无显著性变化;纤维素酶添加量的增加时燕麦中β-葡聚糖含量呈下降趋势,综合模糊评判值呈持续下降趋势。
2.3 复合酶解条件对燕麦中β-葡聚糖含量和游离酚含量的影响
由图3可知,随着酶解温度的提高,β-葡聚糖含量呈先增加后降低的趋势;游离酚含量在低温时稳定,55 ℃后开始下降。温度为50 ℃时,其模糊评判值最高为89.07,因此最适酶解温度为50 ℃。在pH为6.5时,其模糊评判值最高为85.63,最适pH值为6.5。
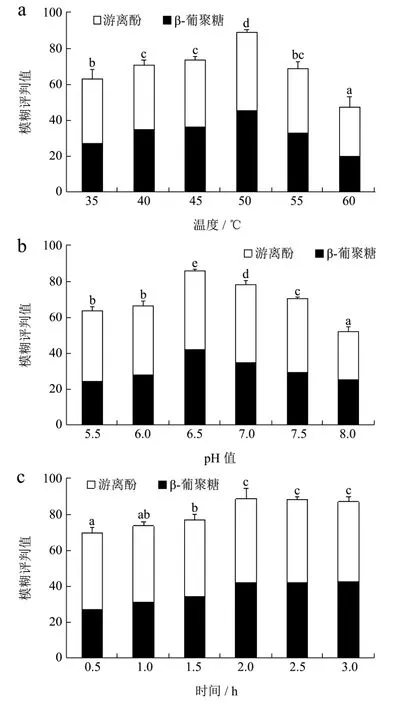

图3 燕麦复合酶解条件对β-葡聚糖含量和游离酚含量的影响Fig.3 Effects of compound enzymolysis conditions on theβ-glucan and free phenolics in oat
酶解时间延长后,β-葡聚糖含量和游离酚含量均逐渐增加,2 h时β-葡聚糖含量和游离酚含量最高并保持稳定,模糊评判值为88.86,因此最适酶解时间为2 h。综合模糊评判值随加水比例的增加,呈先增加后降低的趋势,在料液比为1∶10时,其模糊评判值最高为88.26,因此最适料比为1∶10。
2.4 燕麦复合酶解工艺响应面优化
2.4.1 优化方案与结果
X1、X2、X3和X4分别表示pH、温度、料液比和时间,并以-1、0、+1代表各个因素的高、中、低水平。以β-葡聚糖含量和游离酚含量计算得到的模糊评判值作为响应值Y。因素水平编码表见表1,实验方案及结果见表2。

表1 响应面设计中的实验因素和编码水平Table 1 Experimental factors and coding levels in response surface design

表2 响应面优化实验方案与结果Table 2 The scheme and result of response surface optimization experiment

23 0 1 0 1 2.95 561.90 76.91 24 0 1 1 0 2.93 595.00 78.99 25 0 -1 0 1 3.04 606.67 83.21 25 0 -1 0 1 3.04 606.67 83.21 26 1 -1 0 0 2.86 565.95 76.08 27 0 0 0 0 3.37 623.57 86.47 28 -1 0 0 1 2.77 574.05 75.54 29 -1 0 -1 0 2.49 590.71 73.24
2.4.2 响应面结果分析
通过响应面设计软件design expert 8.06进行数据分析,建立二次响应面回归模型:
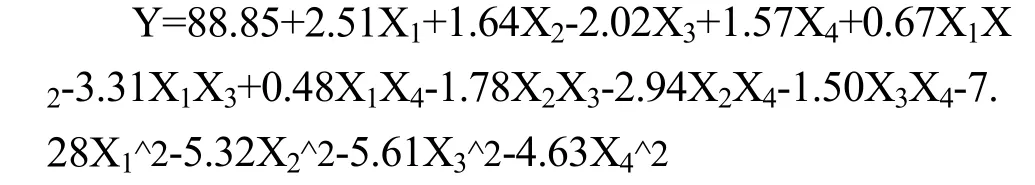
注:X1、X2、X3、X4-因素水平编码值;Y-模糊评判值。
回归与方差分析结果见表 3。从表中可以看出,回归模型p<0.0001,说明回归模型达到极显著水平;失拟项p=0.1902>0.05,说明该模型是合适的。相关系数 R2=0.9415,说明该二次回归方程能够很好地拟合各因素与模糊评判值之间的关系,可利用该回归方程确定复合酶解燕麦的最佳工艺。对各项F值检验可知,pH、温度、时间和料液比及其二次项均为显著影响因素(p<0.05),温度与时间交互项和pH与料液比交互相p<0.01,为极显著影响因素(图4和图5)。四个因素的贡献率顺序为:pH>料液比>温度>时间。
各因子临界优化结果见表 4,将临界值优化结果带入方程(3)中模糊评判值为89.74。
2.4.3 验证试验结果
由响应面优化结果可得知,当pH为6.6,温度为51 ℃,料液比为1∶8,时间为2 h时,预测模糊评判值为89.74。经过三次验证实验β-葡聚糖含量为3.18±0.28 mg/g DW,游离酚含量为65.71±5.96 mg/100 g DW,模糊评判值为86.49。与预测值间相对误差为3.58%,因此实际生产过程中应用该模型进行预测是可行的。
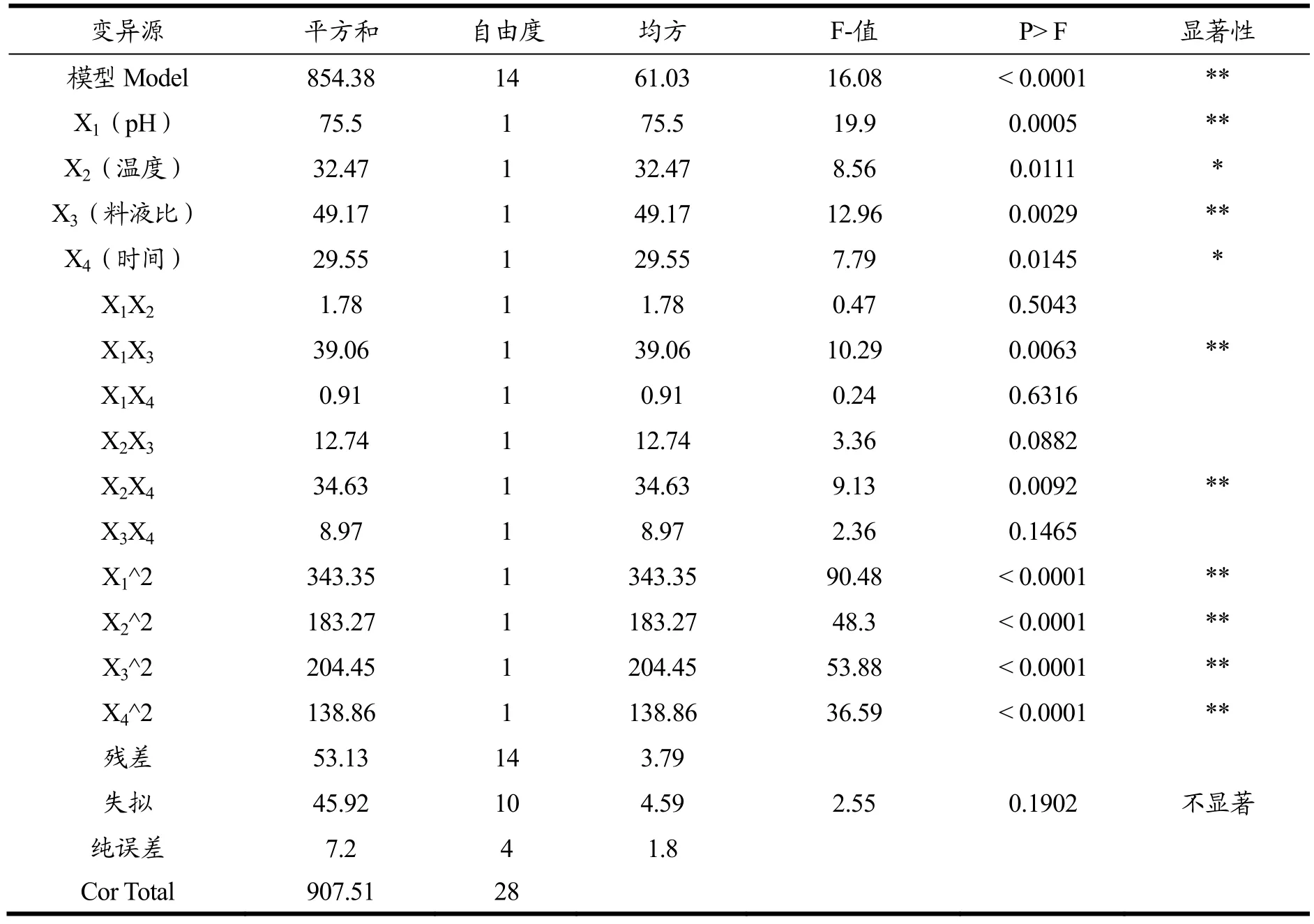
表3 回归模型方差分析Table 3 Results of regression and variance analysis
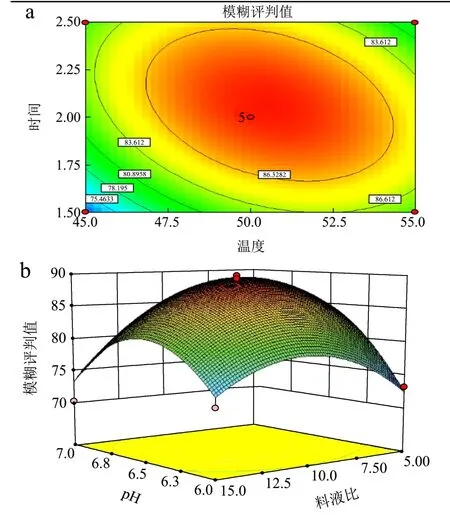
图4 pH与料液比的交互作用对酶解液中β-葡聚糖含量和游离酚含量的影响Fig.4 Interaction of pH value and the solid-liquid ratio on the content of β-glucan and free phenolics in oat hydrolysate
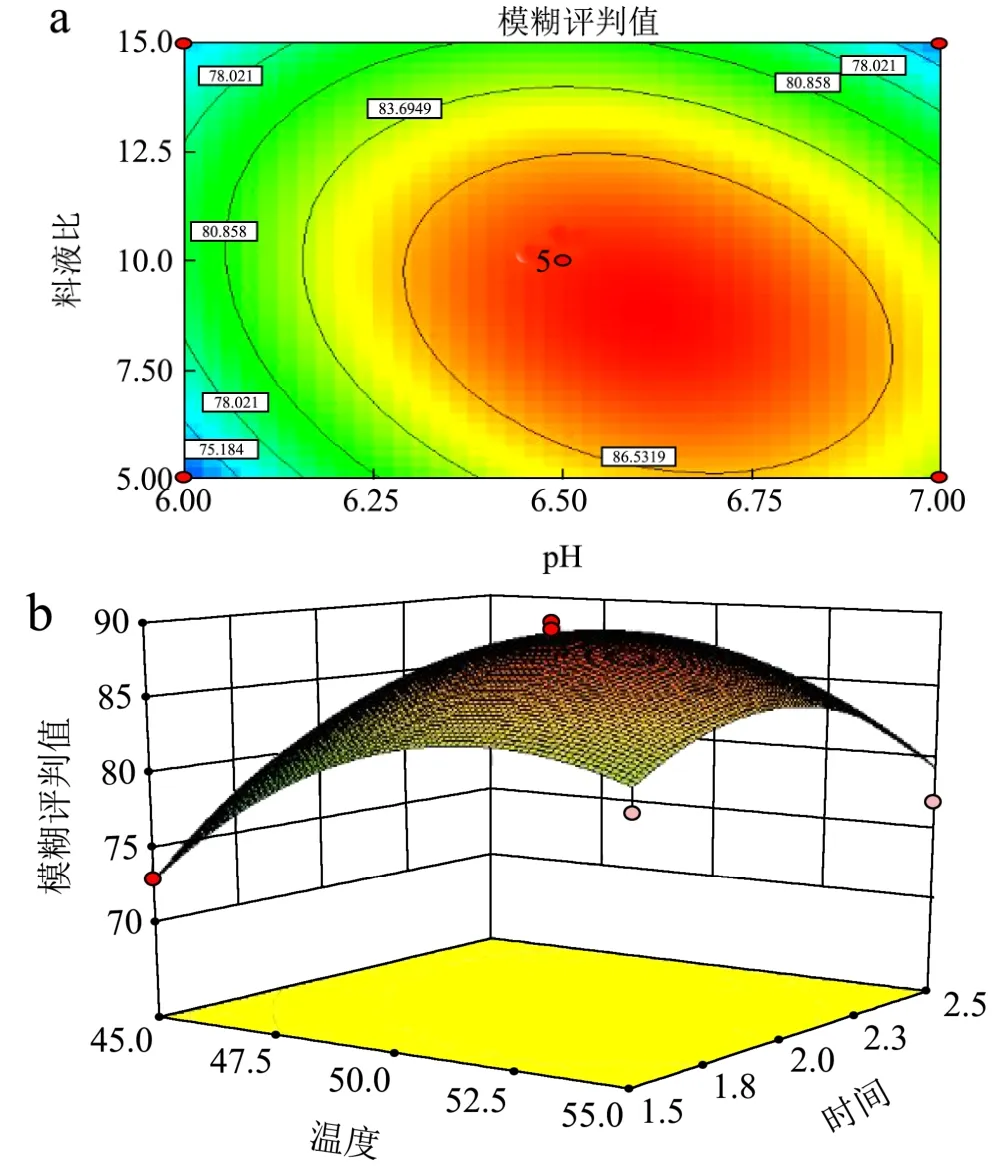
图5 温度与时间的交互作用对酶解液中β-葡聚糖含量和游离酚含量的影响Fig.5 Interaction of temperature and time on the content of β-glucan and free phenolics in oat hydrolysate

表4 因子的临界值优化结果Table 4 Critical value optimizations for factors
3 结论
3.1 燕麦是一种有食用价值和医疗价值的的作物,有着重要的生理功能。宁鸿珍等[18]研究表明,燕麦β-葡聚糖可降低血液中血脂水平,调节脂质代谢的紊乱,减少氧自由基的生成,对于防止高脂血症诱发的动脉粥样硬化病变具有重要的意义。
3.2 目前,我国大部分燕麦主要被加工成为燕麦粉、燕麦片、燕麦饮料以及燕麦饼干,通过不同的加工方式和酶解方法提高燕麦营养成分含量和改善燕麦理化特性。汪丽萍等[19]研究发现,α-淀粉酶酶解燕麦后的浆中糖组分以葡萄糖和麦芽低聚糖为主,糖化酶酶解的燕麦浆中糖组分几乎全部为葡萄糖,α-淀粉酶酶解的浆液酶解效果和稳定性均优于使用糖化酶的浆液。王金华等[20]人发现挤压膨化处理后大麦麸皮中可溶性β-葡聚糖提高28.35%。本研究结果表明,燕麦经烘烤、挤压膨化、α-高温淀粉酶耦合挤压膨化和超微粉碎处理均能显著提高可溶性β-葡聚糖含量。有文献报道,燕麦中存在內源β-葡聚糖酶(如内切β-1,3-葡萄糖酶等),能使β-葡聚糖在提取时被降解[21]。烘烤和挤压膨化处理由于高温使內源β-葡聚糖酶失活,从而提高可溶性β-葡聚糖的含量。
3.3 为解决高营养燕麦溶解后浓浆粘稠度高,不利于燕麦饮料营养价值最大化和口感舒适,本研究从中性蛋白酶、酸性蛋白酶、中温α-淀粉酶、纤维素酶四种酶比较酶解燕麦效果,结果表明,中性蛋白酶能显著提高燕麦中可溶性β-葡聚糖含量(p<0.05)。其原因可能在于中性蛋白酶的作用下,蛋白质分解使细胞壁结构破坏,释放出可溶性的膳食纤维。申瑞玲[22]等人通过在乙醇中加入蛋白酶来提高燕麦β-葡聚糖的提取率,发现β-葡聚糖的提取率随蛋白酶添加量的增加而增加,这与本研究结果一致。
3.4 燕麦具有抗氧化和抗炎症的生理功能。近年来研究报道燕麦可降低患冠心病、糖尿病和癌症的风险[23,24]。其主要功能成分除具有丰富的β-葡聚糖外,还富含酚类抗氧化物,如以游离态或结合态存在的阿魏酸、咖啡酸、香豆酸和香草醛等[25]。武娇等[26]研究发现利用微波加热提取可以显著提高燕麦麸皮中的总多酚的提取效率,提取物具有较强的抗氧化活性。本研究结果表明,随中温α-淀粉酶和纤维素酶添加量的增加其游离酚含量显著提高(p<0.05)。马永强[27]等人利用纤维素酶酶解蓝莓果浆,酶解后发现花色苷的含量提高2.17倍,总酚含量提高1.95倍。其原因可能在于纤维素酶和中温α-淀粉酶对燕麦细胞壁上的纤维素和淀粉进行了水解,进而释放出结合的酚类物质。因此,纤维素酶和中温α-淀粉酶酶解燕麦后,燕麦中游离酚含量上升。
3.5 本研究采用可溶性β-葡聚糖含量和游离酚含量为综合指标建立模糊综合评判模型,优化确定了燕麦经挤压膨化耦合α-高温淀粉酶前处理,再经中性蛋白酶和中温α-淀粉酶(2∶1)复合酶解的工艺条件。在此条件下燕麦中可溶性β-葡聚糖含量为3.18±0.28 mg/g DW,游离酚含量为65.71±5.96 mg/100 g DW,本研究可以为开发高营养全谷物燕麦浓浆饮料提供指导。

