海产干货中克罗诺杆菌污染分布调查及生物学特性研究
姚帮本, 焦 芮, 叶应旺
(1.安徽省产品质量监督检验研究院,安徽合肥 230051;2.合肥工业大学食品科学与工程学院,安徽合肥 230009)
克罗诺杆菌(Cronobacter spp.)属于肠杆菌科,是一种革兰氏阴性、周身鞭毛、无芽孢兼性厌氧粗短杆菌。该菌在生活中较为常见,主要寄生于人和动物的肠道中,易引发新生儿脑膜炎、菌血症及坏死性小肠结肠炎等严重疾病[1-3]。至2002年,美国流行病调查数据表明,新生儿感染克罗诺杆菌的概率为十万分之一,而感染后的死亡率达到20% ~50%[4-5]。克罗诺杆菌具有极强的逆境耐受性,在自然界中的分布极其广泛,从多种食物原材料、半成品、生产器材等中都分离到该菌[5-9]。截止目前,克罗诺杆菌在自然界的污染来源仍不清楚,因此,开展不同食品中的污染调查及预防控制,对保障食品安全意义重大。
克罗诺杆菌生物膜形成是其在载体表面生活时所采取的一种独特的生活方式,它是细菌在不利环境中自我保护的一种本能反应[10]。鞭毛是细菌的主要运动器官,细菌往往通过它移向更适宜生长的环境,避开一些有害无益的影响因子[10]。菌膜的形成与鞭毛运动性都会使细菌朝着更加耐药、更加易繁殖的方向发展,所以这两者之间的相关性日益受到重视[11]。有关鞭毛运动特性促进细菌菌膜形成的相关报道已有很多。研究发现,运动缺陷型的铜绿假单胞菌在其菌膜形成的初始阶段黏附载体的能力有所下降[12]。进一步研究发现,生物膜形成能力下降是由于突变基因PA5017抑制了该菌鞭毛运动性与趋化信号转导通路[13]。除此之外,在枯草芽孢杆菌、创伤弧菌及大肠埃希菌的突变株中均发现这种由于鞭毛运动缺陷而导致菌膜形成障碍的实例[14-16]。本研究主要对合肥各大超市中水产品进行随机抽样,运用改良的国标方法及16S r RNA基因鉴定方法确定其中克罗诺杆菌的检出率,研究分离菌株的生物膜形成能力与菌株鞭毛运动性之间的关系。克罗诺杆菌菌膜的形成是一个复杂的过程,鞭毛的运动特性是否与生物膜的形成有着某些必然联系还待考证。
1 材料与方法
1.1 试剂与材料
试剂:缓冲蛋白质胨水(BPW)、改良月桂基硫酸盐胰蛋白胨(mLST)、胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)、营养肉汤(NB)、酵母提取粉、琼脂粉、D型葡萄糖,均购自北京陆桥技术有限责任公司;结晶紫、乙酸,购自国药集团化学试剂有限公司;2.5%戊二醛固定液,购自北京雷根生物技术有限公司;PCR mix、TAE缓冲液、溴化乙啶,购自上海生工生物工程有限公司;DNA marker(DL 2000)、DNA提取试剂盒,购自天根生化科技有限公司;LIVE/DEAD baclight bacterial viability kit试剂盒,购自Thermo Fisher Scientific公司。
材料:水产干制品,购自合肥市各大超市;96孔细胞培养板、24孔细胞培养板,购自上海百研生物技术有限公司。6 mm×6 mm细胞爬片,购自晶安生物有限公司。
1.2 仪器与设备
10.0 ~1 000.0μL各种规格移液枪,深圳市福田区铭川仪器仪表经营部;酶标仪,美国Thermo公司;LMS710型激光共聚焦显微镜,德国Zeiss公司;Bio-rad型梯度PCR仪、LDZX-30KBS型高压灭菌锅,上海申安公司;SCILOGEX型台式离心机,美国赛洛捷克公司;UTP-313型电子天平,上海菲克苏公司;JB-CJ-1FD型超净台,苏州苏净公司;天能凝胶成像仪、SU8020型场发式扫描电镜,日本日立公司;ZHWY-103B型摇床,上海智城公司;DHG-9070A型电热鼓风干燥箱,上海昕仪公司;电子游标卡尺,上海美耐特有限公司;SHP-80型恒温培养箱,上海森信公司。
1.3 实验方法
1.3.1 样品调查方案
采样时间:2015年6月29日—9月10日;采样地点:安徽省合肥市各大型超市。
共6批次120份样品,主要为超市中散装与包装的干制海产品。
计划采样的前一天,配制实验所需的各种培养基以及对一些处理样品的必需品进行灭菌。早上9时去超市采样,此时超市刚开始营业,可以尽可能排除一些人为及环境因素的影响。
样品的预处理:采样后及时将其带回实验室,首先进行编号,随后裁样(有些干制水产品很大,需将其用灭过菌的剪刀剪成小块),再装入无菌的密封袋中进行密封保存。需要保存在相对低温且干燥的地点,以待下一步鉴定时使用。
1.3.2 样品中克罗诺杆菌污染检测
克罗诺杆菌的筛选检测流程依照 GB 4789.40—2016[17]中阪崎肠杆菌微生物学检验国家标准进行。由于调查样品的特殊性及对实验的特殊要求,对检测标准的某些细节进行了更改。操作步骤如下:
1)增菌。无菌环境下准确称取3.0 g样品,加入到50 mL BPW中,放在100 mL的三角瓶中摇匀,随后放置在180 r/min摇床中,37℃下培养20 h。
2)初步筛菌。将万古霉素(1 mg/mL)经过0.22μm孔径的水系滤膜过滤,按照国标与月桂基硫酸盐培养基混合。取1 mL 1)中的增菌液转移至10 mL mLST中,放置于摇床中以180 r/min,44℃恒温培养24 h。
3)分离。取上一步的培养物在克罗诺杆菌显色培养基平板上划线,放置在37℃的恒温培养箱中培养18 h。观察显色培养基平板上是否存在呈蓝绿色的典型菌落。
4)鉴定。在每个显色培养基平板中间位置挑取1~5个典型及可疑菌落进行甘油保存。
5)菌落PCR。取筛选出的菌种于TSA上划线过夜培养,用牙签挑取少量单菌落于EP管中。挑取菌体不易过多,EP管中可见淡淡痕迹即可,挑取菌体量过多反而易干扰实验,造成非特异性扩增等不良后果。
6)PCR反应体系及电泳条件。PCR反应基于gluA基因设计引物[18]。 E-F:5'-ggcggagccgaataactg-3';E-R:5'-cgtgccctgcatgagaaaa-3'。
PCR反应循环参数:94℃,预变性10 min;94℃,变性45 s,58℃,退火45 s,72℃延伸1 min,共35个循环;72℃,延伸7 min结束反应。
PCR体系组成:2×Taq PCR Master Mix(20 μL),E-F和E-R各0.2μmol/L,模板DNA 1μL,双蒸水17μL。
电泳条件:取菌落 PCR的扩增产物5μL及DNA Marker 5μL,点样于含有核酸染料溴化乙啶的1%琼脂糖凝胶梳子孔中,加入1×电泳缓冲液TAE,120 V电泳约为20~30 min,通过凝胶成像仪观察,并进行测序鉴定。
1.3.3 分离菌株的生物学特性研究
1.3.3.1 分离菌株菌膜形成能力测定
将1.3.2中鉴定出的克罗诺杆菌分离株经过TSB的扩增培养后,在TSA上划线后放置在恒温培养箱37℃倒置培养,随后挑取单菌落接种于5 mL的TSB中进行过夜活化。取分离株过夜活化后的菌液以1∶100的比例与新鲜TSB混合,混合均匀后转移至96孔细胞培养板中培养,每孔加样200μL。每种浓度均在37℃恒温培养箱中培养24、48、72 h。每种浓度重复3~6次,并设置无菌液的新鲜培养基为空白对照组。培养后的96孔细胞培养板的处理步骤如下:
1)弃去96孔细胞培养板中的培养液,使用无菌生理盐水反复清洗未贴壁的浮游细菌3次;
2)将清洗好的细胞培养板置于60℃的恒温鼓风烘箱中固定1 h;
3)在固定好的细胞培养板的每个处理孔中加入200μL的0.1%结晶紫染液(配制好的结晶紫应避光保存)避光染色30 min;
4)将染过色的细胞培养板用0.90%无菌生理盐水清洗3~6次,尽量将染壁的结晶紫洗干净;
5)室温风干后溶解于33%的乙酸中(现测现配现加原则),若不能立刻测量则风干后直接放置于4℃冰箱中;
6)温和震荡细胞培养板并置于酶标仪下测定吸光度,测定波长为590 nm。
1.3.3.2 分离菌株菌膜观察
1)电镜观察分离菌株的菌膜生长情况。将活化过的菌液以1∶100的比例与新鲜TSB混合均匀,转移至24孔细胞培养板中,每孔加入2 mL。24孔细胞培养板预先放入直径为6 mm无菌的细胞爬片作为黏附载体。每种浓度均在37℃恒温培养箱中培养24、48、72 h。每种浓度重复3~6次,并设置无菌液的新鲜培养基为空白对照组。培养结束后,菌膜的扫描电镜样品前处理步骤如下:
①先缓慢沿壁吸取细胞培养板中的培养基后弃去,用无菌PBS轻轻冲洗细胞培养板3次,在清洗过程中可以轻轻晃动培养板洗去浮游菌;
②清洗完毕后加入2.5%戊二醛过夜固定,固定时间不少于6 h;
③将固定后的样品用无菌PBS溶液轻轻冲洗3次;
④乙醇梯度脱水,乙醇的体积分数分别为50%、60%、70%、80%、90%、100%,样品加入每个浓度的乙醇后需脱水放置10 min,每个浓度重复2次;
⑤将乙醇脱水后的样品放置于-20℃冰箱中预冷不少于4 h;
⑥将预冷后的样品置于冷冻干燥机中12 h,取出后放置于干燥器中;
⑦样品喷金100 s后,利用场发式扫描电镜在3 000倍下扫描拍摄。
2)激光共聚焦观察分离株的菌膜生长情况。首先培养分离菌株的菌膜,具体菌膜培养方法及条件参照1.3.3.2中的1)。菌膜激光共聚焦样品前处理步骤如下:
①将培养后3个时间段的各组模型中培养液取出,用无菌的生理盐水轻轻洗涤细胞板中细胞爬片3次,缓慢摇晃除去浮游细菌。
②在细胞培养板中加入配制好的荧光染液(1 mL混合荧光染液的比例为:994μL PBS+3μL染液1+3μL染液2),37℃恒温培养箱避光条件下培养15 min。
③将染色后细胞爬片用无菌生理盐水洗涤3次,洗去染料。
④将处理好的细胞爬片取出,倒置于0.17 mm厚的载玻片上。置于激光共聚焦显微镜下,采用蓝光激发,拍照。Syto9染料呈绿色荧光,表示活菌;碘化丙啶PI染料呈现红色荧光,表示死菌。根据比例可以观察细菌菌落大致形成情况。
1.3.3.3 分离菌株运动能力测定
筛选菌株运动能力的测定主要使用两种培养基,第一种是游动性培养基(swimming motility),第二种是泳动性培养基(swarming motility)。11号分离株过夜扩菌后,在TSA划线培养出单菌落。用牙签轻轻点击单菌落,随后分别点击到swimming motility和swarming motility上,且点击在培养基上的次数必须保证相同。将两种培养基放置在37℃恒温培养箱中进行培养,swimming motility及swarming motility分别培4 h和16 h即可。两种培养基在培养箱中均不可叠加放置。
具体培养基配制如下:
1)游动性培养基(swimming motility)。细菌用胰蛋白胨,10 g/L;酵母提取粉,5 g/L;琼脂粉,0.15%。加蒸馏水定容至1 L,121℃湿热灭菌20 min。需要测定克罗诺杆菌游动性之前,加热凝固的培养基,融化后冷却至50℃左右倒平板,平板的厚度约为4 mm左右,冷却凝固后备用。由于培养基中琼脂粉较少,属于软平板,所以移动平板时需要柔和平稳移动,不可倾斜和倒置。
2)泳动性培养基(swarming motility)。营养肉汤,8 g/L;D-葡萄糖,5 g/L;琼脂粉,0.5%。加蒸馏水定容至1 L,115℃湿热灭菌30 min。需要测定克罗诺杆菌泳动性之前,加热凝固的培养基,融化后冷却至50℃左右倒平板,平板的厚度约为3 mm左右,冷却,干燥过夜,因培养基属于半固体,平板不可倒置。
2 结果与分析
2.1 菌种分离与鉴定结果分析
克罗诺杆菌在显色培养基生长及显色情况见图1。克罗诺杆菌区别于其他肠杆菌的特性之一是该菌具有α-葡萄糖苷酶活性,这种活性会使其在培养基上产生黄色菌落,但与此同时产生的4-硝基苯酚会影响结果[19-20]。Iversen等[21]通过在培养基中加入显色基团Xα-GlcA,配制成克罗诺杆菌的特异性显色培养基,使得该菌在培养基中显蓝绿色(图中圆圈部分)。由图1可见蓝绿色的单菌落,120个调查样品共有37个样品有蓝绿色菌落,此次调查初筛时目的菌株的检出率为30.83%。每个显色培养基中挑取3~5个单菌落过夜活化后用甘油保存。共保存了129个疑似克罗诺杆菌菌落,以待用作后续的鉴定工作。

图1 克罗诺杆菌在显色平板上的蓝绿菌落(圆圈中)形态Fig.1 Shape of Cronobacter spp.on chromogenic medium

图2 克罗诺杆菌属gluA鉴定结果Fig.2 Identification results of gluA for Cronobacter spp.
为防止假阳性与假阴性,因此设置阳性对照与阴性对照,本实验设置了一个已知的克罗诺杆菌G362作为对照。疑似菌株的DNA扩增结果见图2。由图2可见,23个菌株有目的条带(673 bp),检出率为17.83%。陆幸儿等[22]在广东省各超市共328家对10种食物(包括冰淇淋、熟肉、面包、饮用水、调味品、坚果等)进行取样调查,最后检出阪崎克罗诺杆菌54株,总检出率达到6.4%,小于17.83%。两者都是从各大超市随机采集样品,调查结果说明,该菌对海产干制品的污染率较高。海产干制品中含盐量较高,却仍有较高的检出率,这可能与该菌的耐高渗透压有关。Breeuwer等[23]的研究结果表明,克罗诺杆菌确实能耐受极端渗透压和干燥环境。
2.2 分离菌株的生物学特性分析
2.2.1 分离菌株菌膜形成能力分析
细菌形成生物膜是为了适应生存环境而产生的多糖类物质,该物质黏附于载体(生物或非生物)表面,菌体包被于自身所产生的质地不均一的基质中,从而形成一种完全不同于浮游细菌生长模式的细菌群体[10]。这种菌膜结构就如同一种“保护屏障”,对宿主的免疫系统的抵抗性有着显著的影响,是发生慢性感染的因素之一[24]。
23株克罗诺杆菌分离株的菌膜形成能力见图3。由图3可见,编号为11的分离株菌膜形成能力尤为突出。菌膜形成能力的强弱在某种程度上可以表示菌株对外来不利因素的抵抗能力的强弱,因此将编号为11号的分离株待定为后续实验的实验菌株。
2.2.2 11号分离株菌膜形成能力观察
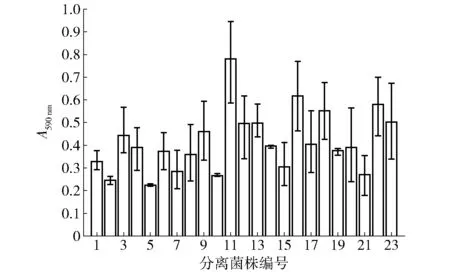
图3 克罗诺杆菌分离菌株菌膜的形成能力Fig.3 Biofilm formation abilities of Cronobacter spp.strains

图4 扫描电镜表征的11号分离株的菌膜形成能力Fig.4 Biofilm formation ability of No.11 strain using scanning electron microscopy
细菌菌膜的形成是一个复杂的动态过程,包括细菌起始的黏附、菌膜黏附期、生长期、成熟期、播散期等一系列阶段[25]。分离株的菌膜形成见图4、图5。由图4与图5可看出,随着时间的不断延长,在一定时间段间,菌膜形成的厚度增加且死菌的比例也逐渐增加。另外还可观察到生物膜中间存在空隙与孔道,有研究认为该孔道为细菌正常新陈代谢的重要通道,分布着多糖和蛋白质等物质[1]。除此之外,由图4可观察到分离株在不同时间段时菌膜的生长情况。24 h时,菌膜形成的初始阶段,菌体大量繁殖并且开始聚集黏附在载体表面;当培养时间达到48 h时,可观察到成片的菌膜,菌膜结构较为稳固,中间的空隙较少,此时菌膜形成量达到最大值;随着时间的继续推移,72 h的培养后,菌膜开始裂解,释放其中的菌体。图5结果基本上与图4一致,24 h时菌体呈鲜绿色,说明此时菌体生长较为旺盛,黏附载体的能力也较强,并开始有成膜的趋势;48 h时开始出现死菌但也是菌膜生成量最大的时候,在激光共聚焦下出现成块和成片的黄绿色菌膜;当11号分离株培养时间达到72 h时,此时Syto9染料所表征的绿色活菌比例下降,而PI所表征的红色死菌比例大大上升,而此时菌膜已经裂解,菌体被释放出来,已无成片完整的黄绿色菌膜。
2.2.3 分离株运动性分析

图5 激光共聚焦显微镜表征的11号分离株的菌膜形成能力Fig.5 Biofilm formation ability of No.11 strain using confocal laser scanning microscopy

图6 克罗诺杆菌分离株的游动性Fig.6 Swimming motilityies of Cronobacter spp.

图7 克罗诺杆菌分离株的泳动性Fig.7 Swarming motility of Cronobacter spp.

图8 克罗诺杆菌在运动培养基中的运动状态Fig.8 Shape of Cronobacter spp.in motility medium
鞭毛是细菌的主要运动器官,细菌的运动往往有一定的趋向性,大多数细菌会依赖鞭毛运动到更适宜生长的方向,从而拥有更充足的营养物质,而避开有害的环境[10]。分离株的运动情况见图6至图8。由图6至图8可知,8号菌株与18号菌株在swimming motility上培养4 h后形成的菌落圈分别达到23株分离株的最大值(55.75 mm)与最小值(32.14 mm);而11号菌株与16号菌株在swarming motility上培养16 h后形成的菌落圈分别达到23株分离株的最大值(14.02 mm)与最小值(7.85 mm)。
鞭毛的运动性与菌体菌膜的形成有一定关系。通过比较8株大肠埃希菌菌毛基因的表达和生物膜形成相关性,发现细菌的运动性与菌膜的形成存在对应关系,运动性越强的菌株,其生物膜形成能力相对越强[16];而Caiazza等[25]研究发现,SadB蛋白缺陷菌株运动能力增强,菌膜形成能力反而减弱。
此次调查取样中,所筛选的23株克罗诺杆菌分离株生物膜形成与其运动能力之间的关系不是很显著,可能是由于克罗诺杆菌菌膜生成情况受到多种因素的影响。鞭毛的运动性虽然在一定程度上可以使菌体朝向高营养物质处移动,尽量避开不利因素,但是在细菌黏结在载体表面时,运动性又会抑制其形成稳定性结构[11]。
3 结 论
抽样调查了120个海产干制样品,运用改良的国标检测方法与分子水平鉴定分离株,发现其中克罗诺杆菌的检出率为17.83%,表明海产干货中克罗诺杆菌具有较高的污染率。进一步研究了23个分离菌株的菌膜形成能力与运动能力之间的关系,结果表明,11号菌株的菌膜形成能力最强并且有较强的运动性,但克罗诺杆菌菌膜形成与其鞭毛运动性之间的关系还未明确,详细的分子机制尚待深入研究。

