一种ACE抑制肽在不同溶液中构象变化的核磁共振
张 钦,宋铖铖,苏盛亿,付颖寰
(1.大连工业大学食品学院,辽宁大连 116034;2.国家海洋食品工程技术研究中心,辽宁大连 116034;3.大连工业大学轻工与化学工程学院,辽宁大连 116034)
高血压是最常见的心血管疾病之一,血管紧张素转化酶(ACE,EC 3.4.15.1)在肾素-血管紧张素系统(RAS)中对调节血压起着关键作用[1]。抑制ACE的活性是降低血压的有效手段,而目前广泛应用的ACE抑制剂往往伴随副作用[2],这可能与ACE抑制肽的构象有关[3]。核磁共振波谱技术是现有的能够测定生物大分子三维空间结构的技术之一[4-5],在测定分子空间构象有着不可替代的重要作用。其中二维核磁共振谱因其相对于一维核磁共振的众多优势而在分析分子空间状态得到运用[6]。NOESY谱表示质子的NOE关系,NOE是一种跨越空间的效应,与核之间的距离有关,当质子间距小于5Å时便可在谱图上观察到[7]。二维图谱中的任何一个交叉峰都表示两个原子之间的距离,利用这样一系列未经指认的距离进行结构推测,从而得到分子的构象状态[8]。
因此,本文以海蜇性腺中分离出的ACE抑制肽SY为基础,通过核磁共振实验研究其在不同溶剂中的构象情况,为后续研究ACE抑制肽SY的空间结构及作用机理提供理论依据。
1 材料与方法
1.1 材料与仪器
Ser-Tyr 纯度99.6%,委托南京莱昂生物科技有限公司合成;重水 氘代度99.8%,北京百灵威科技有限公司;DMSO-d6 氘代度99.9%,含0.03% TMS,上海麦克林生化科技有限公司;氘代甲醇-d4 氘代度99.8%,上海阿拉丁生化科技股份有限公司。
Mettler MS205DU型半微量天平 瑞士梅特勒-托利多有限公司;AvanceⅢ400 MHz核磁共振波谱仪 瑞士Bruker公司。
1.2 实验方法
1.2.1 样品溶液的制备 SY水溶液:精密称取10.00 mg SY粉末于2 mL 塑料离心管中,用1 mL混合溶剂(D2O∶H2O=9∶1)溶解。SY的DMSO溶液:精密称取10.00 mg SY 于2 mL 塑料离心管中,用1 mL含TMS的DMSO溶解。SY的甲醇溶液:精密称取10.00 mg SY于2 mL塑料离心管中,用1 mL的甲醇溶解。超声(40 Hz)至样品完全溶解,转移至核磁样品共振管。
1.2.2 核磁测定条件1H-NMR谱采用zg30脉冲序列在恒温(25 ℃)下检测。实验参数如下:谱宽(SWH):8012.82 Hz,脉冲宽度(P1):14.55 μs,原始数据点数(TD):65536,采样时间(AQ):4.0894465 s,接收增益(RG):20.2,采样次数(NS):16,空扫次数(DS):2,驰豫延迟时间(D1):1 s。NOESY谱测定实验参数设置如下:谱宽(SWH):4000 Hz,接收增益(RG):203,采样次数(NS):16,空扫次数(DS):6。
2 结果与分析
2.1 SY在水溶液中的氢谱与归属分析
二肽SY的化学结构式和原子编号如图1所示,SY在水溶液中的一维氢谱如图2所示,其H原子的归属如表1所示。重水上的重氢与SY上的OH、COOH、NH活泼氢相互质子交换,在一维氢谱中δ4.7附近出现氘代水的质子吸收峰[11]。Tyr-H-8(1)和Tyr-H-8(2)虽然连在同一C原子上,由于该C原子相邻的原子环境不同,导致Tyr-H-8中的一个H原子更靠近-CO,使峰产生分裂进而在δ2.96、δ3.13左右产生两对双峰。Ser-H-2由于连接电负性比较大的-COOH,在δ3.8左右产生一组四重峰。Ser-H-4周围相邻氢所处的环境不同,Ser-H-4上的亚甲基在δ 3.9和δ4.0左右产生两组分裂峰。Tyr-H-7连接电负性较大的-COOH,但由于其化学位移与重水的溶剂峰接近,因此产生的四重峰与重水的溶剂峰重叠。Tyr-H-14,15,16,17这四个位于芳香族上的H,由于苯环的共轭作用,降低了周围的电子云密度[19],从而在δ 6.8与δ7.1左右产生两对双峰。Tyr-H-6由于连着电负性较大的-CO,核外电子云密度降低,产生最大的屏蔽效应,在δ8.5左右产生一组双峰。
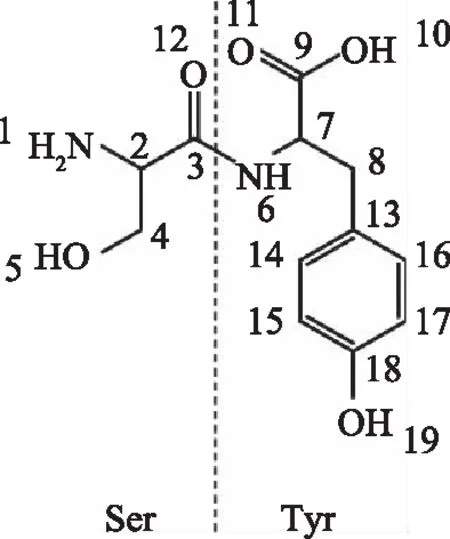
图1 SY化学结构式图Fig.1 Chemical structure of SY
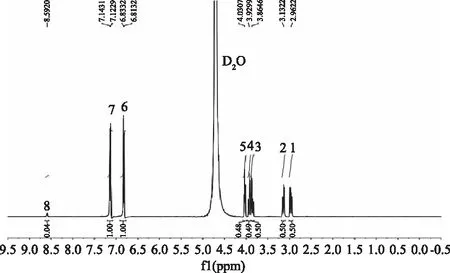
图2 SY在水溶液中的1H-NMR谱图Fig.2 1H-NMR spectrum of SY in water solution

表1 SY在三种溶液中的化学位移Table 1 Chemical shift of SY in three kinds of solution
2.2 SY在DMSO溶液中的氢谱与归属分析
SY在DMSO中的一维氢谱如图3所示。DMSO作为溶剂,则在核磁实验中样品SY的-COOH、-OH、-NH活泼氢均不会被取代。在δ2.5出现DMSO的溶剂峰。Tyr-H-8(1)和Tyr-H-8(2)两个氢原子受到不同的屏蔽效应,在δ2.8和δ2.9附近产生两对双峰,由于自身偶合作用,在δ2.8处为四重峰。Ser-H-2与Tyr-H-7,两个氢原子都连接着电负性较大的-COOH,由于所处环境类似,略有差异,分别在δ3.5和δ4.4左右产生四重峰。在δ3.8位置产生的分裂峰为Tyr-H-4亚甲基的信号。在苯环上的四个氢由于所处空间位置略有差异,故Tyr-H-15,17在δ6.6左右产生一组双峰,Tyr-H-14,16在δ7.0左右产生双峰。在δ8.6左右产生了Tyr-H-6(N-H)的双重峰。Tyr-H-10上的H-为COOH上的氢,由于化学环境推测其在δ9.2左右产生单峰。Ser上的NH2上的两个氢原子在δ8.0产生单峰[20],而Ser-4-H上的H原子由于其化学环境接近Ser-H-1上的H原子,与Ser-H-1的峰重叠在一起,在δ8.0产生信号。δ2.0产生的峰为Tyr-H-19产生的信号。由于每个原子的所处环境不同,故产生相应的H归属。SY在DMSO中H原子的化学位移如表1所示。
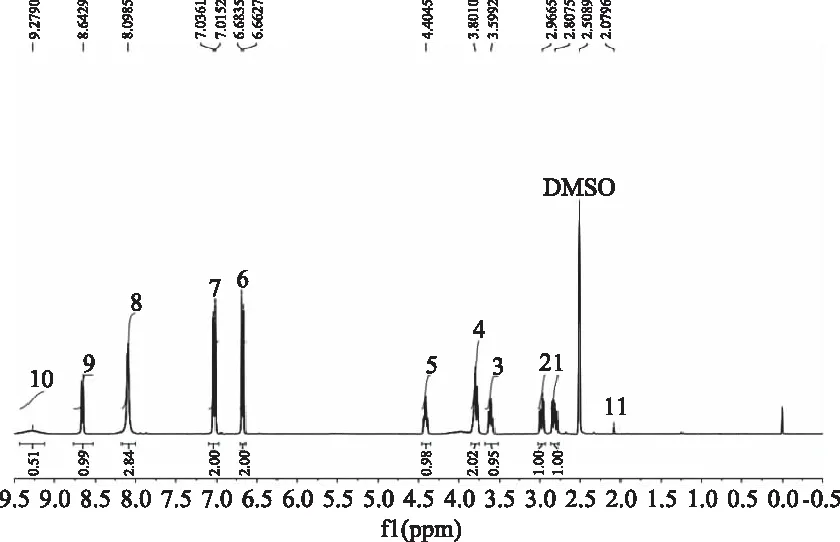
图3 SY在DMSO溶液中的1H-NMR谱图Fig.3 1H-NMR spectrum of SY in DMSO solution
2.3 SY在甲醇溶液中的氢谱与归属分析
SY在甲醇中的一维氢谱如图4所示。用甲醇作为溶剂,活泼氢-OH、-COOH、NR不会在氢谱中产生信号。在δ3.3产生的峰是甲醇的溶剂峰,δ4.8左右产生的为甲醇的水峰。Tyr-H-8(1)和Tyr-H-8(2)分别在δ2.9和δ3.1产生两组四重峰。Ser-H-2和Tyr-H-7都连接了-COOH,空间环境相似,分别在δ3.8和δ4.6产生了两个四重峰。Ser-H-4的亚甲基的两个氢原子周围连接的原子环境不同,导致两个氢原子也处于不同的环境,由于偶合作用,在δ3.9左右产生分裂峰。苯环上的四个H原子由于空间略微的差异,分别在δ6.7与δ7.0产生两对双峰。Tyr-H-6在δ8.5产生一个N-H的双重峰。SY在DMSO中H原子的化学位移如表1所示。
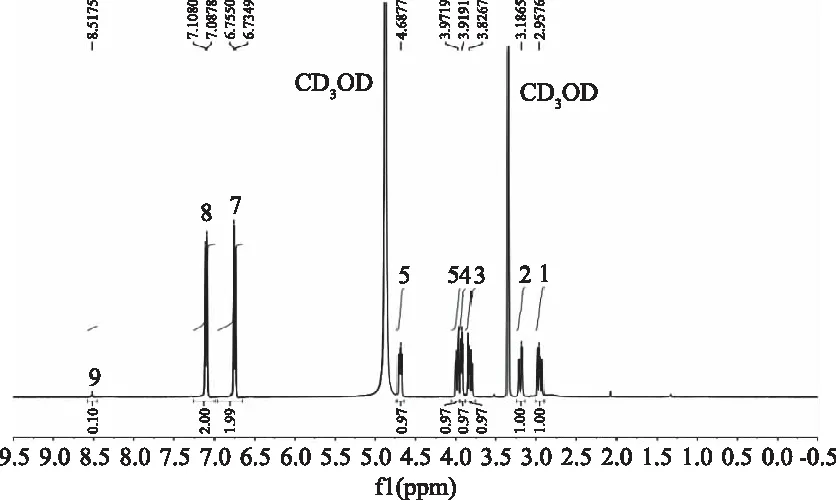
图4 SY在甲醇溶液中的1H-NMR谱图Fig.4 1H-NMR spectrum of SY in CD3OD solution
2.4 SY在三种溶液中NOESY谱及构象分析
一般来说NOESY谱上的交叉峰表示在空间位置比较相接近的质子。因此NOESY谱可以提供在空间位置上相距若干个键之间质子的相邻情况[21]。图5为SY在水溶液中的1H-1HNOESY谱图,从图中可以观察到3个NOE信号,分别为Tyr-H-8(1)~Tyr-H-8(2),Ser-H-4(1)~Ser-H-4(2),Tyr-H-15,17~Tyr-H-14,16质子之间的信号。可以发现,其中的两个NOE效应是连在同一C原子上的两个H原子之间产生的。另一个NOE效应是由苯环上相对的四个H原子之间产生的。这三个NOE效应可能由于是本身空间位置较接近产生的,而且,并未观察到Ser与Tyr的H原子接触产生信号,说明SY中两个氨基酸彼此处在一种相对自由的状态,在水溶液中处于一个相对伸展的状态。有研究表明当小分子物质在水溶液时大部分处于活跃状态[22]。油菜花粉十二肽在水溶液中时则表现出无规则卷曲结构[15]。这种差异可能与肽链的长短有关。较长的肽链构象可能受溶剂的影响更大,也可能与自身折叠相关。有文献报道其他含有酪氨酸的一种ACE抑制肽在水溶液中呈现一种相对伸展的状态[17],但有折叠现象,这可能是由于C端氨基酸的不同导致的。虽然都为ACE抑制肽,但由于其氨基酸序列的差异,导致在同一溶液中构象也存在差异性。溶剂虽然相同,但氨基酸序列不同,同一环境下构象也可能存在着差异。
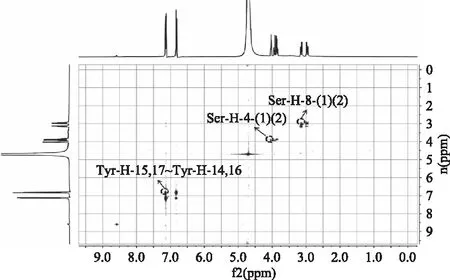
图5 SY在水溶液中的1H-1HNOESY谱图Fig.5 1H-1HNOESY spectrum of SY in water solution
图6为SY在DMSO溶液中的1H-1HNOESY谱图,相对于SY在水溶液中NOESY谱图,NOE信号明显增加多至9个。SY在DMSO溶液中的NOE信号分别为Tyr-H-8-(1)~Tyr-H-8(2),Tyr-H-7~Tyr-H-8(1),Tyr-H-7~Tyr-H-8(2),Tyr-H-8(1)~Tyr-H-15,17,Tyr-H-8(2)~Tyr-H-15,17,Tyr-H-7~Tyr-H-15,17,Tyr-H-6~Ser-H-4,Tyr-H-15,17~Tyr-H-14,16,Tyr-H-6~Tyr-H-10。酪氨酸苯环上的H原子与Tyr-H-7上的H原子有交叉峰,虽然这些H原子都归属于酪氨酸,但是通过NOE效应和其空间位置效应,表明在酪氨酸Tyr-H-7附近位置出现折叠现象。且Tyr-H-7和Tyr-H-8质子间也产生NOE信号,进一步表明酪氨酸在Tyr-H-7,8以及苯环位置上的H处于一种折叠状态。酪氨酸上的-NH和-COOH可能由于相互吸引作用,在谱图上产生NOE信号,从而酪氨酸处于一个以其自身为中心的折叠蜷缩状态,同时酪氨酸上的H-6还与丝氨酸上的H-4在空间位置上接近存在NOE信号。则推测SY在DMSO溶液中处于一个紧凑的折叠蜷缩状态。有报道表明谷胱甘肽在DMSO溶液中处于一种折叠的构象状态[17]。有文献研究ACE抑制肽IIP在DMSO溶液中也存在类似的构象[16]。这些结果与实验得到的结果近似相同。这可能与DMSO本身的结构有关[23],DMSO疏水水合作用导致这种构象。
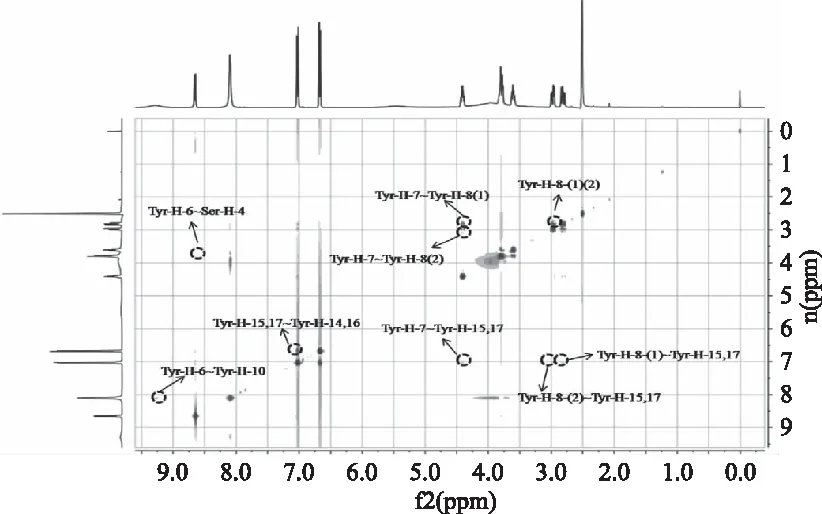
图6 SY在DMSO溶液中的1H-1HNOESY谱图Fig.6 1H-1HNOESY spectrum of SY in DMSO solution
图7为SY在甲醇溶液中的1H-1HNOESY谱图,谱图中可以观察到对于酪氨酸和丝氨酸分别产生了来自各自H原子之间的相对应的NOE信号。在酪氨酸中分别产生了Tyr-H-8-(1)~Tyr-H-8(2),Tyr-H-7~Tyr-H-8(1),Tyr-H-7~Tyr-H-8(2),Tyr-H-8(1)~Tyr-H-14,16,Tyr-H-8(2)~Tyr-H-14,16,Tyr-H-15,17~Tyr-H-14,16质子间的信号。产生这些信号的H原子位置比较接近,因此Tyr优先处于一种伸展的状态,彼此之间略带有一点折叠状态。丝氨酸中产生的NOE信号为Ser-H-2~Ser-H-4(1)、Ser-H-2~Ser-H-4(2),得到的信号表明丝氨酸有折叠现象。从谱图得到的信息丝氨酸和酪氨酸质子之间并没有产生NOE信号,故两个氨基酸在相对彼此处于一种比较自由的状态。以有机溶液甲醇作为溶剂,产生的折叠构象可能是由于有机溶剂导致。但SY整体处于一种较为自由的状态,甲醇也可以作为一个溶解SY的良好溶剂。
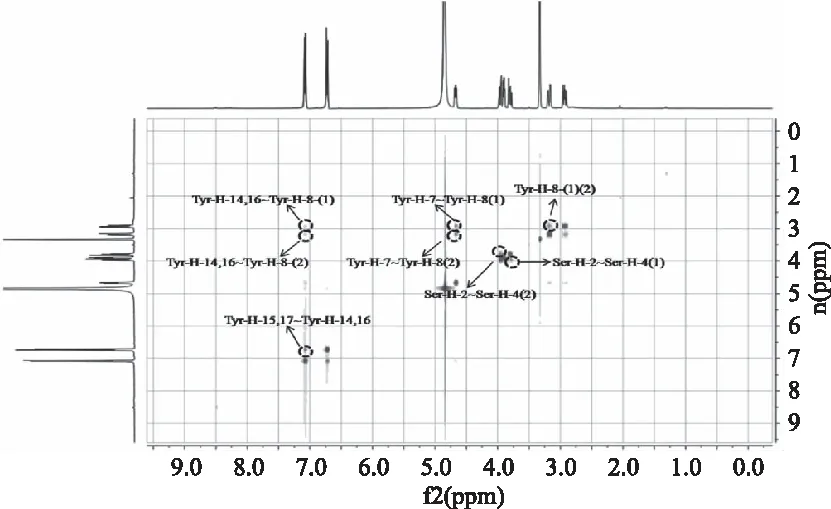
图7 SY在甲醇溶液中的1H-1HNOESY谱图Fig.7 1H-1HNOESY spectrum of SY in CD3OD solution
对比SY在三种不同溶液中的NOESY谱图,可以推测SY在水溶液中整个分子都是处于一种自由的伸展状态并不能观察到折叠状态。在甲醇溶液中是以伸展状态为优势构象并伴有折叠构象存在。而在DMSO溶液中是以伸展和折叠状态共存,折叠构像相对较多。这说明在不同性质的溶液中,SY所处的状态也是不同的。
3 结论
通过核磁共振实验对二肽SY在水溶液、DMSO溶液以及甲醇溶液三种不同溶液环境下的构象进行研究。得到的分析结果SY分子处在不同溶液环境时,其构象也发生改变。其在水溶液中相对柔顺自由伸展的构象存在。而与水溶液不同,在DMSO溶液与甲醇溶液,均有折叠状态出现。但在DMSO溶液中,SY分子两个氨基酸存在接触,处于折叠蜷缩状态。在甲醇中两个氨基酸独自折叠,处于相对伸展的状态。本研究在对SY后续的分子构象进行进一步研究时,对于溶液选择提供了理论基础和实验依据。

