D407A/D430A双位点突变对嗜热酸性生淀粉α淀粉酶GTamy酶学性质的影响
曾 静,郭建军,袁 林
(江西省科学院微生物研究所,江西南昌 330096)
天然生淀粉是一种结构复杂而致密的颗粒,在应用前往往需要经过强酸、强碱、高温或者酶法处理来破坏生淀粉颗粒的结构[1]。酶法降解生淀粉能够简化现代发酵工业中的生淀粉前处理过程,更加环保并节约能耗,因此生淀粉降解酶的研究一直受到高度关注[2-3]。生淀粉酶是指能对不经过蒸煮糊化的生淀粉颗粒表现出强水解活性的酶类[4]。多种微生物包括细菌、酵母、丝状真菌和放线菌都能够产生生淀粉酶。在α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶、异淀粉酶中均有部分酶具有水解生淀粉的能力[4]。
生淀粉α-淀粉酶可以在低于糊化温度条件下直接作用于未经蒸煮糊化的生淀粉颗粒,在淀粉液化过程中能够省去生淀粉糊化步骤,有利于节约能源和简化工艺,因此生淀粉α-淀粉酶在食品、造纸、纺织等领域具有巨大的应用潜力[5-6]。在淀粉双酶法水解工艺中为了防止杂菌污染需要适当加温,至少要达到60 ℃。此外,生淀粉加水形成的乳浊液的pH一般为5.8~6.5,由于淀粉工业中循环工艺的应用,淀粉水解过程中的pH通常在5.0左右[7-10]。因此,获得耐高温、低pH和不依赖于Ca2+的生淀粉α-淀粉酶,有利于对现行淀粉加工工业的工艺体系进行技术升级和改造。
来源于嗜热菌Geobacillusthermoleovorans的α-淀粉酶GTamy属于嗜热酸性生淀粉α-淀粉酶,具有优良的高温活性和热稳定性,其最适反应温度为80 ℃,最适反应pH为5.0,于80 ℃的可溶性淀粉酶活达1723 U/mg,于80 ℃的半衰期为184 min,其活性和热稳定性均不依赖于Ca2+[11]。GTamy是目前报道的玉米淀粉降解率最高的生淀粉α-淀粉酶,使用0.1 U/(mg淀粉)的酶液,于80 ℃水解30%玉米淀粉3 h(pH5.0),玉米淀粉降解率达54%[11]。并且GTamy的酶学性质(如热稳定、低pH、不依赖于Ca2+)使得其在淀粉液化工艺中具有巨大的应用潜力。此外有关GTamy分子结构特征与酶学性质之间关系的研究具有重要理论价值,不仅有利于探讨蛋白质类生物大分子适应高温环境的分子机制,也可以为其他α-淀粉酶的性质优化提供理论依据和设计思路。GTamy的模拟分子结构显示其包含有三个保守的Ca2+结合位点,其中两个Ca2+结合位点位于结构域A与结构域B之间,第三个Ca2+结合位点位于结构域A与结构域C之间[11]。来源于Bacillusstearothermophilus的α-淀粉酶BStA与GTamy具有98%序列相似性,Suvd等[12]发现位于α-淀粉酶BStA的结构域A与结构域C之间的Ca2+结合位点对于BStA的热稳定性非常重要。本研究拟对GTamy中位于结构域A和结构域C(也称生淀粉结合域,raw starch binding domain,RSBD)之间的Ca2+结合位点进行定点突变,并通过比较GTamy与突变体的酶学性质来揭示该Ca2+结合位点对GTamy酶学性质的影响,初步阐述GTamy的分子结构特征与其酶学性质之间的关系。
1 材料与方法
1.1 材料与仪器
大肠杆菌EscherichiacoliJM109、枯草芽孢杆菌BacillussubtilisWB600、枯草芽孢杆菌表达载体pSTOP1622 均由本实验室保存;基因gtamyh(编码具有His tail的α-淀粉酶GTamyH) 由上海博益生物科技有限公司合成;KOD-Plus-neo DNA聚合酶 日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、蛋白质Marker 美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A. 美国Omega Bio-tek公司;Chelating SepharoseTMFast Flow 美国GE Healthcare公司;Bradford法蛋白浓度测定试剂盒、木糖、咪唑 上海生工生物工程股份有限公司;实验所用试剂 均为国产分析纯;LB培养基(1 L):胰蛋白胨 10 g,酵母提取物 5 g,NaCl 10 g,固体培养基添加琼脂粉15 g/L,用于大肠杆菌EscherichiacoliJM109和枯草芽孢杆菌BacillussubtilisWB600的培养,根据质粒的选择性标记需要,添加终浓度为30 μg/mL的卡那霉素。
PCR仪(Mastercycler gradient) 美国Eppendorf公司;TY04S-3C型凝胶成像系统 北京君意东方电泳设备有限公司;SCIENTZ-ⅡD型超声波细胞破碎仪 宁波新芝生物科技股份有限公司;SP-752PC型紫外可见分光光度计 上海光谱仪器有限公司;Agilent 7500ce 美国Agilent公司。
1.2 实验方法
1.2.1 重组质粒pSTOP1622-AbnA-gtamyds的构建及鉴定 以P1和P2为引物(表1),以基因gtamyh为模板,进行PCR扩增,获得不含信号肽的结构基因gtamyhds。PCR扩增条件为:98 ℃ 5 min;98 ℃ 20 sec,60 ℃ 20 sec,74 ℃ 2 min,30个循环;74 ℃,10 min。扩增产物经BglII和SphI双酶切,连接至载体pSTOP1622,构建重组质粒pSTOP1622-gtamyhds。
采用NEB公司的Gibson Assembly Master Mix构建包含枯草芽孢杆菌信号肽AbnA和重组载体pSTOP1622-gtamyhds的重组载体pSTOP1622-AbnA-gtamyhds。所需引物(表1中P3和P4)按照该产品说明书的要求进行设计,PCR等相关操作按照该产品说明书进行。具体操作如下:以pSTOP1622-gtamyhds为模板,采用引物P3、P4(表1),进行PCR扩增得到载体片段;PCR扩增条件为:94 ℃ 5 min;94 ℃ 30 sec,55 ℃ 20 sec,68 ℃ 4 min,35个循环;68 ℃,10 min。在NCBI网站(https://www.ncbi. nlm.nih.gov/)查询信号肽AbnA的核苷酸序列,合成包含同源臂和AbnA核苷酸序列的DNA片段(5′-CAAACTAGTTCGAAGATCT-信号肽核苷酸序列-ACGGCGTGGCAAATTGCCGTG-3′)。PCR扩增的载体片段与上述DNA片段混合,采用Gibson Assembly Master Mix进行无缝克隆,获得重组质粒pSTOP1622-AbnA-gtamyhds。以pSTOP1622-AbnA-gtamyhds为模板,采用引物P5、P2(表1)进行PCR扩增,获得包含信号肽AbnA基因序列和GTamyHds基因序列的约1600 bp的DNA片段。DNA片段测序(上海生工生物工程股份有限公司),比对分析。
1.2.2 重组质粒pSTOP1622-AbnA-gtamyhdsD407A/D430A的构建及鉴定 根据QuikChange®点突变试剂盒的原理,结合α-淀粉酶GTamy基因gtamy和拟突变的氨基酸位点设计引物D407A-F、D407A-R、D430A-F、D430A-R(表1)。以pSTOP1622-AbnA-gtamyhds为模板,采用引物D407A-F和D407A-R,进行PCR扩增得到包含载体序列和基因序列的线性片段。PCR扩增条件为:94 ℃ 5 min;94 ℃ 30 sec,55 ℃ 20 sec,68 ℃ 4 min,35个循环;68 ℃,10 min。扩增产物经DpnⅠ酶处理后,转化大肠杆菌JM109,卡那霉素抗性平板筛选转化子,经测序鉴定是否为突变基因gtamyhD407A。在此基础上,以pSTOP1622-AbnA-gtamyhdsD407A为模板,采用引物D430A-F和D430A-R,进行PCR扩增,重复以上实验步骤,获得重组质粒pSTOP1622-AbnA-gtamyhdsD407A/D430A。
以pSTOP1622-AbnA-gtamyhdsD407A/D430A为模板,采用引物P5、P2(表1)进行PCR扩增,获得包含信号肽AbnA基因序列和GTamyHdsD407A/D430A基因序列的约1600 bp的DNA片段。将DNA片段送至上海生工生物工程股份有限公司进行测序,并与对应基因序列进行比对确认。
1.2.3 枯草芽孢杆菌B.subtilisWB600感受态细胞的制备和转化 枯草芽孢杆菌B.subtilisWB600感受态细胞的制备和转化采用改进的Spizizen法[13]进行。
1.2.4 重组α-淀粉酶的诱导表达和纯化 接种重组枯草芽孢杆菌单克隆到LB液体培养基中,250 mL三角瓶中培养,装液量20 mL,37 ℃和200 r/min下培养培养10 h。然后转接该培养物于新鲜LB液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为25 mL,接种量为3%,培养温度为37 ℃,转速为200 r/min。当培养至菌体OD600 nm达到1时,添加终浓度为0.5%的木糖,诱导细胞表达重组蛋白质,诱导时间为30 h。
采用Ni2+亲和层析柱对发酵上清液中目的蛋白质进行纯化,用250 mmol/L咪唑洗脱缓冲液洗脱,即得到纯化后的重组α-淀粉酶。利用聚丙烯酰胺凝胶电泳[14](Sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)检测重组α-淀粉酶的纯度,并采用Bradford法测定重组α-淀粉酶的浓度[15]。
1.2.5α-淀粉酶的酶活力测定 将10 μL酶液与490 μL 含1%(m/V)可溶性淀粉的50 mmol/L MES,pH5.0缓冲液混合,于80 ℃反应30 min后,迅速放入冰水浴中终止反应,然后采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)法[16]测定反应体系中还原糖量。酶活力单位(U)定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位(U)。
1.2.6α-淀粉酶的最适反应温度和热稳定性测定 按照上述反应体系混合酶液和底物,分别于30~100 ℃反应30 min,测定不同温度条件下酶比活力,并以酶比活力对温度作图,确定其最适反应温度。将酶液于80 ℃保温,分时间梯度取出部分样品,按照1.2.5节方法测定酶活。将未处理的酶液的酶活定义为100%,并以相对酶活的百分比对时间作图,评价酶的热稳定性。
1.2.7α-淀粉酶的动力学常数测定 用50 mmol/L MES(pH5.0)缓冲液配制不同质量分数可溶性淀粉溶液(0.1%、0.2%、0.5%、1.0%、1.5%、2.0%、3.0%、4.0%、5.0%),分别向可溶性淀粉溶液中加入等量的酶液,按照1.2.5的方法测定酶活。根据双倒数作图法以底物浓度的倒数为横坐标,以酶比活力的倒数为纵坐标作图,直线的斜率为Km/Vmax,截距为1/Vmax,计算以可溶性淀粉为底物时的米氏常数Km、反应常数kcat。
1.2.8α-淀粉酶的最适反应pH测定 将酶液与不同pH的1%(W/V)可溶性淀粉溶液混合,于80 ℃下进行酶活测定。采用不同缓冲液配制不同pH的1%(W/V)可溶性淀粉溶液:50 mmol/L MES(pH3.0~7.0)、50 mmol/L MOPS(pH7.0~11.0)。
1.2.9α-淀粉酶对玉米淀粉的降解率及吸附率的测定 取30%(W/V)玉米淀粉的50 mmol/L MES(pH5.0)缓冲液与0.1 U/(mg淀粉)的酶液混合,于80 ℃反应3 h后,用DNS法测定上清液中还原糖量。α-淀粉酶的玉米淀粉降解率按照如下公式计算:
玉米淀粉降解率(%)=还原糖(mg/mL)/起始生淀粉量(mg/mL)×0.9×100
取30%(W/V)生玉米淀粉的50 mmol/L MES(pH5.0)缓冲液与0.1 U/(mg淀粉)的酶液混合,混合体系在20 ℃的恒温振荡培养箱孵育3 h,振荡速率为180 r/min。反应结束后,测定上清液中的残余可溶性淀粉酶活。吸附率AR计算公式如下:
AR(%)=(O-R)/O×100
R:上清液残余酶活力;O:初始酶活力。
1.3 数据处理
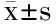
2 结果与分析
2.1 定点突变位点的选择
采用Swiss-Model(http://swissmodel. expasy.org),以来源于Bacillusstearothermophilus的α-淀粉酶BStA(PDB ID:1hvxA)的蛋白质分子结构为模板,模拟GTamy的蛋白质分子结构。α-淀粉酶GTamy与BStA的蛋白质分子结构比对结果(图1)显示:GTamy属于糖苷水解酶类的第13家族,具有第13家族酶分子结构和催化机制上的共同特征[11,17-19]。例如,GTamy的一级结构含有四个保守区域,这四个保守区域包含酶分子的催化活性位点和底物结合位点;GTamy具有第13家族酶分子的保守的催化活性中心,由Asp268、Glu298及Asp365构成;GTamy的三级结构由三个结构域组成,即结构域A、结构域B和结构域C。
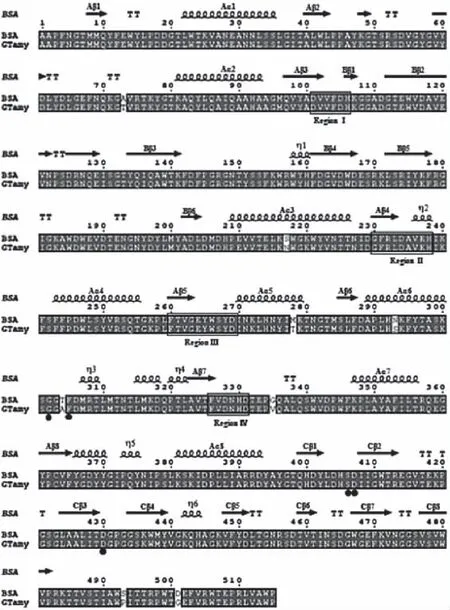
图1 GTamy与α-淀粉酶BSA的蛋白质分子结构比对结果Fig.1 Molecular structure comparison of α-amylase GTamy and BSA注:图中方框标示的是保守序列I~保守序列IV,实心圆形标示的氨基酸残基为α-淀粉酶BSA中位于结构域A与结构域C之间的Ca2+结合位点相关的氨基酸残基,实心三角形标示的氨基酸残基为GTamy中待突变的氨基酸残基。BStA:来源于Bacillus stearothermophilus的α-淀粉酶(PDB ID:1hvxA);GTamy:来源于Geobacillus thermoleovorans的α-淀粉酶。
其中GTamy的结构域C由8个β-sheet结构构成,GTamy的结构域C和来源于Bacillussp. TS-23的α-淀粉酶的生淀粉结合域RSBD序列比对结果表明,GTamy的结构域C属于生淀粉结合域RSBD[11]。生淀粉α-淀粉酶能够直接水解未经糊化处理的生淀粉颗粒的关键在于其具有结合到淀粉颗粒表面的生淀粉结合域RSBD[4,6]。RSBD作为淀粉酶的天然部分主要有以下作用:使淀粉酶分子可以在溶液中与不溶性底物(淀粉颗粒)结合,将底物运送到催化结构域的活性位点以及使淀粉颗粒表面破裂[20]。除此之外,RSBD还具有一些特殊功能。例如,Gt-amyⅡ的RSBD还与其热稳定性相关[21];AmyP的RSBD与其可溶性淀粉酶活相关[22-23]。
已有研究表明,α-淀粉酶中金属离子结合位点对于其维持酶学性质起到非常重要的作用。例如,Linden等[24]通过对比极端嗜热α-淀粉酶PFA与其他低温、中温微生物来源的α-淀粉酶的蛋白质分子结构发现,PFA中Ca2+-Zn2+双金属离子结合位点对于其维持热稳定性非常重要;Machius等[25]和Qin等[26]发现,位于α-淀粉酶BLA的结构域A与结构域B之间的Ca2+-Zn2+-Ca2+三金属离子结合位点以及位于其结构域A与结构域C之间的第三个Ca2+结合位点有利于BLA维持热稳定性;曾静等[27]的研究结果表明,位于极端嗜热α-淀粉酶ApkA的结构域A与结构域B之间Ca2+结合位点的有利于其维持高温活性和热稳定性;Suvd等[12]通过解析α-淀粉酶BStA的蛋白质分子结构发现,位于其结构域A与结构域C之间的Ca2+结合位点对于BSA的热稳定性非常重要。
BStA中位于结构域A与结构域C之间的Ca2+结合位点的配基由多肽链骨架的三个羰基氧原子(Gly300、Phe302和Ser406)和两个天冬氨酸残基Asp(Asp407和Asp430)的羧基氧原子共同构成[12]。根据GTamy和BStA的蛋白质分子结构比对结果,GTamy中存在与BStA中该Ca2+结合位点相对应的氨基酸残基,即Gly303、Phe305、Ser406、Asp407和Asp430。由此推断,GTamy的结构域A与结构域C之间也可能存在Ca2+结合位点。本研究对该Ca2+结合位点中的天冬氨酸残基Asp407和Asp430进行定点突变,研究该Ca2+结合位点对GTamy酶学性质的影响。
2.2 重组质粒的PCR鉴定
分别以重组质粒pSTOP1622、pSTOP1622-AbnA-gtamyhds、pSTOP1622-AbnA-gtamyhdsD407A/D430A为模板,采用引物P5、P2对目标片段进行PCR扩增。PCR扩增所得产物的电泳鉴定图如图2所示,以重组质粒pSTOP1622-AbnA-gtamyhds和pSTOP1622-AbnA-gtamyhdsD407A/D430A为模板进行PCR扩增得到的PCR产物大小均约为1.6 kb,与理论值相符。同时将以上得到的PCR扩增产物送至上海生工生物工程股份有限公司进行测序,并将测序结果(结果未显示)与对应的基因序列进行了比对确认,证实重组质粒构建成功。

图2 重组质粒的PCR鉴定Fig.2 PCR analysis of recombinant plasmids注:M1.1 kb ladder;1.质粒pSTOP1622;2.质粒pSTOP1622-AbnA-gtamyhds;3.质粒pSTOP1622-AbnA-gtamyhdsD407A/D430A;4. 以质粒pSTOP1622为模板,采用引物P5、P2进行PCR扩增的产物;5. 以质粒pSTOP1622-AbnA-gtamyhds为模板,采用引物P5、P2进行PCR扩增的产物;6. 以质粒pSTOP1622-AbnA-gtamyhdsD407A/D430A为模板,采用引物P5、P2进行PCR扩增的产物。
2.3 重组α-淀粉酶的诱导表达与纯化
将阴性对照pSTOP1622和重组质粒pSTOP1622-AbnA-gtamyhds、pSTOP1622-AbnA-gtamyhdsD407A/D430A分别转化枯草芽孢杆菌B.subtilisWB600,获得重组枯草芽孢杆菌并进行诱导表达。待表达完成后,收集发酵上清液和发酵菌体,采用SDS-PAGE分析发酵上清液和发酵菌体中重组α-淀粉酶的表达情况。如图3所示,目的蛋白质GTamy和GTamyD407A/D430A均得到成功表达,且主要位于发酵上清液中。GTamy和GTamyD407A/D430A的表观分子质量均约为60 kD,两者的大小均与理论值相符。采用Ni2+亲和层析柱对发酵上清液中的目的蛋白质进行纯化,得到纯化后的重组α-淀粉酶GTamy和GTamyD407A/D430A。
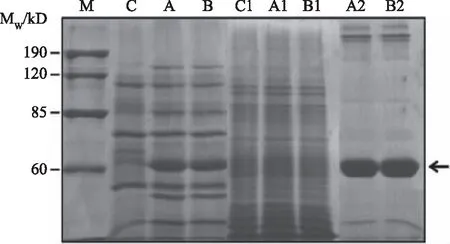
图3 重组α-淀粉酶的SDS-PAGE检测图Fig.3 SDS-PAGE analysis of recombinant α-amylases注:重组α-淀粉酶的SDS-PAGE检测图,其中C为含有质粒pSTOP1622的重组枯草芽孢杆菌的发酵上清液样品,A为含有重组质粒pSTOP1622-AbnA-gtamyhds的重组枯草芽孢杆菌的发酵上清液样品,B为含有重组质粒pSTOP1622-AbnA-gtamyhdsD407A/D430A的重组枯草芽孢杆菌的发酵上清液样品,C1为含有质粒pSTOP1622的重组枯草芽孢杆菌的发酵菌体样品,A1为含有质粒pSTOP1622-AbnA-gtamyhds的重组枯草芽孢杆菌的发酵菌体样品,B1为含有重组质粒pSTOP1622-AbnA-gtamyhdsD407A/D430A的重组枯草芽孢杆菌的发酵菌体样品,A2采用Ni2+亲和层析获得的GTamy纯化样品,B2为采用Ni2+亲和层析获得的GTamyD407A/D430A纯化样品,箭头所指为目的蛋白质GTamy和GTamyD407A/D430A的位置。
2.4 GTamy和GTamyD407A/D430A的酶学性质比较
2.4.1 pH对重组α-淀粉酶相对酶活的影响 将酶液与不同pH(1.0~8.0)的1%(W/V)可溶性淀粉溶液混合,于80 ℃下测定重组α-淀粉酶的相对酶活,结果如图4所示。重组α-淀粉酶GTamy和GTamyD407A/D430A的最适反应pH均约为5.0,在pH3.0~11.0范围内两者具有相似的相对酶活。以上结果表明,D407A/D430A双位点突变不影响GTamy的反应pH。
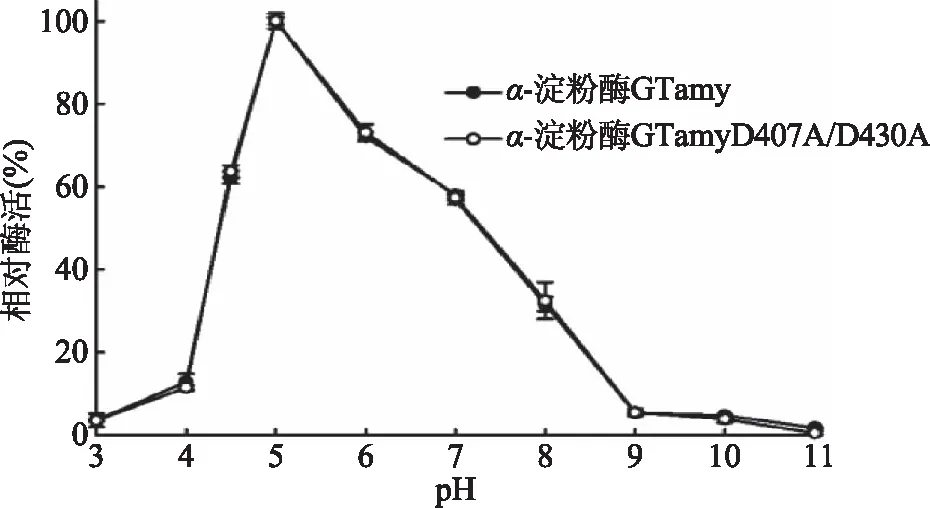
图4 pH对酶活的影响Fig.4 pH dependence of α-amylase activity
2.4.2 温度对重组α-淀粉酶比活力的影响 以1%可溶性淀粉为底物,于不同温度条件下(30~100 ℃)测定重组α-淀粉酶的酶比活力,结果如图5所示。重组α-淀粉酶GTamy和GTamyD407A/D430A的最适反应温度均为80 ℃,但是在40~100 ℃间GTamy的酶比活力均明显高于突变体GTamyD407A/D430A的酶比活力。其中,在80 ℃条件下,GTamy的酶比活力为1 756.75 U/mg,突变体GTamyD407A/D430A的酶比活力为1 484.48 U/mg。这表明该Ca2+结合位点对于GTamy维持其高温活性非常重要。该Ca2+结合位点的缺失导致突变体于高温条件下的酶比活力降低。
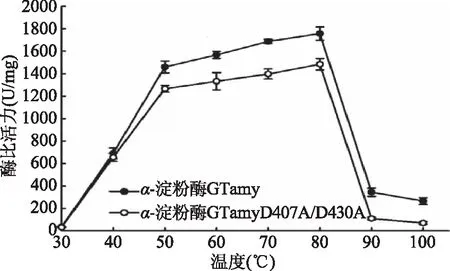
图5 温度对酶活的影响Fig.5 Temperature dependence of α-amylase activity
2.4.3 重组α-淀粉酶的动力学参数 重组α-淀粉酶以可溶性淀粉为底物时的米氏常数Km和反应常数kcat如表2所示,与GTamy相比,80 ℃时突变体GTamyD407A/D430A的Km未明显改变,kcat值明显降低。即突变体GTamyD407A/D430A的可溶性淀粉结合能力未明显改变,以可溶性淀粉为底物时的反应速率明显下降。突变体GTamyD407A/D430A于80 ℃条件下以可溶性淀粉为底物的反应速率为GTamy的79%。以上结果表明,该Ca2+结合位点是通过影响GTamy的反应速率来影响其高温活性的。

表2 80 ℃重组α-淀粉酶的动力学参数Table 2 Kinetic parameters of recombinant α-amylases at 80 ℃
2.4.4 重组α-淀粉酶的热稳定性 重组α-淀粉酶于80 ℃下的热稳定性测定结果如图6所示。在80 ℃的条件下,GTamy的热稳定性高于突变体GTamyD407A/D430A的热稳定性。其中GTamy于80 ℃的半衰期约为3 h,GTamyD407A/D430A于80 ℃的半衰期约为2.5 h。这表明,该Ca2+结合位点与GTamy的热稳定性相关,这与α-淀粉酶BStA中相对应的Ca2+结合位点的功能相同。

图6 80 ℃重组α-淀粉酶的热稳定性Fig.6 Thermal stability of α-amylases at 80 ℃
2.4.5 重组α-淀粉酶对玉米淀粉的吸附率及降解率 通过测定重组α-淀粉酶对玉米淀粉的吸附率和降解率来比较重组α-淀粉酶对不溶性底物的结合能力和降解能力,结果如表3所示。与GTamy相比,突变体GTamyD407A/D430A对玉米淀粉的吸附率和降解率均明显降低。在同等条件下,GTamyD407A/D430A对玉米淀粉的吸附率仅为GTamy的67.9%;GTamyD407A/D430A对玉米淀粉的降解率仅为GTamy的59.3%。

表3 重组α-淀粉酶对玉米淀粉的吸附率及降解率Table 3 Substrate binding rate and hydrolysis rate of α-amylases towards corn starch
3 结论
本研究率先通过构建GTamy的定点突变体GTamyD407A/D430A来研究位于结构域A与结构域C(即生淀粉结合域RSBD)之间的Ca2+结合位点对其酶学性质(如热稳定性、对可溶性淀粉的结合能力和降解能力、对生淀粉的结合能力和降解能力等)的影响。与GTamy相比,突变体GTamyD407A/D430A的高温活性和热稳定性明显降低。GTamyD407A/D430A于80 ℃的酶比活力由1756.75 U/mg降低至1484.48 U/mg;于80 ℃的半衰期由3 h降低至2.5 h。此外,突变体GTamyD407A/D430A对可溶性淀粉的结合能力未明显改变,对可溶性淀粉的降解能力以及对玉米淀粉的结合能力和降解能力明显降低。以1%可溶性淀粉为底物时,GTamyD407A/D430A的底物结合能力不变,反应速率仅为GTamy的79%;以30%玉米淀粉为底物时,突变体的底物吸附率为GTamy的67.9%,底物降解率为GTamy的59.3%。本研究结果表明,位于GTamy的结构域A与RSBD之间的Ca2+结合位点有利于其维持热稳定性和高温活性。该Ca2+结合位点的突变可能通过改变GTamy的分子结构,特别是生淀粉结构域RSBD和酶分子催化中心的分子结构,影响GTamy的酶学性质。本研究初步阐述了GTamy的分子结构特征与其酶学性质之间的关系,为其他α-淀粉酶的分子改造提供了理论依据和设计思路。

