泡菜中抑菌性芽孢杆菌的筛选及其细菌素理化特性
张红梅,符丹丹,赵君峰,王大红,李市场,张 敏
(河南科技大学食品与生物工程学院,洛阳市微生物发酵工程技术研究中心,河南科技大学微生物资源开发与利用重点实验室,河南洛阳 471023)
随着人们对食品品质和食品安全要求的提高,食品中致病微生物和腐败微生物的控制显得越来越重要。近年来,由于人们对食品添加剂的安全性考虑,食品添加剂的使用量一直在减少,而生物保鲜成为大家关注的焦点。生物保鲜是化学添加剂的替代技术,它利用天然微生物产生的抑菌物质达到延长食品保质期的目的[1]。来自于乳酸菌(LAB)具有抑菌活性的细菌素,已经成人们广泛研究的对象[2]。然而,关于产生细菌素的芽孢杆菌研究较少,既然芽孢杆菌属细菌能够产生多种不同化学结构的抗菌多肽,对产细菌素的芽孢杆菌的研究显得更有意义[3]。
国内外学者从不同的环境中分离筛选了产细菌素的芽孢杆菌。如Cladera-Olivera等[4]从亚马逊河中分离到1株能抑制单增李斯特氏菌的地衣芽孢杆菌;Liu等[5]从传统发酵豆酱中分离到1株产分子量为3.5 kD细菌素的枯草芽孢杆菌;An等[6]从海洋石斑鱼中筛选到一株抑制多数食源性病原菌的解淀粉芽孢杆菌;李俊峰等[7]从石油污染的土壤中筛选到一株产细菌素物质的枯草芽孢杆菌。
研究发现,自然发酵泡菜在常温下长期保存不易变质的主要原因除了其低pH外,还有生产过程中某些微生物产生的能抑制其他细菌生长的抑菌物质[8]。为获得结构新颖、抑菌活性更为稳定的细菌素,本文拟从市售袋装泡菜中分离筛选具有广谱抑菌作用的芽孢杆菌菌株,进而为生物保鲜新品种的开发奠定基础。
1 材料和方法
1.1 材料与仪器
传统发酵泡菜:采自云南通海县泡椒小米辣、河北平乡县泡豇豆,四川眉山酸菜,乌江涪陵榨菜;大肠杆菌(Escherichiacoli)ATCC25922、金黄色葡萄球菌(Staphylococcusaureus)ATCC25923、酿酒酵母菌(Saccharomyceteceevisiae)AS2399、纳塔尔链霉菌(Streptomycesnatalensis)4.3505 均由河南科技大学食品与生物工程学院微生物实验室保藏;实验动物:一级小白鼠(体重18~22 g) 购自第四军医大学;LB肉汤 北京奥博星生物技术有限公司;木瓜蛋白酶(200000 U/g)、胰蛋白酶(250000 U/g)、链霉蛋白酶(200000 U/g)、淀粉酶(200000 U/g)和脂肪酶(200000 U/g) 华蓝化学有限公司;rTaq PCR Master mix 上海生工生物工程股份有限公司;细菌基因组DNA快速抽提试剂盒 北京鼎国昌盛生物技术有限责任公司。
SW-CJ-2FD型超净工作台 苏州安净净化科技有限公司;DH-420型恒温培养箱 北京科伟永兴仪器有限公司;H2100R台式高速冷冻离心机 湘仪离心机仪器有限公司;THZ-Q恒温振荡器 太仓市华美生化仪器厂;ABI stepone plus PCR仪 德国艾本德股份有限公司;EDZX-50K立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.2 实验方法
1.2.1 芽孢杆菌的筛选 取4种泡菜汁各2 mL,混匀后于70 ℃水浴中孵育30 min,杀死营养细胞,梯度稀释后,取100、10-1、10-2三个梯度均匀涂布于LB肉汤培养基,观察细菌菌落的形态特征,对疑似菌落进行革兰氏染色[9],挑取产芽孢的革兰氏阳性菌落保存备用。
1.2.2 细菌素产生菌株的初步筛选 将分离的菌株于LB肉汤液体培养基中37 ℃振荡培养36 h,发酵液经8000 r/min离心10 min,取上清液,采用孔径为0.22 μm的滤膜过滤除菌去除菌体,获得拮抗液。利用琼脂扩散法测定抑菌活性[10],取大肠杆菌培养液(细菌浓度1.0×106CFU·mL-1)均匀涂布于固体培养基表面,于每个孔中加入100 μL拮抗液,培养24 h,观察抑菌作用,记录抑菌圈直径。
1.2.3 H2O2作用的排除 H2O2作用的排除参照张艾青等[11],利用H2O2受热分解的特性,取菌株拮抗液于80 ℃水浴加热10 min,参照1.2.2测定除去H2O2的拮抗液对大肠杆菌的抑菌直径。
1.2.4 蛋白酶的处理 取排除H2O2作用的拮抗液,分别加入木瓜蛋白酶、胰蛋白酶、链霉蛋白酶、淀粉酶和脂肪酶,使酶的终浓度为2 mg/mL,在酶的最适pH下,37 ℃保温2 h,再将pH调回至6.5±0.2,以不加酶液的拮抗液作为对照,参照1.2.2测定蛋白酶和非蛋白酶处理后拮抗液对大肠杆菌的抑菌直径。
1.2.5 菌株鉴定 对LB平板上培养24 h的菌落形态、色泽、表面、边缘、凹凸度、透明度进行形态观察;之后分别对菌体进行革兰氏染色和芽孢染色后,于光学显微镜下观察染色后的菌体形态和芽孢形状。根据生理生化细菌鉴定标准,对分离纯化后的菌株进行生理生化测定,包括硝酸盐还原,淀粉水解,过氧化氢酶实验,甲基红实验(M.R实验)、H2S实验及乙酰甲基甲醇实验(V.P实验)等[12]。
1.2.6 细菌16S rDNA基因序列测定 基因组DNA的提取方法参照Giorgio[13]。PCR扩增16S rDNA基因序列PCR扩增的引物分别是27F(5′-AGAGTTTGAT CMTGGCTCAG-3′)和1492R(5′-TACGGYTACC TTGTTACGACTT-3′)[14]。16S rDNA的测序由上海生工生物技术有限公司完成。同源性分析利用BLAST,寻找与目的基因序列同源性最高的已知分类地位的菌种,然后从GENEBANK中提取该属内的代表菌株的16S rDNA序列,与测定的菌株的序列共同用Clustal X1.8 校准对齐后,用MEGA5软件以邻接法构建系统发生树[15]。
1.2.7 安全性实验 取健康小鼠(体重18~22 g),随机分组,每组5只。实验组每只小鼠以腹腔注射的方法,分别注入菌体浓度为5×109个/mL的液体培养物1 mL;对照组每只小鼠腹腔注射1 mL生理盐水,连续观察7 d。
1.2.8 温度和pH对细菌素的影响
1.2.8.1 温度对细菌素的影响 菌体培养物以1%的接种量接入50 mL LB培养基中,37 ℃培养36 h,取拮抗液分别于70、80、90 ℃水浴中处理30 min,冷却后,参照1.2.2测定拮抗液对大肠杆菌和酵母菌的抑菌直径。
1.2.8.2 pH对细菌素的影响 菌体培养物以1%的接种量接入50 mL LB培养基中,37 ℃培养36 h,获得拮抗液,用1 mol/L HCl和1 mol/L NaOH调节其pH分别至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,37 ℃保持2 h后,再将不同样品的pH调回至6.5±0.2,参照1.2.2测定拮抗液对大肠杆菌的抑菌直径。
1.2.9 细菌素抑菌谱 以大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、酵母菌(Saccharomycete)、链霉菌(Streptomyces)做指示菌,活化24 h后,稀释至1.0×106CFU·mL-1,涂布接种于各对应的固体培养基表面,参照1.2.2测定拮抗液对各指示菌的抑菌直径。
1.3 数据处理
利用Origin 8.0进行实验数据处理,数据平行3次,结果用平均值±标准偏差表示,采用SPSS 18.0软件对数据进行统计学分析。
2 结果与分析
2.1 芽孢杆菌菌株的筛选
利用高温水浴杀死营养细胞体的方法,从4种市售泡菜中共分离出3株产芽孢细菌,通过革兰氏染色和芽孢染色后,发现这3株菌同时具有革兰氏阳性、产芽孢、杆状细胞的特点,初步确定这3株菌属芽孢杆菌属细菌,分别命名为PC-1、PC-2、PC-3。
2.2 细菌素产生菌株的初步筛选
利用琼脂扩散法,以大肠杆菌为指示菌,对传统发酵泡菜中分离的3株芽孢杆菌属细菌PC-1、PC-2、PC-3进行抑菌活性检测,结果如图1所示。由图1可见,PC-1对大肠杆菌没有抑制作用,无抑菌圈出现;PC-2和PC-3对大肠杆菌有抑制作用,均能形成抑菌圈,抑菌圈直径分别为(33±0.23) mm和(30±0.37) mm;其中PC-2的抑菌抑菌作用强于PC-3,因此选用PC-2菌株作为进一步实验的测试菌。

图1 初筛菌株对指示菌的抑菌作用Fig.1 Antimicrobial effect of the primary strains
2.3 H2O2抑菌作用的排除
细菌生长代谢过程所产有机酸、H2O2以及菌体细胞常常也具有抑菌作用,初步筛选的PC-2需进一步确定其抑菌活性是否为细菌素所致。由于拮抗液的制作过程包含过滤除菌环节,故排除菌体细胞的干扰;另外,拮抗液的pH在发酵前后无明显变化为6.5±0.2,亦排除酸的影响;进一步通过加热拮抗液使H2O2分解的方法,检测H2O2对拮抗液抑菌的干扰作用,结果如图2所示。由图2可知,排除H2O2作用的拮抗液仍具有抑菌作用,平均抑菌圈直径为(31±0.71) mm,与处理前抑菌效果差别不显著,可以初步判断PC-2的抑菌活性物质不是H2O2。
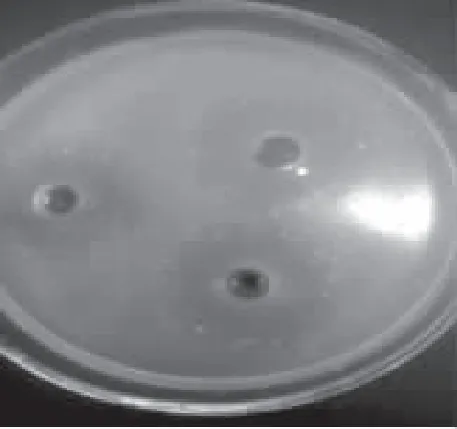
图2 H2O2排除后的抑菌作用Fig.2 Antimicrobial effect of Bacillus PC-2 after eliminating H2O2
2.4 蛋白酶的稳定性
为进一步确定PC-2的抑菌活性物质,分别用木瓜蛋白酶、胰蛋白酶、链霉蛋白酶、淀粉酶和脂肪酶对拮抗液进行处理,抑菌结果见图3。图3显示,拮抗液中加入不同蛋白酶后,与对照相比抑菌圈直径减小,抑菌活性均有不同程度降低;而用非蛋白水解酶淀粉酶和脂肪酶处理后,抑菌圈直径变化不显著,抑菌活性几乎不受影响。其中,木瓜蛋白酶和胰蛋白酶对拮抗液抑菌活性的影响较小,抑菌圈直径分别减少了19.35%和22.58%,与对照组呈显著性差异(p<0.05),链霉蛋白酶对其抑菌活性的影响较大,抑菌圈直径减少了66.21%。从酶处理的结果来看,说明PC-2所产抑菌物质为蛋白类的细菌素物质,其中不含糖苷键和酯键。由于细菌素的氨基酸组成特征不同,造成细菌素对蛋白酶的敏感型不同,与Khochamit等[16],Zheng等[17]的研究结果相似。

图3 蛋白酶对抑菌作用的影响Fig.3 Effect of proteolytic enzyme on the activitiy of bacteriocin from Bacillus PC-2
2.5 菌株鉴定
2.5.1 菌株PC-2菌体形态学观察 菌株PC-2经革兰氏染色为阳性,光学显微镜下菌体呈明显的直杆状、单生,产椭圆形芽孢、中生,结果见图4A;平板上菌落扁平,乳白色,粗糙褶皱,边缘不整齐,结果见图4B,具有典型的芽孢杆菌形态特征。
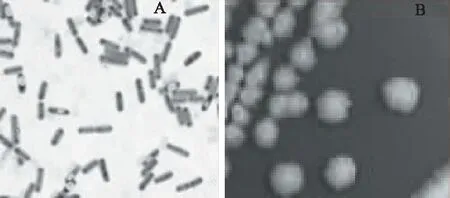
图4 菌株PC-2的形态特征Fig.4 Morphological characteristic of train PC-2
2.5.2 生理生化特征 菌株PC-2的生理生化测定结果见表1。由表1可知,菌株PC-2能还原硝酸盐、水解淀粉且具有液化明胶的能力等。根据鉴定结果查表,并结合革兰氏染色观察结果,可初步确定PC-2菌株属于蜡样芽孢杆菌(Bacillus.cereus)。

表1 芽孢杆菌PC-2的生理生化特征Table 1 Biochemical characteristic of Bacillus PC-2
2.5.3 细菌16S rDNA基因序列分析及系统发育树构建 测试菌株PC-2经扩增电泳后得到约1483 bp的序列。将测序结果输入Genebank中,利用Blast功能对目的序列与Genebank库中的数据序列进行同源性比对。Clustal X 1.8对齐后使用MEGA 5.0计算序列相似性,构建系统发育树,发育树结果见图5。软件进行序列分析后,菌株PC-2与同源性搜索后关系最近的前2株来自蜡样芽孢杆菌的亲缘性最高,与菌株Bacillus.cereusaST307(其登录号为:EU350369.1)处于同一个小分支,亲缘关系最接近。结合菌落形态学特征和生理生化鉴定结果,菌株PC-2被鉴定为蜡样芽孢杆菌(Bacillus.cereus)。
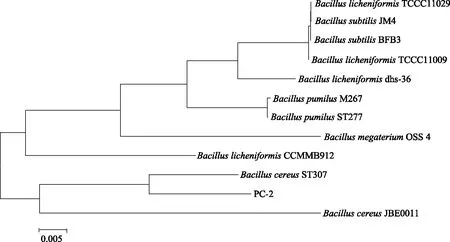
图5 菌株PC-2的16S rDNA序列系统发育树Fig.5 Developmental phylogenetic tree of PC-2 based on 16S rDNA
2.5.4 安全性实验 注射菌液组和对照组小鼠在观察期内生长正常,未出现死亡及异常表现,表明PC-2菌株没有致病性,为安全无毒株。
2.6 温度和pH对细菌素的影响
2.6.1 温度对细菌素的影响 经过不同温度处理后,菌株PC-2拮抗液的抑菌活性变化结果如图6所示。由图6可知,菌株PC-2的拮抗液经70、80、90 ℃处理30 min后,对大肠杆菌的抑菌活性基本无影响,抑菌圈直径保持在(32±0.56) mm范围内;对酵母菌的抑菌活性也无明显影响,抑菌圈直径保持在(30±0.36) mm范围内,表明PC-2所产细菌素有较强的热稳定性。据报道,芽孢杆菌属细菌产生的细菌素特性与本结果一致,枯草芽孢杆菌BS15产生的细菌素80 ℃加热30 min仍保持抑菌活性[18];蜡样芽孢杆菌SS28和NS02所产细菌素,分别于121 ℃、100 ℃加热15 min仍然稳定[19-20];从蜂蜜中分离的抑制幼虫芽孢杆菌的蜡样芽孢杆菌m6c和m387产生的细菌素在70 ℃维持30 min仍活性稳定[14]。

图6 温度处理对抑菌效果的影响Fig.6 Effect of temperature on the activitiy of bacteriocin from Bacillus cereus PC-2
2.6.2 pH对细菌素的影响 不同pH条件下菌株PC-2的拮抗液对大肠杆菌的抑菌活性变化情况如图7所示,由图7可知,PC-2所产细菌素在相对较宽的pH范围(pH2.0~8.0)内抑菌活性稳定,pH9.0~11.0的碱性环境中抑菌活性微弱。在pH5.0的酸性条件下抑菌活性最强,低于或高于此值的偏酸或偏碱环境时,抑菌活性会不同程度递减。pH2.0的偏酸环境时,抑菌活力减少到72.73%,pH8.0的偏碱环境中,抑菌活力减少到50.16%。偏碱环境下的抑菌效果弱于偏酸环境下的抑菌效果,这可能与偏酸性的泡菜汁环境有关。
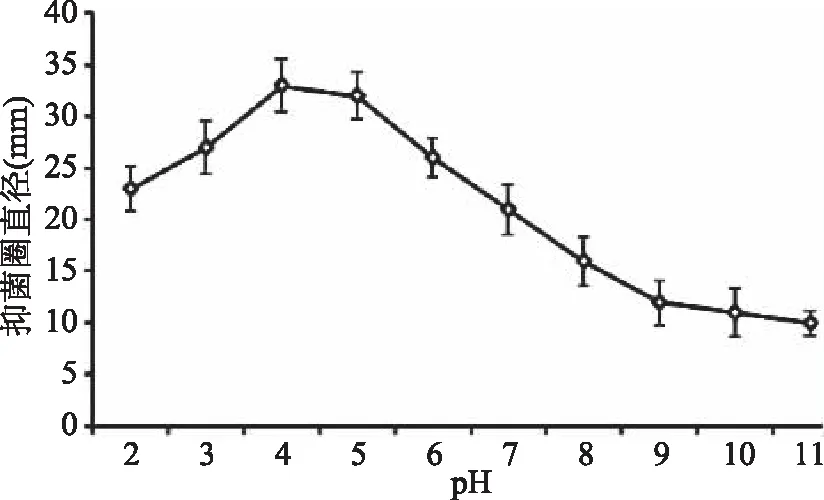
图7 pH对抑菌效果的影响Fig.7 Effect of pH on the activitiy of bacteriocin from Bacillus cereus PC-2
相似研究结果多有报道,Khalil等[21]报道了巨大芽孢杆菌22所产细菌素在pH2~8范围内对鼠伤寒沙门氏菌具有抑菌活性,Naclerio等[22]报道了蜡样芽孢杆菌所产细菌素在3.0~12.0范围内活性均稳定。细菌素的这一特性有利于其在酸性、中性及弱碱性食品中作为防腐剂的使用。
2.7 细菌素抑菌谱
通过琼脂扩散法检测菌株PC-2的拮抗液对多种指示菌的抑菌活性,结果见图8。抑菌谱实验结果表明,该拮抗液具有抑菌作用,且抑菌谱较广,对G+菌(如金黄葡萄球菌)和G-菌(如大肠杆菌)均有抑菌作用,抑菌圈直径均在(32±0.76) mm范围;对单细胞真菌类(如酵母菌)和放线菌(如链霉菌)也有一定的抑制作用,抑菌圈直径分别为(21±0.57) mm和(16±0.38) mm;表明菌株PC-2所产细菌素对细菌的抑制作用比对真菌的明显,对真菌的抑制作用比对放线菌的明显。蜡样芽孢杆菌PC-2所产细菌素对食品污染常见菌的抑制作用更有利于其在生物保鲜方面的应用。

图8 蜡样芽孢杆菌PC-2所产细菌素的抑菌谱Fig.8 Inhibition spectrum of bacteriocin produced by Bacillus.cereus PC-2
3 结论
从传统发酵泡菜中筛选得到1株对大肠杆菌具有明显抑菌作用的芽孢杆菌菌株PC-2,经生理生化和16S rDNA鉴定为蜡样芽孢杆菌(Bacillus.cereus),pH2.0~8.0范围内抑菌活性稳定,pH5.0时抑菌活性最强,该菌的抑菌物质热稳定性好。菌株的拮抗液经不同蛋白酶处理后,抑菌活性均有降低,初步推测抑菌活性物质为细菌素类。该抑菌物质具有较广泛的抑菌谱,为生物保鲜行业的广泛应用奠定了基础。

