老年女性血HCY水平与骨密度的相关性研究
吕晓双 王晓丽 孙侃 周洁 田莉
新疆石河子大学医学院第一附属医院内分泌代谢科,新疆 石河子 832000
骨质疏松症(osteoporosis,OP)是骨量减少,骨微结构受损以及骨脆性增加,易发生骨折的一种全身性、代谢性疾病[1]。随着人口的老龄化和平均寿命的延长,与骨质疏松症相关的发病率和财务成本不断上升,骨质疏松症成为目前严重危害老年人身体健康的疾病之一。已知年龄的增长、女性性别、更年期早期、低体重、吸烟、低钙摄入量、过度饮酒、体力活动缺乏、先验性骨折、髋部骨折史等都是骨质疏松的危险因素。荷兰鹿特丹医学中心的前瞻性队列研究(RSI)认为同型半胱氨酸(homocysteine, HCY)浓度升高可能是老年男、女性骨质疏松性骨折独立而强烈的危险因素[2]。Tyagi 等[3]也提到HCY与骨骼疾病有关,HCY增强破骨细胞的活性,降低成骨细胞的活性,改变细胞基质及骨质胶原的连接,导致骨密度降低。 HCY 可直接影响成骨细胞基质金属蛋白酶(matrix metalloproteinases,MMPs),改变其细胞基质稳定性。本研究旨在探究老年女性HCY、脂质水平等与骨质减少的关系。
1 材料和方法
1.1 对象
收集2016年9月至2017年3月在我院门诊和住院的126例老年女性患者,年龄≥60岁。均排除饮酒、吸烟、服用药物(尤其是影响骨密度及钙代谢的药物)、严重心脑血管病、甲状腺功能亢进、甲状旁腺功能亢进、糖尿病、胃肠道及严重肝肾功能损害和继发性骨质疏松症等。
1.2 方法
1.2.1采集受试者基本信息:包括年龄、绝经年龄、身高、体重、月经史和生育史、生活方式。
1.2.2骨密度的检测:采用美国通用公司(GE Medical Systems)生产的双能X线骨密度检测仪检测腰椎 L1~L4节段及股骨颈骨密度(bone mineral density,BMD)。
1.2.3骨质疏松的诊断:参照1994年世界卫生组织(WHO)推荐的诊断方法[4],测得的骨密度与同性别峰值骨密度相比,其骨密度下降标准差,如有一个或一个以上部位T值≤-2.5SD为骨质疏松;-2.5
1.2.4标本采集及血清参数测定:所有受检者晨起抽空腹肘正中静脉血2 mL,置入促凝管中 1 h后低温高速离心(3 500 r/min)10 min,取血清于1.5 mL 无酶EP管中,-80 ℃冰箱保存待测。HCY 采用上海酶联生物科技有限公司提供的酶联免疫吸附试剂盒法测定。采用罗氏全自动生化分析仪(型号 ModularDPP-H7600)检测血钙(calcium,Ca)、血磷(phosphorus,P)、碱性磷酸酶(alkaline phosphatase,ALP)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDLC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDLC)、甘油三酯(triglycerides, TG)等生化指标。
1.3 统计学处理

2 结果
2.1 三组间一般资料的比较
三组患者年龄、绝经时间的比较差异无统计学意义(P>0.05)。骨质疏松组身高、体重明显低于骨量减少组及骨量正常组,差异有统计学意义(P<0.05)。与骨量正常组相比,骨质疏松组绝经年龄明显偏低,差异有统计学意义(P<0.05)见表1。

表1 三组间一般资料比较Table 1 Comparison of general characteristics between the groups
注:与骨量正常组比较,*P<0.05
2.2 三组间HCY及其他生化指标的比较
三组间高密度脂蛋白胆固醇、血钙、血磷、碱性磷酸酶之间比较差异无统计学意义(P>0.05)。骨质疏松组甘油三酯低于骨量正常组,差异有统计学意义(P<0.05)。骨量正常组血同型半胱氨酸(P<0.001)、低密度脂蛋白胆固醇(P<0.05)明显低于骨量减少组和骨质疏松组,差异有统计学意义。见表2。
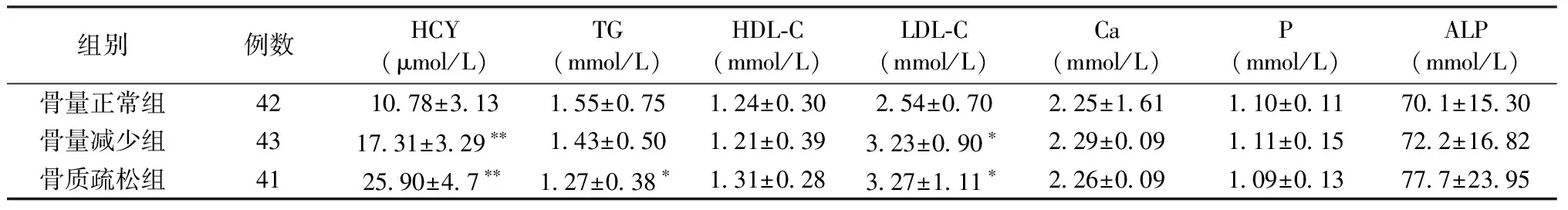
表2 三组间HCY及其他生化指标比较Table 2 Comparison of HCY and biochemical indicators between the groups
注:与骨量正常组比较,*P<0.05,**P<0.01
2.3 老年女性骨质减少的危险因素分析
以骨质减少为应变量,绝经年龄、体重、血清HCY、LDL-C、TG 水平为自变量进行二项分类Logistic 回归分析,结果显示,低体重及HCY、LDL-C水平升高是骨质减少的危险因素,见表 3。
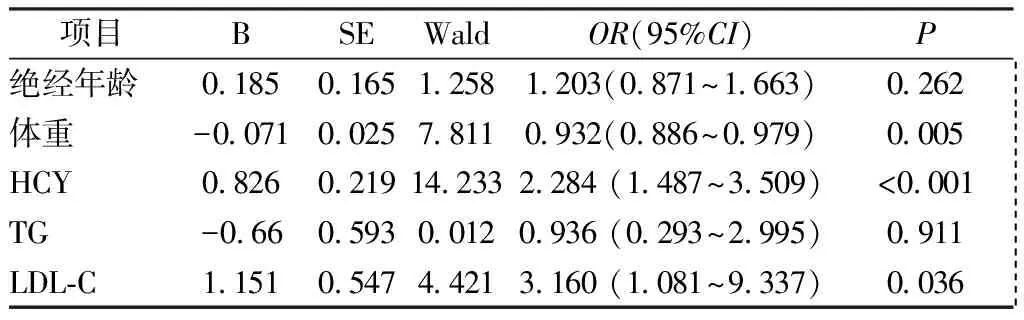
表3 骨质减少的影响因素Table 3 Influencing factors of bone loss
3 讨论
本研究发现骨质疏松组的身高、体重、绝经年龄明显低于骨量减少及骨量正常组,这与既往研究结果一致,体重越小,绝经越早,发生骨质疏松症的可能性就越大。与骨量正常组和骨量减少组相比,骨质疏松组HCY、LDLC水平明显升高。多因素分析发现HCY、LDL-C与骨密度呈显著负相关。
HCY是一种含硫氨基酸,属于非必须氨基酸,是蛋氨酸代谢的中间产物。已有大量研究证实HCY为心血管疾病的独立危险因素。HCY浓度升高可损害血管内皮细胞,且HCY浓度越高内皮细胞受损程度越严重[5],而内皮细胞损伤是动脉粥样硬化的主要原因。因此推测HCY可能对成骨细胞也有类似作用,抗酒石酸酸性磷酸酶((tartrate-resistant acid phosphatase,TRAP)可反映骨细胞活性,Koh等[6]利用鼠骨髓细胞,发现生理浓度的HCY可上调TRAP阳性的多核细胞和TRAP的活性,同时,刺激actin环的形成、增加每个细胞的核数目和整合素β3 mRNA的表达。此外,HCY刺激p38丝裂原活化蛋白激酶的活性和细胞内活性氧簇(ROS)的产生[7]。研究显示,HCY通过增加细胞内ROS直接激活破骨细胞的形成及其活性,提示伴有轻度到中度hHCY的个体破骨细胞介导的骨吸收增加,导致骨质疏松形成。刘文华等[8]对269例绝经后女性研究发现骨量减少与炎症指标(NLR,CRP)、脂质代谢指标(LDL)、氧化应激指标(HCY)有关,骨质减少组的NLR、CRP、LDL、HCY明显高于骨量正常组。HCY升高被认为是引起骨质疏松的危险因素,机制主要是促进骨髓基质细胞凋亡,使成骨细胞细胞活性降低,骨形成减少。HCY还增加了破骨细胞的数目和活性,使骨吸收增强。并阻碍胶原蛋白纤维与组织的连接,而减低骨密度。另外,本研究发现骨质疏松组甘油三酯明显低于骨量正常组,而骨质疏松组低密度脂蛋白胆固醇高于骨量正常组,进行Logistic回归分析发现TG、LDLC与骨密度无明显相关性。这与蔡晓燕等[9]对418例骨质疏松及319例健康者的TG水平与骨质疏松的研究结果相反。伊朗的一项关于绝经后女性横断面调查[10]显示未经调整的胆固醇水平和骨密度之间呈负相关(P=0.037),但当调整体重和BMI后进行线性回归分析,发现血清总胆固醇水平和股骨BMD之间没有相关性。尤婷婷等[11]的动物实验表明,脂肪乳喂养大鼠的甘油三酯升高同时伴有骨密度的降低。本研究表明 LDLC水平升高促进骨量的丢失,可能的机制是LDLC增高促进破骨细胞生成、骨吸收及诱发炎症反应,同时抑制成骨细胞生成,从而影响了骨细胞基质微环境,引起骨质疏松。
综上所述,血清HCY、LDLC水平升高,TG水平下降是骨质减少的危险因素。监测HCY、LDLC水平对早期发现骨质减少并防止其进一步发展有着重要的作用,降低HCY、LDLC水平是否能成为预防或治疗骨质疏松的方法需进一步明确。

