姜黄素对类风湿关节炎破骨细胞分化中NF-κB p65和NFATc1表达的影响
商玮 徐子涵 郭郡浩 董晓蕾 赵智明 蔡辉
解放军南京总医院中西医结合科,江苏 南京 210002
类风湿关节炎(rheumatoid arthritis,RA)是以慢性滑膜炎和骨破坏为特征的自身免疫性疾病[1]。关节周围骨侵蚀主要发生于滑膜与软骨交界处,可导致关节间隙狭窄,从而发生不同程度的关节僵硬、畸形,造成RA患者功能障碍和残疾。破骨细胞(osteoclast,OC)在这一病理过程中起关键作用,研究表明RA患者OC活性增加可加重全身性骨丢失[2]。活化T细胞核因子c1(nuclear factor of activated T cells cytoplasmic 1,NFATc1)是促进OC分化的关键调节因子,核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)通过核因子-κB(nuclear factor kappa B,NF-κB)/AP-1/c-fos和钙离子信号通路两条信号通路调节NFATc1的活化,促进OC分化[3]。
姜黄素(curcumin,Cur)是从中药姜黄中提取的一种低分子量的酚类物质,具有抗炎、抗氧化和抗癌活性[4],已有研究发现Cur能改善RA患者疾病活动度[5]。本课题前期发现Cur能调节RANKL/OPG比值,提高佐剂性关节炎大鼠骨密度水平[6],但其具体作用机制尚不明确。本研究通过应用Cur干预RA患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC),检测其对OC生成及NF-κB p65、NFATc1蛋白表达的影响,探讨Cur影响RA患者OC生成的可能机制。
1 材料和方法
1.1 研究对象
血液标本来源:确诊活动期RA患者12例,年龄(56.3±15.1)岁,RA诊断均符合2010年RA的ACR/EULAR分类标准[7],所有患者均签署知情同意书,并经过我院伦理委员会批准。
1.2 材料
NF-κB p65、NFATc1多克隆抗体(Cell Signaling Technology公司,美国),RANKL、巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)(Pepro Tech公司,美国),α-MEM培养基(Gibco公司,美国),胎牛血清(fetal bovine serum,FBS)(杭州四季青生物工程材料有限公司,中国),人淋巴细胞分离液(Sigma公司,美国),抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(南京建成科技有限公司,中国),姜黄素标准品(批号:FY13561019,南通飞宇生物科技有限公司,中国)。
1.3 方法
1.3.1RA-OC原代培养及鉴定:采用密度梯度离心法分离RA患者PBMC,以2×106个/cm2的密度接种于培养皿中[8],在37 ℃、5% CO2培养箱内孵育2~3 h,吸除皿内培养液以去除悬浮细胞,将贴壁细胞用胰酶消化,将细胞调节成2×105个/cm2接种于24孔板中,用含100 ng/mL RANKL、50 ng/mL M-CSF及20% FBS的α-MEM完全培养液培养,置于37 ℃、5% CO2培养箱中,2~3 d换液一次。细胞形态学观察、TRAP染色及骨吸收试验对RA-OC进行鉴定。
1.3.2Cur细胞毒性检测:取96孔板,各孔加入100 μL的PBMC细胞悬液(5×105/mL),37 ℃孵育过夜,加入含Cur培养基,浓度为0、2.5、5和10 μmol/L,每组3个复孔,分别孵育24、48 和72 h,加入CCK-8溶液10 μL,37 ℃孵育4 h,于450 nm 波长处测吸光度,计算细胞存活率。细胞存活率(%)=(实验组OD值/对照组OD值)×100%。
1.3.3TRAP染色检测Cur对RA-OC分化的影响:RA患者PBMC在含100 ng/mL RANKL、50 ng/mL M-CSF、20% FBS及不同浓度Cur(0、2.5、5和10 μmol/L)的α-MEM培养液中培养,2~3 d换液。14 d后,参照TRAP染色试剂盒说明书进行TRAP染色,光镜下观察染色结果,并随机选取10个视野,计数TRAP阳性细胞(细胞核≥3个,胞质呈酒红色),结果用“个/10个视野”表示,每孔重复计数3次。
1.3.4NF-κB p65蛋白表达的检测:Western-blotting检测:细胞培养14 d后,用细胞核蛋白与细胞浆蛋白抽提试剂盒提取核蛋白和胞浆蛋白,进行蛋白定量,100 ℃变性3~5 min,上样后进行蛋白电泳、转膜,5%脱脂奶粉封闭2 h,NF-κB p65一抗(1∶1000稀释)4 ℃孵育过夜(胞浆蛋白以β-Actin为内参,核蛋白以Lamin B1为内参),二抗(1∶2000稀释)室温振荡孵育2 h,滴加ECL试剂于X线下曝光显影,计算各条带的灰度值,结果以目的蛋白与内参蛋白灰度值之比来表示。免疫荧光染色检测:将分离获得的PBMC接种于24孔板内无菌盖玻片上,设阴性对照组(M-CSF+/RANKL-)、阳性对照组(M-CSF+/RANKL+)、Cur 5 μmol/L组(M-CSF+/RANKL+/Cur 5 μmol/L),按分组加入含有细胞因子和干预药物的培养液,培养14 d后4%多聚甲醛固定,0.5% Triton透化15 min,1% BSA室温封闭30 min, 5% BSA稀释的NF-κB p65多克隆一抗(1∶50),4 ℃孵育过夜,5% BSA稀释的TRITC标记的羊抗兔IgG(1∶200),37 ℃避光孵育1 h,5 μg/mL DAPI避光孵育5 min,封片固定,于荧光显微镜下观察并拍摄图片。
1.3.5NFATc1蛋白表达的检测:Western-blotting检测:细胞培养14 d后,提取细胞总蛋白,进行蛋白定量, 100 ℃变性3~5 min,上样后进行蛋白电泳、转膜,5%脱脂奶粉封闭2 h,NFATc1一抗4 ℃孵育过夜,以β-Actin为内参,二抗室温振荡孵育2 h,滴加ECL试剂于X线下曝光显影,计算各条带的灰度值,结果以目的蛋白与内参蛋白灰度值之比来表示。
1.4 统计学处理

2 结果
2.1 RA-OC的原代培养及鉴定
形态学观察:培养至第14天,胞体明显增大,可见多个多核细胞,折光性强,形态呈类圆形和不规则形,可见片状伪足和丝状突起,胞内有3~5以上的细胞核,胞浆内可见大小不等的空泡,符合OC形态特征。(图1 A)
TRAP染色:200×光镜下可见形态不规则、体积较大的多核细胞。胞浆见散在的紫红色颗粒样沉淀,颜色较深。苏木精复染后,细胞核呈蓝紫色,胞核3~5个以上不等,符合TRAP染色阳性特征。(图1B)
骨吸收陷窝检测:取与细胞共培养21 d的骨磨片,在光镜下观察可见骨表面有大小不等,深浅不一,不规则椭圆形的骨吸收陷窝,边缘清晰。甲苯胺蓝染色后,骨吸收陷窝呈蓝紫色异染(图1C)。扫描电镜下观察,可见陷窝底部具有因骨胶原纤维残留而显粗糙的骨吸收特征。(图1D)

图1 RA-OC的鉴定A. 细胞形态学观察(200×)B. TRAP染色(200×)C. 倒置显微镜下骨吸收陷窝(200×)D. 扫描电镜下骨吸收陷窝(1000×)Fig.1 Identification of osteoclasts from RA patientsA. Observation of cell morphology (200×). B. TRAP staining (200×). C. Bone resorption lacunae observed by inverted microscope (200×). D. Bone resorption lacunae observed by scanning electron microscope (1000×).
2.2 Cur对细胞存活率的影响
CCK-8检测结果显示,培养24、48 和72 h,各浓度组与对照组相比,对PBMC细胞存活率无明显影响(P>0.05)(图2),说明Cur 2.5、5和10 μmol/L的浓度对PBMC未产生细胞毒性。

图2 Cur对细胞存活率的影响Fig.2 The effect of curcumin on cell viability
2.3 Cur对RA-OC分化的影响
200×光镜下见,Control组为正常OC,细胞形态均一、分布均匀、轮廓清晰,有3~5个以上细胞核(图3 A)。经不同浓度Cur干预后,视野内OC数量明显减少,形态各异,大部分为未分化成熟的破骨细胞前体细胞(osteoclast precursor,OCP)(图3 B、3C、3D)。TRAP+细胞计数结果显示,与Control组比较,Cur 2.5 μmol/L组、Cur 5 μmol/L组和Cur 10 μmol/L组TRAP+细胞数均明显减少(P<0.05),说明Cur对RA-OC分化具有抑制作用。(图4)

图3 TRAP染色(200×)A. Control组;B. Cur 2.5 μmol/L 组;C. Cur 5 μmol/L 组;D. Cur 10 μmol/L 组Fig.3 TRAP staining(200×)A. Control Group;B. Cur 2.5 μmol/L Group;C. Cur 5 μmol/L Group;D. Cur 10 μmol/L Group
2.4 Cur对RA-OC NF-κB p65表达的影响
分别提取各组细胞的细胞浆蛋白和细胞核蛋白,通过Western-blotting检测NF-κB p65在细胞浆和细胞核中的表达,观察NF-κB p65入核表达情况。结果显示,与Control组相比,Cur 2.5 μmol/L组、Cur 5 μmol/L组和Cur 10 μmol/L组细胞浆中NF-κB p65的蛋白表达明显升高,而细胞核中NF-κB p65的蛋白表达明显下降(P<0.05),提示Cur具有抑制NF-κB p65入核表达的作用,并且随着干预浓度的增加,抑制NF-κB p65入核表达的作用更加明显。(图5)

图5 Cur对RA-OC细胞浆和细胞核中NF-κB p65表达的影响注:* P<0.05Fig.5 The effect of curcumin on the expression of NF-κB p65 in cytoplasm and nucleus of osteoclasts of RA patientsNote: * P<0.05

图4 Cur对RA-OC分化的影响注:* P<0.05Fig.4 The effect of curcumin on osteoclast differentiation in RA patientsNote:* P<0.05
通过细胞免疫荧光染色法观察Cur对RA-OC NF-κB p65核易位的影响。由图6我们观察到,阴性对照组NF-κB p65主要分布于细胞浆中;RANKL干预后,NF-κB p65在细胞浆的表达减少,在细胞核的表达增加;5 μmol/L Cur干预后,与阳性对照组相比,NF-κB p65在细胞浆的表达增加,在细胞核的表达减少, 提示Cur具有抑制RA-OC NF-κB p65核易位的作用。
2.5 Cur对RA-OC NFATc1表达的影响
Western-blotting检测NFATc1蛋白的表达,结果显示,Cur 2.5 μmol/L组、Cur 5 μmol/L组和Cur 10 μmol/L组细胞中NFATc1蛋白表达水平均低于Control组(P<0.05),提示Cur显著抑制RA-OC NFATc1蛋白的表达。(图7)
3 讨论
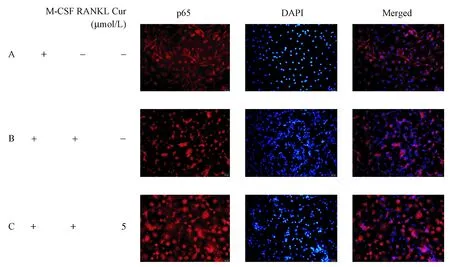
图6 免疫荧光检测NF-κB p65在RA-OC中的表达Fig.6 Detection of NF-κB p65 expression in osteoclasts of RA patients by immunofluorescence staining
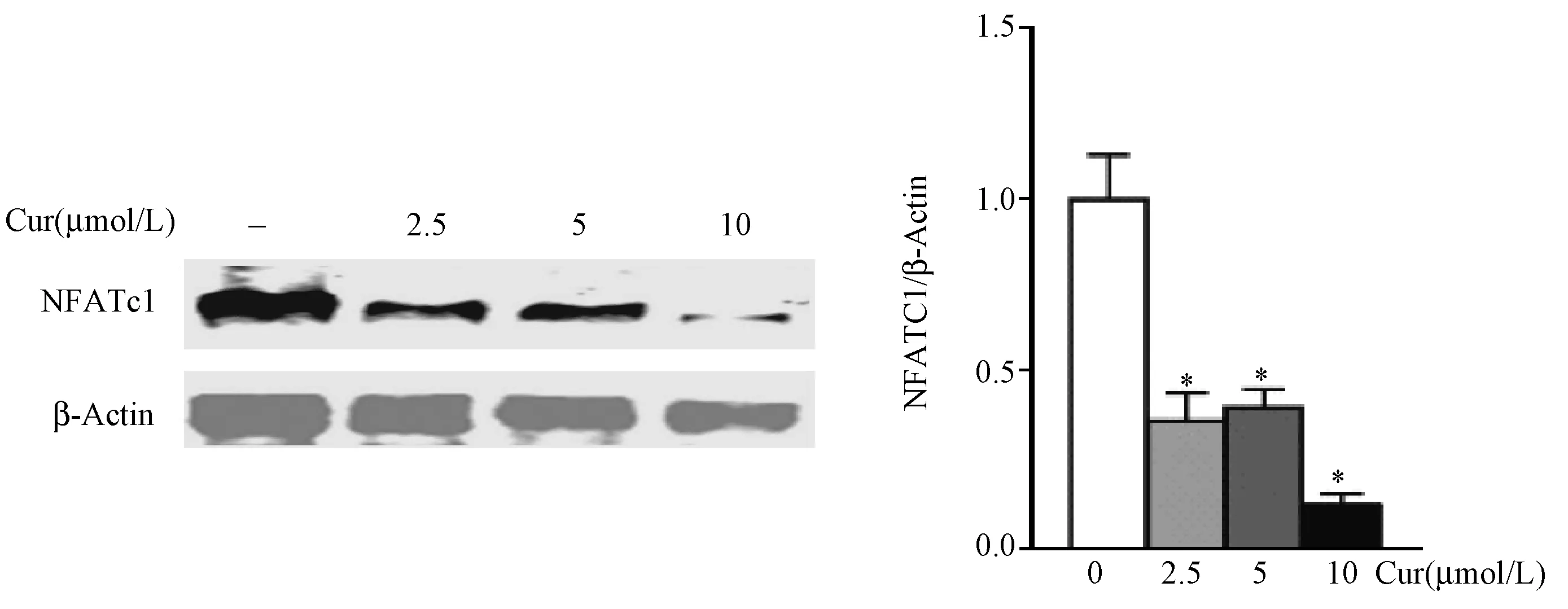
图7 Cur对RA-OC NFATc1表达的影响注:* P<0.05Fig.7 The effect of curcumin on the expression of NFATc1 in osteoclasts of RA patientsNote:* P<0.05
滑膜炎导致的关节软骨和骨的破坏是RA病理变化的中心环节,是患者发生关节变形和残疾的主要原因。RA关节局部的成纤维样滑膜细胞(fibroblast-like synovial cells,FLS)释放大量的炎症介质,形成局部炎症环境[3],分泌RANKL与OCP表面上的 RANK 结合后,通过NF-κB/AP-1/c-fos和钙离子信号两条信号通路,调节NFATc1的活化,促进OC分化[9]。NFATc1是OC分化的关键转录因子,NFATc1被激活后可转录出OC特异性基因如TRAP、组织蛋白酶K、基质金属蛋白酶-9[10]。
Cur是从姜黄中获得的四萜类化合物,具有抗炎、抗氧化和抗癌活性[4]。在本课题组前期研究工作[6,11,12]基础上,本实验进一步探索Cur在治疗RA骨破坏中的作用及其可能机制,通过体外诱导RA患者PBMC分化为OC,经形态学观察、TRAP染色、骨吸收陷窝实验对OC进行鉴定,结果显示本实验中使用的外周血单核细胞诱导法能成功获得分化成熟且具有骨吸收功能的OC。选用对细胞存活率无明显影响的浓度2.5、5和10 μmol/L作为本实验Cur干预浓度,在实验中观察到Cur具有抑制RA-OC分化的作用。
OC的分化涉及数条通路,其中NF-κB/NFATc1信号通路是OC分化中的重要信号途径之一[13]。NF-κB转录因子在细胞因子、病原体和辐射等刺激的影响下被快速的激活。p65是NF-κB核转录因子的核心亚基,转入到细胞核后,驱动靶基因的表达而发挥功能[14]。本实验分别提取细胞浆蛋白和细胞核蛋白,检测NF-κB p65在细胞浆和细胞核中的表达,结果提示Cur具有抑制NF-κB p65入核表达的作用。免疫荧光结果与Western-blotting结果与相一致,分别从NF-κB p65的定量及定位表达说明Cur具有抑制RA-OC NF-κB p65核易位的作用。Bharti等[15]研究发现Cur能抑制RAW264.7 OC形成,与抑制NF-κB的活化有关,本研究的结果与其研究结果相符合。
NFATc1是重要转录调节因子,参与OC特异性基因的调控表达,对OC分化、融合、粘附及骨吸收功能至关重要[16]。本研究通过Western-blotting检测各组NFATc1蛋白的表达,结果提示Cur抑制NFATc1在RA-OC中的表达。OCP的RANK活化后,激活多条途径诱导NFATc1的活化,而NFATc1是NF-κB信号的靶基因。因而,Cur导致的NFATc1表达的抑制,可能与其对NF-κB活化的抑制有关,同时,NFATc1表达的抑制,影响了RA-OC的分化与成熟。
综上,Cur能抑制RA-OC分化过程中的NF-κB信号,抑制NF-κB p65的入核表达,降低转录因子NFATc1的表达,从而抑制RA-OC的分化。本研究进一步阐明Cur改善RA骨破坏的作用机制,为开发Cur相关药物应用于RA治疗提供了实验依据。

