麝香对骨缺损模型大鼠HMGB1和BMP2表达的影响
李宁 谢兴文 宋敏 李建国 白壁辉 柴利军 周文杰*
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中医院,甘肃 兰州 730000
道路交通伤及我国老龄化社会的到来,致使骨折的发生率大幅度提高[1-3]。如何提高骨折后骨缺损的治愈率及愈合时间是骨科研究的热点与难点。已有研究表明,麝香不仅能够阻断IL-1β对体外终板软骨细胞的破坏[4],而且能够增加骨密度,对骨坏死有治疗作用[5]。前期研究发现,麝香可促进颅骨骨缺损模型大鼠骨组织中基质细胞衍生因子1、单核细胞趋化蛋白 1和肝细胞生长因子的表达。本项研究采用蛋白印迹技术拟检测高迁移率族蛋白1(highmobilitygroupbox-1protein,HMGB1)和骨形态发生蛋白2(bone morphogenetic protein-2,BMP2)的表达,以期探讨麝香促进骨缺损愈合的可能作用机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物:健康6周龄SPF级SD大鼠300只,雌雄各半,体重(200±20)g,均购自甘肃中医药大学实验动物中心,适应性喂养7 d,自由进食水。动物设施使用证明No:00000230,动物合格证号:62001000000201。
1.1.2药物和试剂:麝香(兰州安泰堂中药饮片有限公司,批号:20151001)。氯胺酮注射液(西安力邦制药有限公司,国药准字H20054749)。BCA蛋白浓度测定试剂盒(批号:20151231)、SDS-PAGE凝胶制备试剂盒(批号:20160118),北京索莱宝有限公司;抗HMGB1兔多克隆抗体、抗BMP2兔多克隆抗体,生工生物工程股份有限公司;GAPDH(批号:ZS-257780)、山羊抗兔IgG/辣根酶标记(批号:122107),北京中杉金桥生物技术有限公司;ECL显色试剂(批号:1515601),美国 Millipore公司。
1.1.3设备:90颅骨钻(STRONG公司);DNM-9602酶标分析仪,北京普朗新技术有限公司; PowerPoc Basic凝胶电泳仪、ChemiDocTMXRS+凝胶成像分析仪,美国Bio-rad公司。
1.2 方法
1.2.1颅骨骨缺损模型的制备:适应性喂养7 d后,按照0.1 g/kg的剂量腹腔注射氯胺酮,麻醉显效后,俯卧位固定大鼠头部及四肢,头部术区褪毛、碘伏消毒,取1~1.5 cm的纵行切口,分离骨膜、暴露颅骨,利用颅骨钻在顶骨造成直径约6 mm的圆形骨缺损,盐水冲洗,去除残存骨屑,逐层缝合后用碘伏消毒伤口。
1.2.2分组与给药:造模完成后将大鼠按体重采用随机数字表法分为对照组和给药组,每组150只,再将这两个组按照第7、14 和28 天分为3个小组,每组50只。给药组按42 mg/kg灌服麝香,对照组灌服等体积的生理盐水,均每日灌胃1次。
1.2.3标本采集与指标检测:分别在第7、14 和28 天时进行颅骨骨缺损处取材。组织蛋白的提取严格按照BCA法蛋白质浓度测定试剂盒说明操作,蛋白上样总量每个泳道为40 μg。SDS-PAGE凝胶制备严格按照试剂盒说明操作,120 V电泳至溴酚蓝移到凝胶底部,冰水浴200 mA转膜60 min,5 %脱脂奶粉封闭90 min,分别加入BMP2一抗(稀释度为1∶500)、HMGB1一抗(稀释度为1∶2000)和GAPDH一抗(稀释度为1∶2000),冰箱4 ℃过夜。第二天TBST洗膜3次,每次10 min,山羊抗兔辣根酶标记的二抗室温孵育90 min(稀释度为1∶4000),TBST洗膜3次,每次10 min。ECL发光液显影后凝胶成像分析仪采集图像信号,Image J软件分析各组条带,将各组灰度值与内参比较即得HMGB1和BMP2的相对表达量。
1.3 统计学处理
2 结果
给药组HMGB1、BMP2在第7 天的表达均达到峰值(P<0.05),第14 天时降低,第28 天时表达最低;与对照组比较,第7 天 HMGB1、BMP2表达均有统计学意义(P<0.05);给药组第7 和14 天 HMGB1的表达明显高于本组第28 天(P<0.05)。见图1和表1。

图1 HMGB1和BMP2在颅骨骨缺损模型大鼠组织中表达的结果Fig.1 Expression of HMGB1 and BMP2 in rat models of calvarial defect注:A、B、C为对照组,D、E、F为给药组
3 讨论
在临床上由创伤、感染、畸形矫正等因素造成的骨缺损最为常见。目前,治疗骨缺损的方法包括骨移植、Masquelet技术、基因治疗等,但这些方法都有不同的缺点和局限性[6-8]。近些年,研究较多的组织工程技术为骨缺损的治疗提供了新思路,而种子细胞、激活因子和支架材料等是其研究的主要方面[9]。
HMGB1是存在于真核细胞核内的非组蛋白染色体结合蛋白,与DNA的复制、转录以及细胞运动密切相关,因其在聚丙烯酞胺凝胶电泳(PAGE)中迁移速度快而得名[10]。近年来,HMGB1在炎症过程中作为晚期炎性因子出现而备受关注,由损伤和坏死的细胞释放,此外,内毒素及多种炎性因子均可诱导HMGB1的释放从而介导炎性反应[11,12]。Wang等[13]研究发现尼古丁能抑制由内毒素或TNF-α诱导HMGB1的释放,并提高脓毒症实验模型的生存率。BMPs是一类能促进骨形成和再生的诱导剂,属于TGF-β超家族,其中BMP2是研究的热点,它可诱导间充质干细胞向成骨细胞分化,在骨折愈合的早期发挥了重要的成骨作用[14-16]。Wu等[17]研究发现低功率激光照射能诱导BMP2促使小鼠骨髓间充质干细胞的增殖和成骨分化。董万涛等[18]对胫骨骨缺损兔模型的研究发现,消定膏促进骨缺损愈合的机制与TGF-β/BMPs信号通路有关。
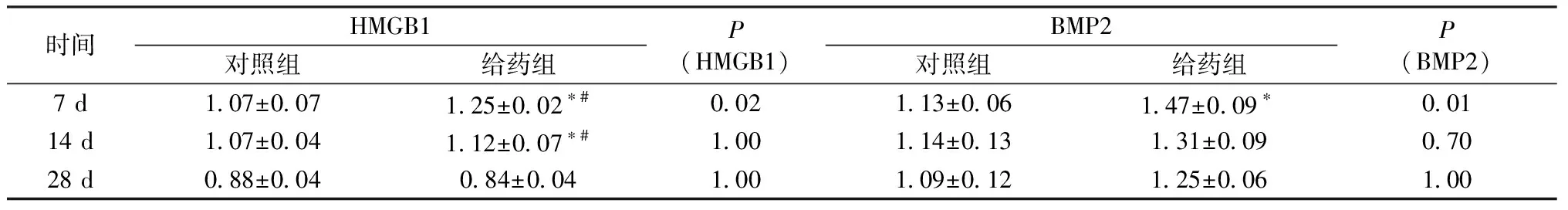
表1 颅骨骨缺损模型大鼠骨组织中HMGB1和BMP2的表达水平Table 1 Expression levels of HMGB1 and BMP2 in bone tissue of rats with cranial bone defect
注:与对照组比较,*P<0.05;与本组第28天比较,#P<0.05
麝香具有开窍醒神、活血通经、消肿止痛之功效[19]。现代研究发现,麝香主要含大环化合物、甾体化合物、多肽蛋白质类化合物等,对中枢神经系统、心血管系统、免疫系统、呼吸系统、内分泌和生殖系统等有广泛的生理活性[20,21]。本次研究发现,麝香可促进HMGB1、BMP2在骨缺损处骨组织中的表达,在第7 d时HMGB1和BMP2的表达最高,随后依次降低,说明麝香在骨缺损的愈合过程中发挥了作用,促使相关的因子向骨缺损处的迁移,那么,麝香是否能够促进更多的细胞因子的表达以及通过哪些途径迁移至骨缺损处有待进一步的研究。

