去势抵抗性前列腺癌差异表达基因及其关键通路的生物信息学分析
王文刚,张维涛,王世霞,方 东,王 鹏,程 川
(1.泰山医学院研究生院,山东泰安 271016;2.泰山医学院附属医院泌尿外科,山东泰安 271000)
前列腺癌是目前全球癌症死亡的主要原因之一[1]。虽然我国前列腺癌的发病率比较低,但随着我国人口老龄化、饮食结构变化以及前列腺特异抗原(prostatic specific antigen,PSA) 筛查的广泛展开,我国前列腺癌的发病率呈上升趋势。虽然早期大多数前列腺癌患者对内分泌治疗有效,但在经过中位时间18~24个月的缓解期后,几乎所有患者最终由雄激素依赖性前列腺癌(androgen dependent prostate cancer,ADPC)发展成为去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC),最终死于前列腺癌[2],转移性去势抵抗性前列腺癌(metastatic castration resistant prostate cancer,mCRPC)患者中位生存时间更是低于2年[3]。
随着生物信息学技术的发展,前列腺癌内分泌治疗耐药机制的研究取得了很大进展。雄激素-雄激素受体(androgen receptor,AR)信号通路的一系列改变被认为是CRPC发生耐药的一个重要机制,包括AR的再活化(通过AR扩增、突变或变异)、通过异常通路激活AR、以及肿瘤内雄激素的产生和可替代的雄激素的产生[4-5]。也有研究表明,非雄性激素通路的激活作用(通过配体依赖性的非甾体分子或不依赖配体而激活雄激素受体的下游信号来激活雄激素受体),使前列腺癌细胞的增长和扩散已不再受雄性激素的控制,从而产生内分泌治疗耐药。因此,尽管雄激素受体机制依然活跃,但前列腺癌细胞的增长和扩散已不再受雄性激素的控制,这种类型的激活被称为非雄性激素激活[6-7]。尽管关于CRPC耐药机制已经取得一些进展,但目前其具体机制尚未完全阐明。
在本研究中,应用生物信息学方法分析CRPC的基因表达谱,并制定了去势抵抗和激素敏感前列腺癌细胞之间的差异表达基因(differentially expressed genes,DEGs)。同时,构建了DEGs的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,用以发掘涉及去势抵抗性前列腺癌的关键差异基因。研究的目的是进一步加强对激素耐药机制的理解,并在去势抵抗性前列腺癌中寻找一些新的潜在治疗靶点。
1 资料与方法
1.1样本来源在美国国立生物信息技术中心(National Center for Bio-technology Information,NCBI) 的公共基因芯片数据库(Gene Expression Omnibus,GEO)[8]中获得的登陆号为GSE32269的基因芯片数据。研究采用的是由GPL966实验平台采集的51个样本,其中22个样本为原发性局限性前列腺癌基因芯片表达谱数据,29个样本为骨转移去势抵抗性前列腺癌基因芯片表达谱数据。
1.2方法
1.2.1数据处理及差异表达 利用R统计软件进行数据分析和处理。Limma软件包对前列腺癌及趋势抵抗性前列腺癌基因芯片表达谱数据进行数据挖掘机生物信息学分析,获得其两者的差异表达基因,选择差异最显著(差异表达倍数>1.5,P<0.01)的270个差异表达基因作为研究对象。
1.2.2GO功能分析及通路富集分析 本研究主要应用DAVID数据库中的GO功能及KEGG通路富集分析模块对筛选的显著差异表达基因进行分析。GO功能分析包括分子功能(molecular function,MF)、生物过程(biological process,BP)和细胞成分(cellular component,CC)分析。
1.2.3构建蛋白-蛋白相互作用网络(PPI网络) 应用在线分析工具STRING对DEGs的PPI网络进行分析,并利用Cytoscape软件对其进行网络绘制。
2 结 果
2.1DEGs的筛选根据设定的参数(差异表达倍数>1.5,P<0.01),用R软件对两组样本进行比较后,共发掘出270个显著差异基因,其中上调差异基因141个,下调差异基因129个。
2.2上调及下调差异基因的KEGG通路富集分析通过DAVID分析,上调差异基因主要集中在ECM受体相互作用、PI3K-Akt信号通路、局灶粘连、蛋白质消化吸收、阿米巴病等通路中;下调差异基因主要集中在矿物吸收、肾素-血管紧张素系统、酪氨酸代谢等通路中。结果见表1。
表1上调及下调差异基因的KEGG通路富集

分类功能计数P值UpregulatedDEGs KEGG_PATHWAYhsa04512:ECM⁃receptorinteraction147.49×10-14 KEGG_PATHWAYhsa04151:PI3K⁃Aktsignalingpathway142.06×10-6 KEGG_PATHWAYhsa04510:Focaladhesion135.09×10-8 KEGG_PATHWAYhsa04974:Proteindigestionandabsorption102.29×10-8 KEGG_PATHWAYhsa05146:Amoebiasis91.58×10-6DownregulatedDEGs KEGG_PATHWAYhsa04978:Mineralabsorption58.65×10-4 KEGG_PATHWAYhsa04614:Renin⁃angiotensinsystem31.94×10-2 KEGG_PATHWAYhsa00350:Tyrosinemetabolism34.25×10-2
2.3上调及下调差异基因的GO功能富集分析利用DAVID对上调及下调差异基因所参与的分子功能、生物过程和细胞成分进行分析。其中上调基因参与的主要分子功能有:蛋白质结合、胶原结合、细胞外基质结构组成、肝素结合、细胞外基质结合;生物过程有:细胞外基质组织、细胞粘附、细胞增殖、胶原分解代谢过程、细胞分裂;细胞成分有:细胞质、细胞外空间、核质、细胞外基质、胶原蛋白三聚体。下调基因参与的主要分子功能有:肌动蛋白结合、丝氨酸型内肽酶活性、丝氨酸型肽酶活性、钙调蛋白结合、细胞骨架的结构成分;生物过程有:氧化还原过程、蛋白水解、细胞粘附、肌肉收缩、药物反应;细胞成分有:细胞外基质外来体、细胞质、胞外空间、细胞质核周区域、局灶粘连。结果见表2。
表2上调及下调差异基因的GO功能富集
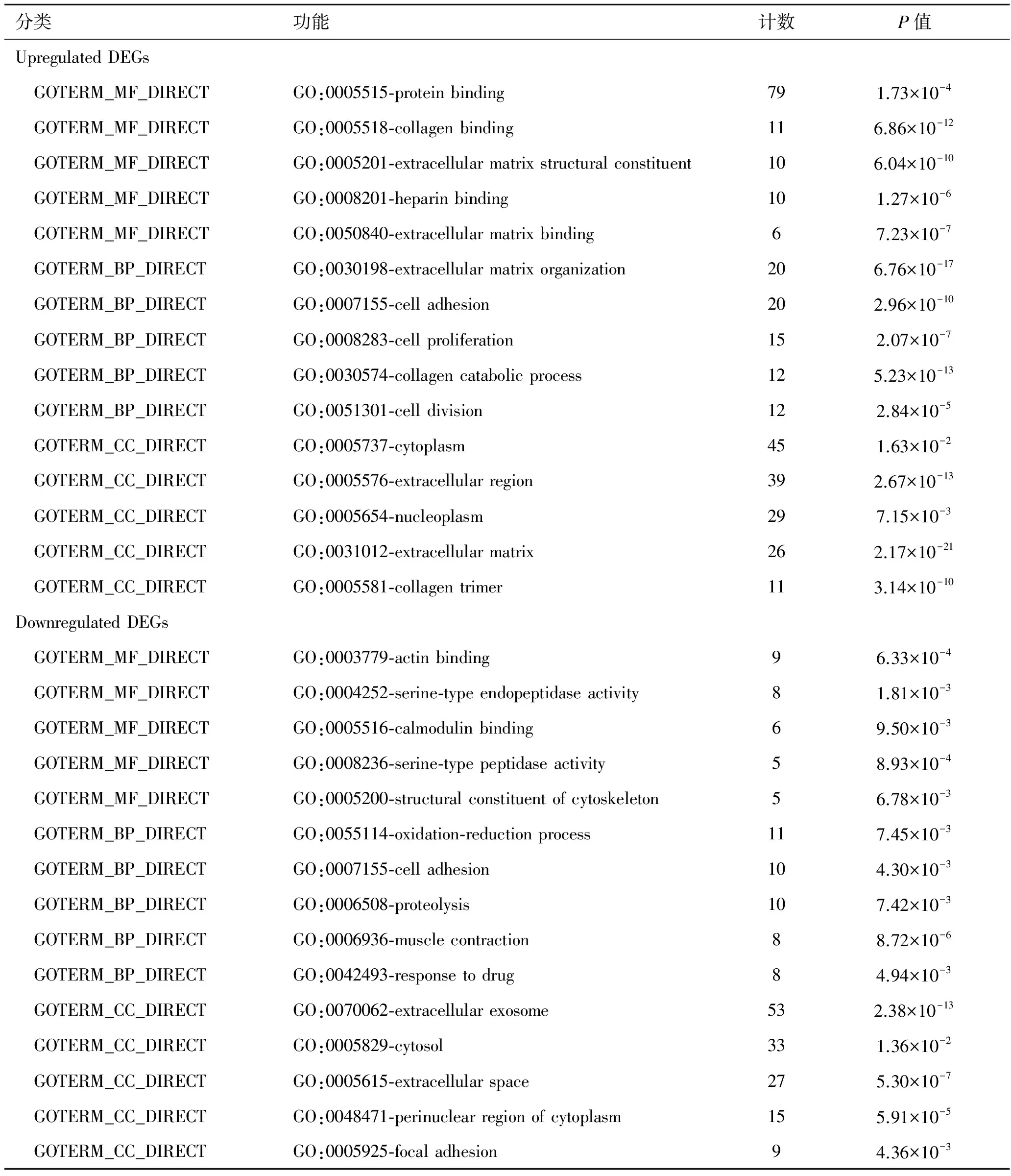
分类功能计数P值UpregulatedDEGs GOTERM_MF_DIRECTGO:0005515⁃proteinbinding791.73×10-4 GOTERM_MF_DIRECTGO:0005518⁃collagenbinding116.86×10-12 GOTERM_MF_DIRECTGO:0005201⁃extracellularmatrixstructuralconstituent106.04×10-10 GOTERM_MF_DIRECTGO:0008201⁃heparinbinding101.27×10-6 GOTERM_MF_DIRECTGO:0050840⁃extracellularmatrixbinding67.23×10-7 GOTERM_BP_DIRECTGO:0030198⁃extracellularmatrixorganization206.76×10-17 GOTERM_BP_DIRECTGO:0007155⁃celladhesion202.96×10-10 GOTERM_BP_DIRECTGO:0008283⁃cellproliferation152.07×10-7 GOTERM_BP_DIRECTGO:0030574⁃collagencatabolicprocess125.23×10-13 GOTERM_BP_DIRECTGO:0051301⁃celldivision122.84×10-5 GOTERM_CC_DIRECTGO:0005737⁃cytoplasm451.63×10-2 GOTERM_CC_DIRECTGO:0005576⁃extracellularregion392.67×10-13 GOTERM_CC_DIRECTGO:0005654⁃nucleoplasm297.15×10-3 GOTERM_CC_DIRECTGO:0031012⁃extracellularmatrix262.17×10-21 GOTERM_CC_DIRECTGO:0005581⁃collagentrimer113.14×10-10DownregulatedDEGs GOTERM_MF_DIRECTGO:0003779⁃actinbinding96.33×10-4 GOTERM_MF_DIRECTGO:0004252⁃serine⁃typeendopeptidaseactivity81.81×10-3 GOTERM_MF_DIRECTGO:0005516⁃calmodulinbinding69.50×10-3 GOTERM_MF_DIRECTGO:0008236⁃serine⁃typepeptidaseactivity58.93×10-4 GOTERM_MF_DIRECTGO:0005200⁃structuralconstituentofcytoskeleton56.78×10-3 GOTERM_BP_DIRECTGO:0055114⁃oxidation⁃reductionprocess117.45×10-3 GOTERM_BP_DIRECTGO:0007155⁃celladhesion104.30×10-3 GOTERM_BP_DIRECTGO:0006508⁃proteolysis107.42×10-3 GOTERM_BP_DIRECTGO:0006936⁃musclecontraction88.72×10-6 GOTERM_BP_DIRECTGO:0042493⁃responsetodrug84.94×10-3 GOTERM_CC_DIRECTGO:0070062⁃extracellularexosome532.38×10-13 GOTERM_CC_DIRECTGO:0005829⁃cytosol331.36×10-2 GOTERM_CC_DIRECTGO:0005615⁃extracellularspace275.30×10-7 GOTERM_CC_DIRECTGO:0048471⁃perinuclearregionofcytoplasm155.91×10-5 GOTERM_CC_DIRECTGO:0005925⁃focaladhesion94.36×10-3
2.4PPI网络分析基于STRING的数据分析,总共发现974组蛋白存在作用关系,而整个网络中以TOP2A、CDK1、BIRC5、BUB1、AURKA、FOXM1、DCN、EZH2、TYMS、ASPM蛋白与其他大于30个蛋白存在相互作用关系(degree>30),说明这些蛋白在前列腺癌内分泌治疗耐药过程中具有重要的生物学意义(图1)。
图1差异表达基因的蛋白-蛋白相互作用网络图
3 讨 论
目前,对于CRPC内分泌治疗耐药的确切发生和发展机制仍不十分清楚,因此,CRPC的治疗不仅是目前临床治疗的难点,也是基础与临床研究的热点。随着第二代基因测序技术的发展,为生物信息学的研究提供了丰富的资源,极大地推动了生物信息学的发展[9]。本研究结合基因芯片和生物信息学技术,共挖掘出270个显著差异基因。用STRING在线工具对CRPC相关差异基因编码的蛋白质间的相互作用进行了分析,结果发现这些基因编码的蛋白间的相互作用节点主要集中在TOP2A、CDK1、BIRC5、BUB1、AURKA、FOXM1、DCN、EZH2、TYMS、ASPM等基因。通过文献挖掘对这些基因进一步的研究,我们发现这其中有些基因与CRPC的关系已有文献报道,部分基因与CRPC的关系报道甚少。
TOP2A是一种编码DNA拓扑异构酶的基因,该基因中的几种突变体与肿瘤的耐药性有关,并已作为几种抗癌剂的作用靶点。MURPHY等[10]的研究表明,TOP2A的扩增与高级别前列腺癌的雄激素抵抗及存活率降低有关。LI等[11]通过抑制DU145细胞的TOP2A表达后,发现肿瘤细胞增殖和致瘤性显著降低。最近,LABBé 等[12]研究发现TOP2A和EZH2可作为转移潜能增加患者的分子标志物,其早期发现可使患者从辅助靶向治疗中获益。EZH2基因参与形成多聚体蛋白复合物,其涉及维持细胞世代连续基因的转录抑制状态。ARMSTRONG等[13]的最新研究数据表明,CCN3-EZH2-AR反馈环路可作为CRPC的潜在治疗靶点。同时,WU等[14]通过放化疗及小分子抑制剂对EZH2抑制,诱导了CRPC细胞的死亡。由此可见,TOP2A和EZH2可作为CRPC治疗靶基因,具有很高的研究价值。
CDK1是细胞周期的关键调节因子,与G1/S-期和G2/M期转移中的细胞周期蛋白A和细胞周期蛋白B形成复合物[15]。在CRPC激素剥夺治疗中CDK1活性增加可使AR表达升高[16]。SARWAR等[17]研究表明,AR-V7与CDK1和磷脂酰肌醇-4-磷酸5-激酶α相互作用以诱导转移生长和治疗抵抗。因此,CDK1抑制剂有希望成为新型CRPC治疗剂。而BUB1在CRPC中尚未得到很好的研究。BUB1是主轴组装检查点(SAC)的中心组成部分,在有丝分裂中起着重要作用,该基因的突变与非整倍体和多种癌症有关[18]。WANG等[19]通过体外实验表明,通过降低BUB1的表达,可以降低乳腺癌细胞的生长,抑制细胞的迁移和侵袭;检测BUB1的表达可能有助于乳腺癌预后的预测。本研究中BUB1表达上调,其与CRPC关系有待进一步实验研究。
FOXM1和AURKA参与细胞增殖的转录激活和细胞周期调节。最近PENG等[20]实验研究已证明FOXM1和AURKA通过长链非编码RNA HOXD-AS1的激活来促进前列腺癌的增殖、去势抗性和化疗抗性,这为CRPC提供了潜在治疗方法。以往对人肺、肝脏、结直肠和宫颈肿瘤细胞的研究中发现,DCN可与EGFR直接相互作用以调节肿瘤细胞生长[21-22]。HU等[23]的最新实验研究证实DCN可抑制EGFR和AR表达和磷酸化,并抑制雄激素非依赖性前列腺癌的生长。以DCN为靶点治疗CRPC将有广阔的临床研究前景。
本研究中TYMS、BIRC5、ASPM基因差异表达同样明显,但文献挖掘发现其与CRPC的关系报道甚少。TYMS编码胸苷酸合酶,是DNA复制和修复所必需的酶[24]。RAHMAN等[25]通过体外研究表明,TYMS的过度表达足以将哺乳动物细胞转化为恶性表型。对于前列腺癌,几个涉及52~172例患者的研究表明TYMS表达水平可能与不良的肿瘤表型相关[24]。BIRC5是一种抗细胞凋亡蛋白,引起了许多研究者的关注,在许多类型的癌细胞(包括胃癌、肺癌、结肠癌、乳腺癌等)中过度表达[26]。由于BIRC5在多种癌症中的高表达与生存期减少有关,将成为近年来癌症治疗的可能靶点之一。ASPM编码的蛋白质在有丝分裂纺锤体调节、调节神经发生和小头畸形中起关键作用[27-28]。XIE等[29]通过基因芯片分析数据表明,ASPM可能在前列腺癌的进展中起重要作用,ASPM的表达增加可能潜在地预测前列腺癌患者的无复发生存率降低。因此,通过文献挖掘我们发现,这些基因与多种癌症及癌细胞恶化程度增加有关。通过对这些基因进行进一步的研究,可能会发现CRPC新的治疗靶点。
在我们的生物信息学分析中,差异基因的GO功能分析及通路富集分析主要参与细胞分裂、蛋白质及胶原结合、胶原结合、氧化还原过程、药物反应、局灶粘连、细胞外基质结构组成及结合、肌动蛋白结合、ECM受体相互作用、PI3K-Akt信号通路、蛋白质消化吸收、丝氨酸型肽酶活性、钙调蛋白结合等分子生物功能及信号通路。PI3K-Akt信号通路是一种重要的致癌信号通路,与肿瘤的发生及对多种肿瘤类型的常规和靶向抗癌治疗的耐药性有关[30]。在前列腺癌中,PI3K-Akt信号通路的激活与前列腺癌的进展密切相关[31]。CARVER等[32]证实PI3K信号通路抑制了AR的转录活性。PI3K/Akt/mTOR通路抑制剂与其他治疗方法联合应用治疗CRPC已经在临床试验中[33]。我们相信,在对这些分子生物功能及信号通路的进一步研究中,对CRPC的治疗将会有更多新的发现。
利用生物信息学方法对CRPC与ADPC的DEGs进行系统的分析,可有效发掘这些差异基因的相互作用信息,为去势抵抗性前列腺癌的早期诊断及治疗靶点选择提供了新的线索和方向。