eEF2K对MDA-MB-231细胞增殖的影响与初步机制研究
肖 敏,王根柱,戚 欣,李 静
(中国海洋大学医药学院分子药理室,山东 青岛 266000)
真核延伸因子2激酶(eukaryotic elongation factor 2 kinase,eEF2K)又称钙调蛋白依赖性激酶Ⅲ(CaM kinase Ⅲ),是1985年由Nairn等[1]从哺乳动物中首次发现的,属于“α-激酶”家族。eEF2K共由724个氨基酸组成,分子质量约81 499 u。已有研究发现,当细胞面临一定的应激压力时,eEF2K能够磷酸化其细胞内唯一底物蛋白eEF2,抑制蛋白质合成过程中肽链延伸阶段,降低细胞中氨基酸和能量的消耗,使细胞能够在代谢压力下得以存活[2-3]。近年研究发现,eEF2K在一些肿瘤细胞中的表达和活性会影响肿瘤细胞的增殖、迁移、侵袭等生理进程[3-6],但在不同的肿瘤细胞中,eEF2K表现出不同作用。已有文献报道[3, 5-7],在人成骨肉瘤细胞、胶质瘤细胞、乳腺癌细胞中,抑制eEF2K能够提高肿瘤细胞对贫营养状态的敏感性,导致细胞死亡;而在结肠癌、宫颈癌以及肝癌细胞中,贫营养状态下抑制eEF2K则能够增强细胞对贫营养条件的耐受,从而存活下来。
MDA-MB-231细胞为三阴性乳腺癌细胞,具有强侵袭性和高转移性,临床预后不良。由于缺乏治疗靶点,临床对于三阴性乳腺癌的治疗仍是一大难题。为了进一步揭示eEF2K在三阴性乳腺癌细胞中的作用,本文观察了eEF2K在不同培养条件下,对肿瘤细胞MDA-MB-231生长的影响,并初步探讨作用机制,为阐明eEF2K在三阴性乳腺癌中的作用以及开发新的治疗靶点奠定基础。
1 材料与方法
1.1试剂与仪器L-15培养基(杭州吉诺);eEF2K shRNA(h) Lentiviral Particles和Control shRNA Lentiviral Particles (Santa Cruz);eEF2、eEF2K、Akt、ERK、Src、mTOR、JAK、PI3K及其磷酸化抗体(Cell Signaling Technology);β-actin 抗体、羊抗兔二抗、羊抗小鼠二抗(杭州华安);ECL化学发光液(Thermo Fisher);吉姆萨染液(北京雷根生物)。Epoch2 酶标仪、Protein Simple成像系统(Bio-tek公司);Life拍照显微镜(Life Technology公司)。
1.2稳定转染细胞株的构建MDA-MB-231细胞购自中科院上海细胞库。MDA-MB-231细胞于L-15(含15%胎牛血清和1%青链霉素)培养基中,置于37℃、无二氧化碳条件下培养。待细胞密度达到80%以上时,胰酶消化并接种于24孔板中。 48 h后,各孔分别加入不同浓度的嘌呤霉素(0、0.5、1、1.5、2、2.5、3、4、5 mg·L-1),筛选出能够杀死所有细胞的嘌呤霉素的最低浓度。同样条件接种细胞于24孔板,分别加入eEF2K shRNA (h) Lentiviral Particles和Control shRNA Lentiviral Particles,感染细胞24 h,加入嘌呤霉素筛选,获得稳定抑制eEF2K表达的MDA-MB-231细胞稳转株和空载体稳转株,分别记作MDA-MB-231 sheEF2K和MDA-MB-231 shNC细胞。
1.3SRB法测定细胞增殖曲线MDA-MB-231、MDA-MB-231 shNC和MDA-MB-231 sheEF2K 3种细胞于L-15(含15%血清和1%青链霉素)培养基中,置于37℃、无二氧化碳条件下培养。待细胞密度达到80%以上时,胰酶消化,并以3 000个/孔接种于96孔板中。贴壁后,更换完全培养基。以MDA-MB-231细胞倍增时间大约为23 h为参考,设置时间梯度,分别培养0、12、24、48、72、96 h后,采用SRB法,于515 nm处测定各孔吸光度值,并绘制细胞增殖曲线。同样方法测定3种细胞在无糖和无血清培养条件下的增殖曲线。
1.4平板克隆检测细胞克隆形成能力将MDA-MB-231、MDA-MB-231 shNC和 MDA-MB-231 sheEF2K 3种细胞于L-15 (含15%血清和1%青链霉素)培养基中,置于 37℃、无二氧化碳条件下培养。待细胞密度达到80%以上时,胰酶消化,并以500个/孔接种于6孔板中。37℃、无二氧化碳条件下培养15 d。弃去培养液,甲醇固定细胞3 min,晾干。吉姆萨染液染色15 min,流水洗去浮色,晾干,拍照。显微镜下计数超过50个细胞的克隆数。
1.5Westernblot检测相关信号分子表达将MDA-MB-231、MDA-MB-231 shNC和 MDA-MB-231 sheEF2K 3种细胞于L-15(含15%血清和1%青链霉素)培养基中,置于37℃、无二氧化碳条件下培养。待细胞密度达到80%以上时,胰酶消化并以2×105个/孔接种于6孔板中。待细胞密度生长至80% 左右时,弃去培养基,RIPA裂解液裂解40 min后收样,加上样buffer煮沸15 min,保存于-20℃。配制8%的SDS-PAGE凝胶,上样电泳分离后,转印至NC膜上。5%的脱脂牛奶封闭2 h,4℃孵育一抗过夜。TBST洗4次,室温孵育二抗1 h,ECL发光检测3种细胞中相关信号分子(Akt、ERK、Src、mTOR等)的表达和活化情况。每组实验重复3次。
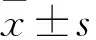
2 结果
2.1eEF2K抑制的稳定细胞株构建慢病毒颗粒感染细胞24 h后,加入嘌呤霉素筛选。取出部分细胞,Western blot检测eEF2K的抑制效率。结果表明,与对照组细胞MDA-MB-231 shNC相比,MDA-MB-231 sheEF2K细胞中eEF2K的表达明显下降,抑制效率可达71.76%(Fig 1A、1C)。并且eEF2K抑制后,细胞中eEF2K活性也降低,eEF2磷酸化明显减少(Fig 1B、1D)。此外,与野生细胞MDA-MB-231相比,MDA-MB-231 shNC细胞中eEF2K的表达无明显变化,表明空载体自身没有影响eEF2K的表达。上述结果表明成功构建了eEF2K低表达的稳转细胞株,可以用于后续实验。
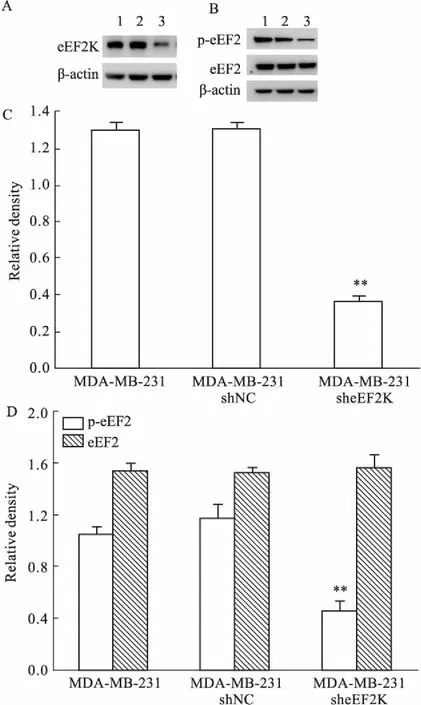
Fig 1 Different MDA-MB-231 cells constructed with
2.2抑制eEF2K后对不同培养条件下MDA-MB-231细胞增殖的影响将MDA-MB-231细胞及构建的两种稳定转染细胞株接种于96孔板,SRB法分别测定3种细胞在完全、无糖和无血清培养条件下的增殖曲线。结果发现,与完全培养条件下MDA-MB-231细胞相比,在无糖和无血清的培养条件下,MDA-MB-231细胞增殖速度明显降低。但在无糖和无血清的培养条件下,相对于MDA-MB-231 shNC细胞,eEF2K明显抑制的MDA-MB-231 sheEF2K细胞仍表现出较快增殖,在72 h增殖率为分别31.08%和25.63%(Fig 2A、2B)。Western blot检测MDA-MB-231细胞中 eEF2K的活性,发现在上述贫营养状态下,MDA-MB-231细胞中eEF2磷酸化水平明显升高,表明该条件下eEF2K被激活(Fig 2C、2D)。上述结果表明,贫营养条件下,eEF2K抑制能够促进乳腺癌细胞生长。
在完全培养条件下,与MDA-MB-231 shNC细胞相比,eEF2K明显抑制的MDA-MB-231 sheEF2K细胞增殖却被抑制(Fig 3A),并具有时间依赖性,96 h最高抑制率达33.02%。同样,平板克隆实验结果发现,抑制eEF2K表达的 MDA-MB-231 sheEF2K细胞株形成的克隆数明显少于其对照细胞,抑制率为22.48%(Fig 3B)。上述结果表明,在完全培养基培养条件下,eEF2K抑制降低了乳腺癌细胞的增殖能力。
2.3抑制eEF2K后对肿瘤细胞相关增殖信号通路活化的影响Western blot法检测MDA-MB-231细胞及构建的MDA-MB-231 shNC细胞、MDA-MB-231 sheEF2K细胞在完全培养条件下,增殖相关蛋白的表达与活化。灰度分析结果发现,MDA-MB-231 sheEF2K细胞中Akt和mTOR蛋白的磷酸化水平明显降低,其上游分子PI3K活性几乎不受影响(Fig 4A、4C)。而其他增殖相关蛋白如 Src、ERK、JAK磷酸化水平相比于自身蛋白表达均未见明显减少(Fig 4B、4D)。表明在MDA-MB-231细胞中,完全培养条件下,eEF2K减少引起的细胞增殖抑制可能与 Akt-mTOR信号通路活化降低有关。
3 讨论
据文献报道,贫营养状态下,eEF2K激活,导致其下游底物eEF2磷酸化,降低eEF2与核糖体结合的能力,抑制翻译延伸,减少氨基酸和能量的消耗,维持细胞生存[2-4, 8-9]。本实验发现,与完全培养条件相比,贫营养状态下的MDA-MB-231细胞增殖速度明显降低。Western blot结果也表明,贫营养条件下,eEF2K被激活,表明蛋白合成被抑制,细胞增殖速度维持在较低水平。该现象与文献报道一致。相同的道理,在贫营养情况下,eEF2K抑制的MDA-MB-231 sheEF2K细胞增殖速度明显高于对照组细胞MDA-MB-231 shNC,且在72 h时最为明显。表明eEF2K被抑制后,其蛋白合成抑制作用消失,细胞仍能继续增殖,即抑制eEF2K能够降低肿瘤细胞对贫营养状态的敏感性,该现象也与文献报道一致[5]。而在完全培养条件下,利用SRB方法观察细胞增殖情况时,我们发现,与对照组MDA-MB-231 shNC相比,MDA-MB-231 sheEF2K增殖速度明显被抑制。进一步应用平板克隆实验也发现,抑制eEF2K的表达也明显抑制了MDA-MB-231 shNC细胞的克隆形成。上述实验均没有观察到野生的MDA-MB-231细胞与MDA-MB-231 shNC细胞具有明显差别。这些研究表明,抑制eEF2K的表达,对不同细胞培养条件下细胞的生长具有不同的影响。
Fig 2 Effect of eEF2K inhibition on cell growth of different MDA-MB-231 cells in different media
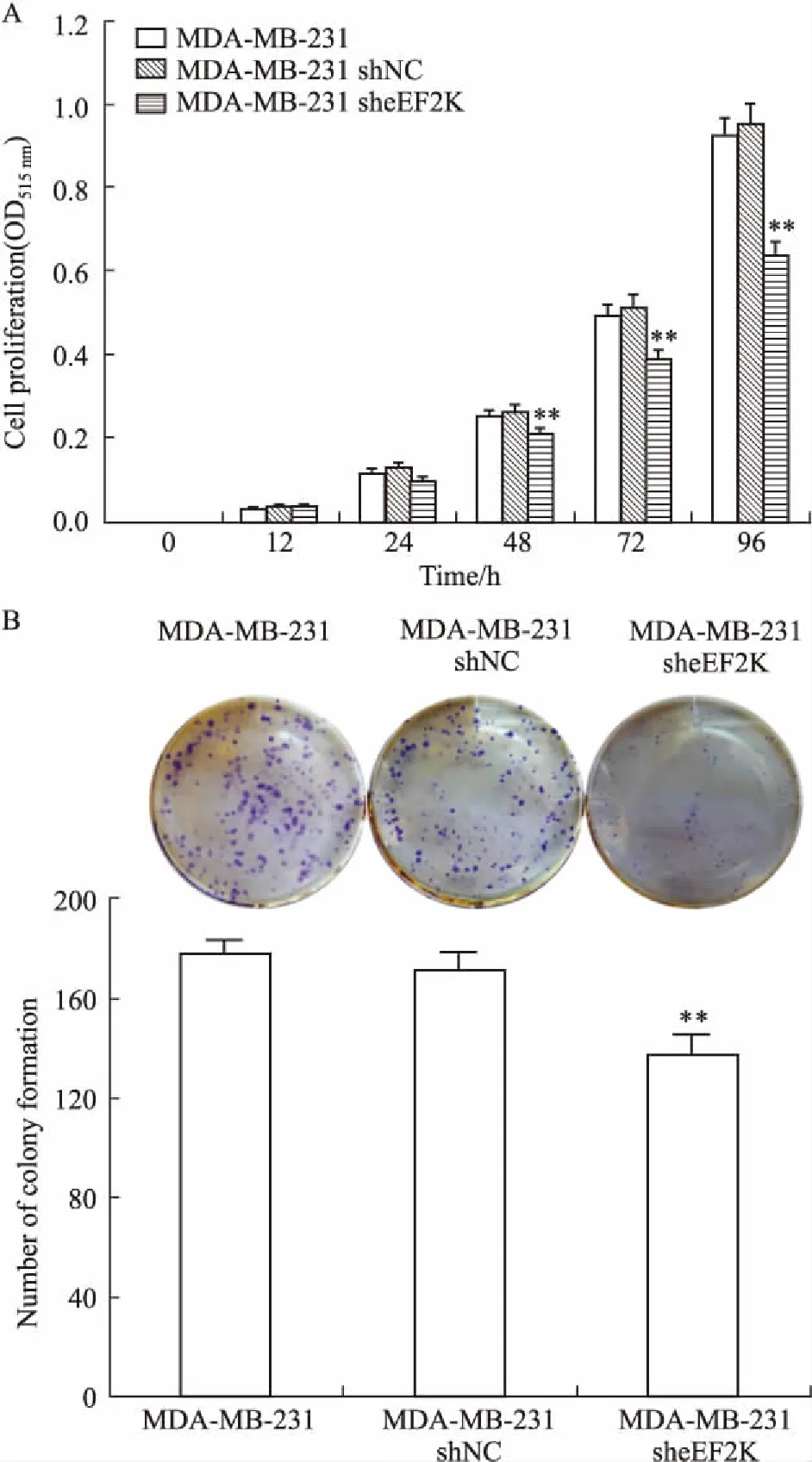
Fig 3 Effect of eEF2K inhibition on cell growthof different MDA-MB-231 cells
为此,我们进一步对完全培养条件下的3种细胞中增殖相关信号通路进行了检测。细胞中增殖相关信号通路主要有3条:RPTK-Ras-MAPK信号通路、JAK-STAT信号通路和PI3K-Akt-mTOR信号通路[10-13]。我们采用Western blot方法检测了上述信号通路中的相关分子,结果发现,与MDA-MB-231细胞和MDA-MB-231 shNC细胞相比,MDA-MB-231 sheEF2K细胞中Akt和mTOR的磷酸化水平明显降低,而上游分子PI3K活化无明显变化,其他分子如 Src、ERK、JAK磷酸化水平也均未明显变化,提示eEF2K抑制后,对MDA-MB-231的增殖抑制作用可能与Akt-mTOR信号通路活性下降有关,且与上游分子PI3K无关。
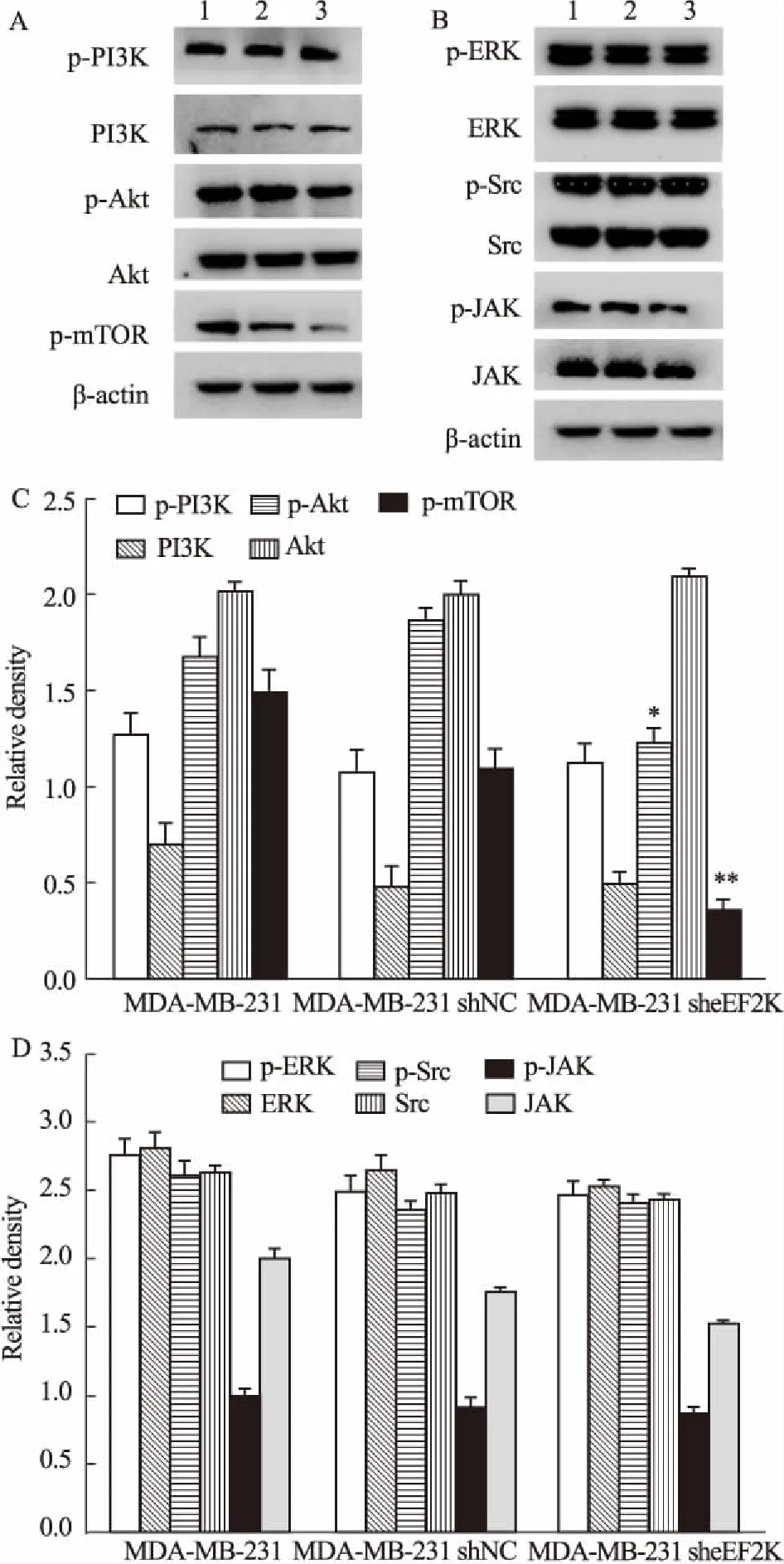
Fig 4 Effect of eEF2K inhibition on protein expression andactivation of different MDA-MB-231
eEF2K作为翻译延伸因子激酶可以磷酸化eEF2,抑制蛋白的翻译延伸。本研究发现,不同培养条件下,eEF2K对细胞生长影响明显不同。特别是发现完全培养条件下,eEF2K抑制后抑制了MDA-MB-231的增殖,并且与Akt-mTOR信号通路活化下降有关,提示eEF2K除了具有翻译延伸因子激酶的作用以外,可能还存在着其它的功能,可能是三阴性乳腺癌细胞治疗的新靶点,值得今后进一步研究。
(致谢:本实验是在中国海洋大学医药学院分子药理室完成的,感谢澳大利亚南澳洲健康医疗研究所Christopher G Proud 教授和王学敏老师提供的质粒。)