同时性多原发肺癌的临床诊治*
韩德前 黄媚娟 唐源 唐颖 李昱立
(四川大学华西临床医学院·华西医院 1.胸部肿瘤科,2.病理科,四川 成都 610041)
多原发肺癌 (multiple primary lung cancers,MPLC)的概念最早由Beyreuther提出,是指在同一患者肺内同时或先后出现两个或两个以上不同起源的原发恶性肿瘤,组织类型可以相同或不同。以诊断时间间隔6个月为界,分为同时性MPLC(synchronous MPLC,SMPLC) 和异时性MPLC(metachronous MPLC,MMPLC)。SMPLC以腺癌为常见主要病理类型[1],其诊断有时较困难,容易被误诊为肺内转移癌。现将我院胸部肿瘤科1例同时、异侧双原发肺癌的诊治经过报告如下。
1 病例资料
患者男性,59岁,工人,因“反复咳嗽、咳痰5月余,加重伴气紧15d”于2016年6月26日入院。既往有脑梗塞病史。吸烟40年,平均20支/d。查体:生命体征正常,ECOG评分1分,浅表淋巴结未触及肿大,左下肺叩诊浊音,呼吸音减弱。肿瘤标记物:癌胚抗原47.51 ng/ml,非小细胞肺癌抗原4.25 ng/ml,糖类抗原125 119U/ml。2016年6月28日胸部CT(图1A)示右肺尖及左肺上叶纵膈旁见多发结节影,右肺较大者约1.7cm×1.3cm,左肺下叶见软组织影,不除外肿瘤可能,左侧胸膜增厚,左侧胸腔中量积液;胸9至胸11椎体及部分附件骨质破坏,多系转移。腹部CT及头部MRI未见确切转移征象。纤支镜刷片查见非小细胞癌,病理报告高疑腺癌(图2);免疫组化(左肺下叶基底段):CK-7(+)、TTF-1(+)、ALK-V(-)ROS-1(-),支持腺癌(图3)。
2 诊治过程及结果
完善相关检查后临床诊断为左肺下叶腺癌伴左侧胸膜、双肺内、胸椎转移(IV 期),行左肺肿瘤组织EGFR基因检测示外显子19缺失突变。遂于2016年7月18日给予一线吉非替尼(250mg po qd)治疗,同时每月使用双膦酸盐1次预防骨相关事件。患者咳嗽、咳痰、气紧症状明显缓解,未遵医嘱规律随访。2016年10月18日行胸部CT(图1B)提示右肺尖肿块影较前长大(约2.7cm×1.9cm),左肺下叶肿块较前明显缩小(约1.7cm×1.0cm),左侧胸腔积液明显减少。根据实体肿瘤的疗效评价标准(RECIST 1.1)评估为稳定(左肺病灶明显缩小,右肺病灶稍增大),故继续一线吉非替尼治疗。2016年12月16日胸部CT(图1C)示右肺尖肿块影较前进一步增大(约3.3cm×2.9cm),呈分叶状,可见毛刺,邻近胸膜粘连,增强见中度强化。左肺下叶肿块明显缩小。双肺内散在小结节,部分转移灶可能。于我院肿瘤专科门诊随访,评估为左肺病灶对一线治疗敏感,而右肺病灶对吉非替尼耐药。2017年1月2日行右肺上叶包块经皮穿刺活检术,病理示低分化腺癌(图2),行二代基因测序(Next-generation sequencing,NGS)检测示EGFR(-)、ALK-V(-)、ROS-1(-)、MET拷贝数扩增(图4)。2017年1月18日起给予二线吉非替尼(250mg po qd)联合克唑替尼(250mg po Bid)治疗。2017年3月16日胸部CT(图1D)示右肺上叶病灶较前明显缩小,左肺病灶控制稳定,未见胸腔积液。期间出现III级胃肠道反应,II级肝功能异常,予以对症处理后有所恢复。患者自觉副反应明显,遂停用克唑替尼。2017年4月于门诊行右肺尖病灶放疗后失访。
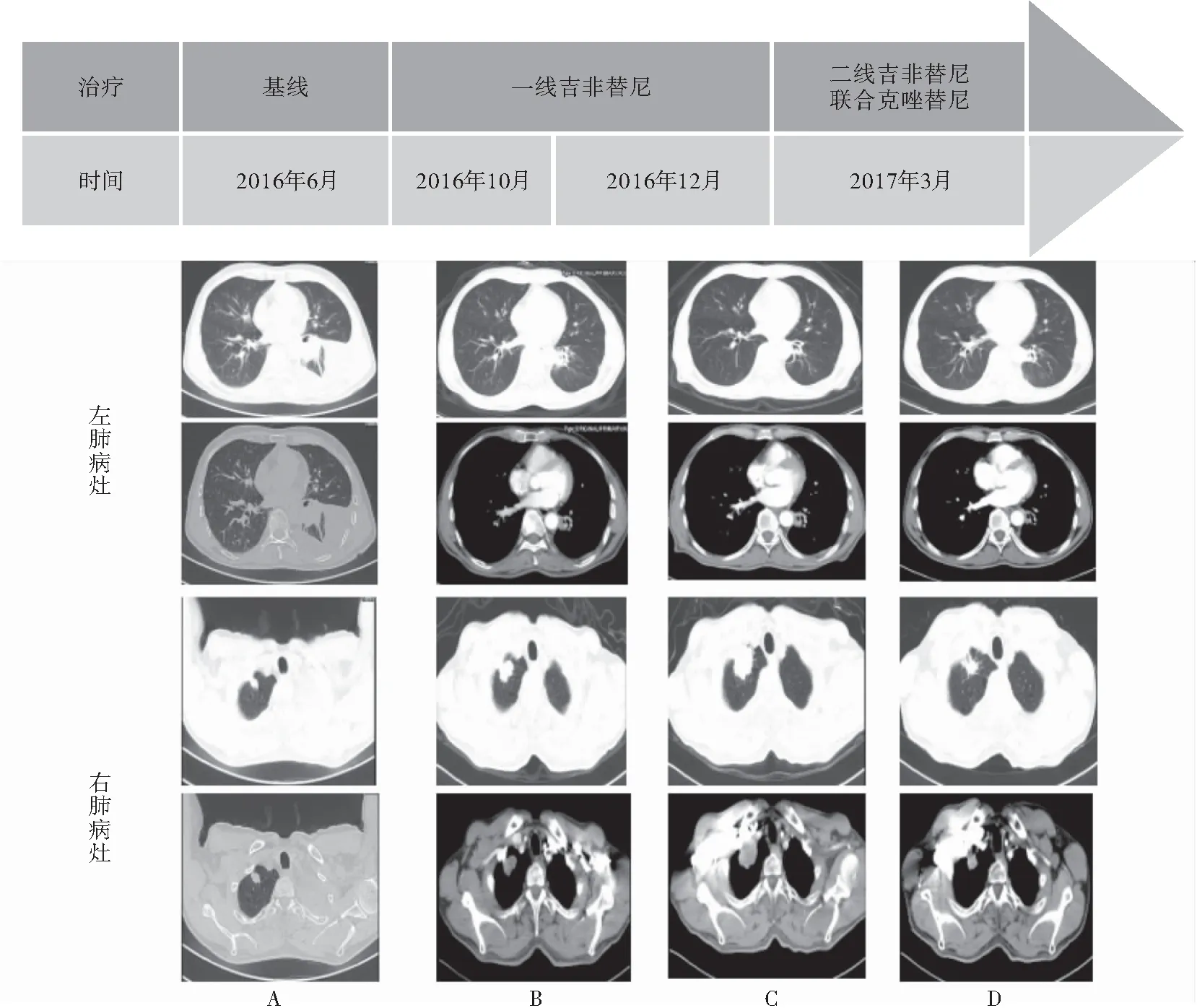
图1 不同抗肿瘤治疗方案在各时期的影像学评价Figure 1 Imaging evaluation of different antitumor regimens in different periods
注:左肺原发腺癌在一线吉非替尼治疗(2016年7月18日~2017年1月18日)后获得部分缓解,右肺原发腺癌对吉非替尼耐药而对克唑替尼治疗敏感(2017年1月18日~2017年3月6日)
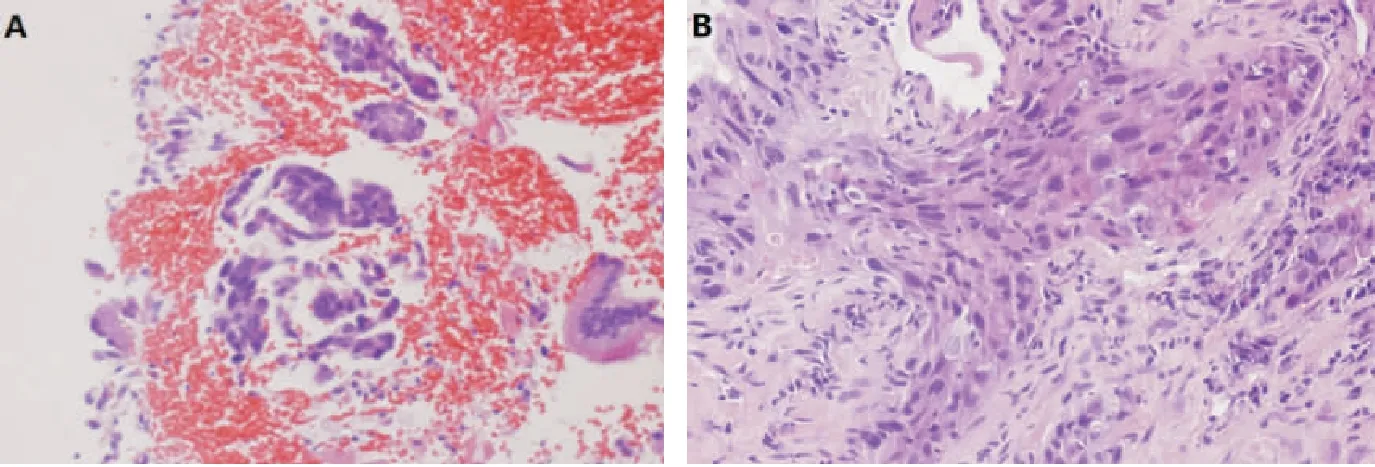
图2 左肺及右肺病灶病理切片Figure 2 Pathological diagnosis of adenocarcinoma注:A.左肺下叶软组织HE染色(×200);B.右肺尖结节HE染色(×200)
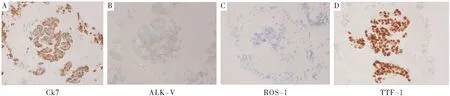
图3 左肺下叶软组织免疫组化染色(×200)
Figure3Immunohistochemicalanalysiswiththyroidtranscriptionfactor1(TTF-1),CK7,ROS-1andanaplasticlymphomakinase(ALK).TheresultsshowedpositivestainingwithTTF-1,CK7,andnegativeforROS-1andALK
注:免疫组化染色结果,A.CK7(+);B.ALK-V(-);C.ROS-1(-);D.TTF-1(+)
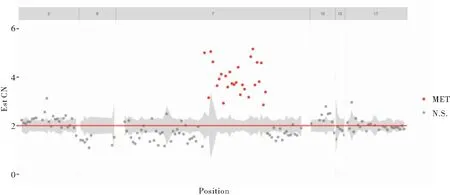
图4 MET拷贝数扩增分布Figure 4 MET copy number amplification注:右肺尖结节穿刺二代测序(NGS),结果提示MET拷贝数扩增
3 讨论
近年来,MPLC的检出率呈逐渐升高趋势。国外文献报道为1.1%~3.1%[2-4],国内多以个案报道为主,其发病率为0.67%[5],低于国外文献报道[6]。这可能与对本病认识不足或将原发癌误认为转移、复发病灶,从而放弃了活检、手术等确诊手段,使得多原发肺癌患者被漏诊有关[7]。
多原发肺癌的病因尚无明确定论,综合文献报道,可能与多种因素相关。①区域性癌化假说。在口腔多原发鳞癌的研究中,Slaughter[8]首次提出“区域性癌化”的概念,认为在相同致癌因子条件下口腔内多发癌前病灶彼此独立发展为多原发病灶。Strong[9]将“区域性癌化”学说扩展至整个呼吸系统,认为致癌原介导的DNA改变存在于整个呼吸道黏膜,支气管肺泡上皮可能广泛异性增生,其中某些高级别的异性增生细胞首先癌变,随着时间的推移,还可能有其它异性细胞相继癌变,形成多原发肺癌。②医源性因素及人口老龄化。随着医疗卫生条件的改善及先进诊治技术的应用,使肺癌在早期得以诊断和治疗,随着肺癌综合治疗手段的进展,疗效得到提高,人的平均寿命得以延长,与此同时也为第2原发肺癌的发生发展提供了时间。③环境因素。有报道称烟雾中的有害物质可使P53基因突变,与多原发肺癌的发生密切相关[10],尤其以鳞癌和小细胞癌最为显著。④遗传因素。Li[11]发现MPLC具有家族遗传倾向可能,有肺癌家族史的患者出现第2原发肺癌的机率较无家族史的患者提高了9倍。
目前诊断组织学类型不同的MPLC相对容易,但诊断组织学类型相同的MPLC仍较困难。临床实践中,我们首先借助胸部高分辨CT(HRCT)进行鉴别。MPLC多为孤立的、边缘不光整、密度欠均匀的类圆形结节影,可伴毛刺及分叶征。转移癌则表现为边缘光滑、密度较均匀的球形阴影,少见毛刺及分叶征。1975年,Martini等[12]首先提出了MPLC的临床诊断标准(M-M标准)。SMPLC的诊断标准:病灶位于不同部位彼此独立;组织学类型不同;组织学类型相同时,位于不同肺段、肺叶或不同侧肺,且为不同原位癌,共同淋巴结引流部位无癌,确立诊断时无肺外转移。MMPLC的诊断标准:组织学类型不同;组织学类型相同时,需满足以下任意一条:①无瘤间期不低于2年,源于不同原位,再发病灶位于不同肺叶或对侧肺。②共同淋巴结引流部位无癌。③确立诊断时无肺外转移。M-M诊断标准虽得到大多数学者认可,但因肺癌组织学成分复杂,在病变发展和治疗过程中有不断转变的可能,所以该标准也不断得到国内外学者的补充和改进。
1995年,Antakli等[13]对M-M标准进行了修订,提出DNA倍体分析有助于鉴别MPLC与肺内转移,但未提出相关技术手段进行基因分析。
2003年,美国胸科医师协会(American College of Chest Physicians, ACCP)在其肺癌指南中提出新的MPLC诊断标准[14],并在2007年[15]和2013[16]年进行补充 。SMPLC的诊断标准:①组织学类型不同。②分子遗传学特征不同。③起源于不同原位癌。④组织学类型相同时,肿瘤位于不同的肺叶且无N2、N3转移及无全身转移。MMPLC的诊断标准:①组织学类型不同。②分子遗传学特征不同。③起源于不同原位癌。④组织学类型相同时,无瘤间期不低于4年且无全身转移(但2个病灶间隔时间2~4年时,不能确定是MMPLC还是转移)。ACCP补充后的标准增加了分子遗传学特征,同时兼顾了MPLC与转移灶的鉴别。
既往诊断标准及检查技术无法满足MPLC的个体化诊断及治疗需求。然而明确诊断很大程度上决定治疗方案并影响预后。近年来,P53基因、表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR)基因和Kras基因突变检测以及微卫星多态性分析应用于多原发肺癌的基因比较分析,评估各病灶的克隆关系,鉴别MPLC与转移[17]。
Girard等[18]研究7例双发肺腺癌病灶患者的EGFR/Kras基因突变。分别参照M-M标准[12]及ACCP标准[13],并通过临床病理分析诊断组织学类型相同的MPLC,结果显示上述两种参照标准得出的结果不一致,而基因突变检测提示所有患者配对的EGFR/Kras基因突变均不同,即为双原发性肿瘤,且与肺腺癌组织学亚型的结论一致。该研究提示EGFR/Kras基因突变分析可鉴别MPLC和转移。
有研究表明,基于识别基因组上拷贝数变化的比较基因组杂交技术 (comparative genomic hybridization,CGH)在区分同源肿瘤上有着较高的可信度[19-20]。在同时性和异时性多原发肺癌中也出现了同样的结果[21]。
驱动基因的研究将非小细胞肺癌的临床诊断和治疗推进到精准化、个体化时代,靶向治疗显著改善了部分患者的生活治疗,延长了生存时间。目前有多种RAS基因检测技术用于临床,但这些技术的检测灵敏度、特异性、样本的需要量、检测时间及成本均存在差异[22]。二代基因测序(next-generation sequencing,NGS)技术的基本原理是合成与测序同时进行,当DNA聚合酶合成互补链时,根据捕捉的荧光信号(光或pH值的改变)经过计算机软件处理,从而获得待测基因的序列信息,其不但能够同时高通量检测(约25~20 000个)基因序列信息,而且能够检测出FISH或PCR技术不能发现的基因改变[23-24]。
MPLC在治疗上尚无统一金标准,目前国内外普遍共识认为应首选手术切除,即综合评估若无手术禁忌,则尽可能选择手术治疗。对于手术的方式及范围无统一标准,应遵循在最大限度切除肿瘤的基础上最大限度保存肺功能和降低手术风险,术后采取多学科综合治疗。对于分期较晚或难以手术的患者可选择放疗、化疗、立体定向放疗(stereotactic body radiation therapy,SBRT)、射频消融(radiofrequency ablation,RFA)、分子靶向治疗等。Johnson等[25]报道,SMPLC患者术后的5年生存率为20%。郎杉等[26]对25例MPLC手术患者进行回顾性分析显示,术后3年生存率为91.8%,5年生存率为48.8%,总体中位生存时间为58个月。
SBRT具有肿瘤靶区精确度高、放疗毒副反应发生率低的特点。Creach等[27]对66例接受SBRT治疗的MPLC患者的预后进行了观察,发现中位总生存期为20个月,中位无复发生存期为15.5个月,仅6例原位复发,无3级以上毒副反应发生。提示SBRT可改善MPLC预后,毒副反应可耐受,对于有手术指征但无法接受手术的MPLC是一种安全有效地治疗手段。
本例为EGFR突变阳性双原发同类型晚期肺癌,合并异侧病灶MET拷贝数扩增。治疗上选择以全身治疗为主的综合治疗方案。IPASS[28]研究证实,晚期EGFR突变阳性非小细胞肺癌吉非替尼一线治疗疗效显著优于常规化疗,毒副作用可耐受。根据目前NCCN(National Comprehensive Cancer Network)肿瘤学临床实践指南推荐,故一线方案选择口服吉非替尼。在一线治疗时双肺病灶表现出不同生物学特性,行右肺病灶NGS检测发现右肺病灶MET拷贝数扩增。MET不仅是EGFR-TKI耐药后的新靶点,亦是原发致癌驱动基因,其激活包括突变、扩增和蛋白质过表达,属潜在的治疗靶点。有研究显示,13例不同程度MET拷贝数扩增的患者接受克唑替尼治疗,结果4例评价PR(33%),中位缓解持续时间为35周,不良反应可耐受[29]。本例经证实右肺病灶与左肺病灶非同一克隆源性,加用克唑替尼后治疗效果较好。
4 结论
MPLC发病率呈上升趋势,因此提高对MPLC的认识有重要的临床意义。目前MPLC的诊断主要参考M-M标准及ACCP标准,同时强调应综合考虑临床表现、影像特征、病理类型和分子遗传学特征。以手术为首选的综合治疗模式被普遍公认。NGS技术作为新兴的基因检测方法,具有准确、高效等特点,它的运用将MPLC的诊断及鉴别诊断提升到了新的水平,有望成为指导肿瘤个体化精准治疗的重要辅助工具。

