猪流行性腹泻病毒实时荧光定量RT-PCR检测方法的建立及初步应用
杨 峰,杨猛超,周宏超,许信刚,张为民*,张 琪*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.陕西供销福地牧业有限责任公司,陕西周至 710400)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属于冠状病毒科冠状病毒1型,感染猪会导致猪流行性腹泻(Porcine epidemic diarrhea,PED),临床上以呕吐、泄泻和脱水为特征。各个年龄阶段的猪均可感染PEDV,而仔猪与其他年龄段猪相比更易感,感染后的发病率可达到100%,哺乳仔猪的病死率甚至超过80%[1]。自20世纪80年代后期该病开始在我国猪群中大面积流行,保守估计已有100多万头的仔猪死亡,给我国养猪业造成了极为严重的损失[2]。
实验室检测通常采用逆转录PCR(reverse transcription PCR,RT-PCR)方法检测PEDV,但常规RT-PCR方法在灵敏度和重复性以及病毒含量确定等方面还存在一些不足[3-4]。实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)具有操作简单、灵敏度高、重复性好、耗时短、结果量化等优点,逐渐在实验室的检测中得到广泛的应用[5-10]。RT-qPCR有荧光染料法和TaqMan探针法两种,由于TaqMan探针法相对荧光染料法比较昂贵,因此使用最多的是荧光染料法,其中SYBR染料使用的最普遍,但该荧光是一种不饱和荧光,在浓度高的时候会对PCR的扩增过程产生一定的抑制,所以在使用时加入的含量相对较小,这样又会致使DNA的双链位点不能被荧光染料充分的全部结合。但是Eva Green与此不同,它是饱和荧光染料,没有非饱和染料“染料重排”的缺点,制作的熔解曲线分辨率相对较高,而且可以在扩增过程当中及时的从DNA双链中释放出来,从而降低了对PCR扩增过程的影响,因此,使用Eva Green染料定量,比使用SYBR染料准确性高[11-12]。本研究通过对NCBI中登录的PEDV N基因进行分析比较,设计1对特异性的引物,建立基于Eva Green的RT-qPCR 方法,以期为PEDV在临床检测中提供一种快速、特异、灵敏、定量的方法。
1 材料与方法
1.1 材料
1.1.1毒株、菌株及病料猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒( Transmissible gastroenteritis virus,TGEV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV),西北农林科技大学动物医学院微生物实验室分离保存并提供;大肠埃希菌DH5α感受态细胞,购自康维世纪生物科技公司;病料为陕西省不同地区规模化养猪场临床剖检疑似PEDV感染的病死仔猪小肠内容物,加适量PBS并冻融3次后置-80℃保存,共43份。
1.1.2主要试剂 DNA标准 DL 2 000和2×TaqMaster Mix,康维世纪生物科技公司产品;Trizol试剂、RNA逆转录试剂盒,天根生化科技公司产品;凝胶回收试剂盒、pEAST-T1克隆试剂盒、质粒提取试剂盒,全式金生物公司产品;2×Eva Green Premix,ABM 生物科技公司产品。
1.1.3引物设计及合成 参考NCBI中登录的PEDV N基因序列(KM609210. 1、KT021227.1、KM242131.1、JX261936.1、AF353511.1等),使用DNA Star软件进行比对分析保守序列,用Primer 5软件设计引物。所设计的荧光定量特异性上、下游引物序列分别为PEDV-F:5′ -TGAGGGTGTT-TTCTGGGTTG-3′ ,PEDV-R:5′ -TTGCCATTGCCACGACTC-3′ ,预期扩增片段长度为192 bp。引物由西安擎科泽西生物公司合成,稀释至10 μmol/L,置4℃保存备用。常规RT-PCR引物由西北农林科技大学动物医学院微生物实验室提供,扩增片段长度为1 326 bp[13]。
1.2 方法
1.2.1PEDV RNA的提取及逆转录 取PEDV细胞培养液200 μL,使用Trizol法提取RNA,根据逆转录试剂盒说明书进行逆转录,得到的cDNA,置-20℃存储或进行常规RT-PCR试验。
1.2.2常规RT-PCR扩增 反应体系20 μL:2×TaqMaster Mix 10 μL,ddH2O 6 μL,上游引物和下游引物各0.5 μL,模板cDNA 3 μL。反应条件:95℃预变性5 min;95℃ 30 s,56℃ 30 s, 72℃ 1 min,循环30次;72℃再延伸10 min。
1.2.3RT-qPCR阳性质粒及标准模板制备 按照胶回收试剂盒回收1.2.2扩增的目的片段,并将其按照pEAST-T1克隆试剂盒构建重组质粒菌。重组质粒菌经常规PCR鉴定为阳性后,将重组质粒菌中的阳性质粒按照试剂盒的操作步骤提取,进行测序分析。用超微量光谱分析仪测定阳性质粒浓度,按照以下公式将浓度转化为拷贝数,然后进行梯度稀释。稀释后的质粒作为标准模板,置-20℃保存备用。拷贝数(copies/μL) =C×NA/MW,其中C为阳性质粒测定的浓度,单位ng/μL,NA取值为6.02×1023copies/mol,MW为平均分子量,单位为Dolton。
1.2.4RT-qPCR扩增 反应体系10 μL:2×Eva Green Premix 5 μL,ddH2O 3.4 μL,标准模板1 μL,上游引物和下游引物各 0.3 μL。反应条件:95℃预变性10 min;95℃ 3 s,60℃ 30 s,循环35次。
1.2.5RT-qPCR反应标准曲线建立 选取浓度分别为1×108拷贝/μL~1×103拷贝/μL的标准模板为阳性模板,以双蒸水为阴性对照模板,进行RT-qPCR扩增。结果以RT-qPCR仪自带软件分析绘制扩增曲线、标准曲线和熔解曲线。
1.2.6RT-qPCR特异性试验 用建立的RT-qPCR方法分别检测PEDV、TGEV、PRRSV、CSFV提取后逆转录得到的cDNA,验证建立的RT-qPCR方法的特异性。
1.2.7RT-qPCR灵敏性试验 选取浓度为1×104拷贝/μL~1×100拷贝/μL的标准模板为阳性模板,以双蒸水为阴性对照模板,分别进行RT-qPCR方法和常规PCR方法扩增,将所得结果进行对比,比较所建立的RT-qPCR方法和常规PCR方法的灵敏程度。
1.2.8RT-qPCR重复性试验 对同一批次不同浓度的标准模板和不同批次不同浓度的标准模板为阳性模板,以双蒸水为阴性对照模板,进行RT-qPCR扩增,分别计算组内和组间变异系数。
1.2.9临床样本的检测 将不同猪场送检的疑似PEDV感染的小肠内容物样品做待测样品,以标准模板做阳性对照模板,以ddH2O为阴性对照模板,用所建立的RT-qPCR方法检测,然后将RT-qPCR方法检测为阳性的样品进行常规PCR方法检测,统计结果进行比较。
2 结果
2.1 常规RT-PCR扩增
对PEDV进行常规RT-PCR扩增,结果与预期大小一致,目的片段为1 326 bp,而且无杂带(图 1),说明提取并逆转录得到的为PEDV的cDNA,可以进行后续试验。
2.2 阳性质粒常规PCR鉴定
将菌液用PEDV荧光定量特异性引物进行常规PCR检测,结果扩增到192 bp目的片段(图2),结果说明重组质粒构建成功,且设计的引物可作为PEDV的特异性引物。将鉴定为阳性的质粒进行测序,测序结果在NCBI网站上进行BLAST,结果同源性达99%。

M.DNA 标准DL 2 000;1.PEDV常规RT-PCR产物;2.阴性对照
M.DNA Marker DL 2 000;1.RT-PCR products of PEDV;2.Negative control
图1常规RT-PCR扩增结果
Fig.1Amplification result of PEDV by RT-PCR
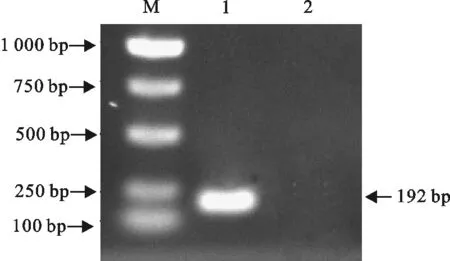
M.DNA 标准DL 1 000;1.阳性质粒常规PCR产物;2.阴性对照
M.DNA Marker DL 1 000;1.PCR products of positive plasmids;2.Negative control
图2阳性质粒常规PCR鉴定
Fig.2The conventional PCR identification of positive plasmids
2.3 RT-qPCR标准模板的制备
用超微量光谱分析仪测定提取质粒的浓度45.09 ng/μL,A260/A280值为1.796,计算得拷贝数为7.83×109拷贝/μL,将其稀释至浓度分别为1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100拷贝/μL,-20℃保存备用。
2.4 RT-qPCR反应标准曲线建立
RT-qPCR标准模板的扩增曲线如图3所示,相应的标准曲线如图4所示,其熔解曲线如图5所示。在1×103拷贝/μL ~1×108拷贝/μL浓度范围内,所得拷贝数(x)与Ct值(y)的线性方程为y=-3.359x+40.388,斜率为-3.359,截距为40.388,线性相关系数 R2=0.999,显示了良好的线性关系。熔解曲线峰型单一,无杂峰,熔解温度一致, Tm=82.22℃。
2.5 RT-qPCR特异性试验
分别以PEDV、TGEV、PRRSV和CSFV提取后逆转录得到的的cDNA为反应模板,用建立的RT-qPCR方法扩增,结果表明只有PEDV有荧光信号(图6),说明所建立的RT-qPCR方法特异性好。
2.6 RT-qPCR敏感性试验
以1×104、1×103、1×102、1×101、1×100拷贝/μL的标准模板为反应模板,进行RT-qPCR方法扩增,结果显示RT-qPCR方法检测的最低拷贝数为1×101拷贝/μL(图7)。以 1×104、1×103、1×102、1×101、1×100拷贝/μL的标准模板为反应模板,以常规PCR方法扩增,结果显示,常规PCR 方法检测的最低拷贝数为1×103拷贝/μL(图8)。结果表明,所建立 RT-qPCR方法比常规RT-PCR方法灵敏100倍。

1~6.1×108拷贝/μL~1×103拷贝/μL 6个不同浓度标准模板的RT-qPCR扩增曲线; NC.阴性对照
1-6.RT-qPCR curves of 1×108copies/μL to 1×103copies/μL diluted standard template,respectively;NC.Negative control
图3实时荧光定量PCR扩增曲线
Fig.3RT-qPCR amplification curve
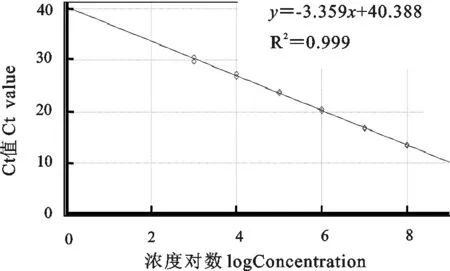
图4 实时荧光定量PCR标准曲线
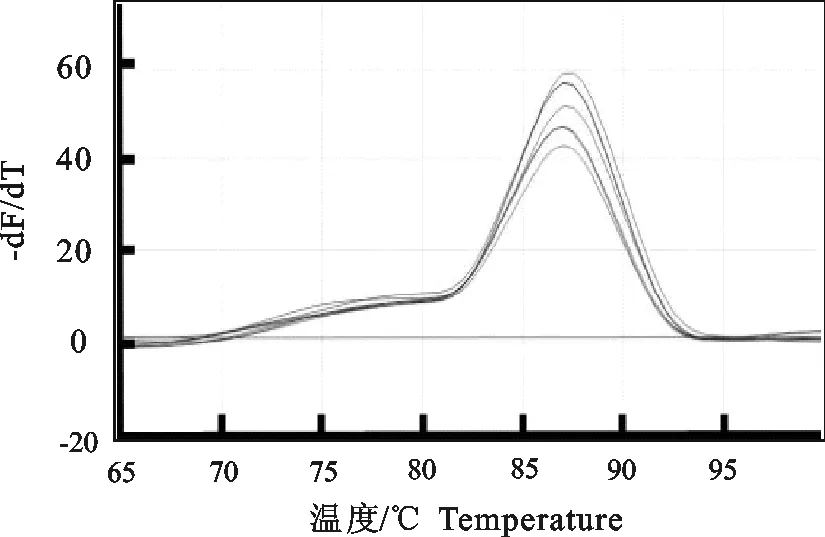
图5 实时荧光定量PCR熔解曲线

图6 RT-qPCR特异性试验
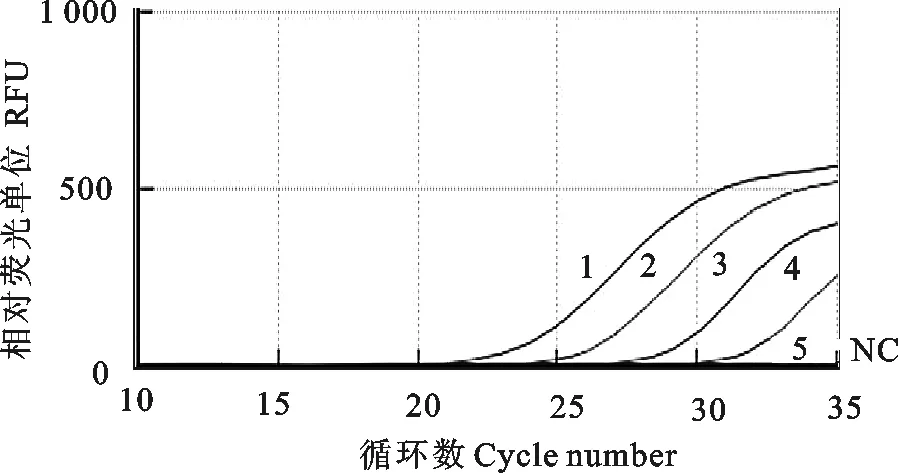
1~5.1×104拷贝/μL~1×100拷贝/μL 5个不同浓度标准模板的RT-qPCR扩增曲线;NC.阴性对照
1-5.RT-qPCR amplification curves of 1×104copies/μL to 1×100copies/μL diluted standard template,respectively;NC.Negative control
图7RT-qPCR灵敏性试验
Fig.7RT-qPCR sensitivity test
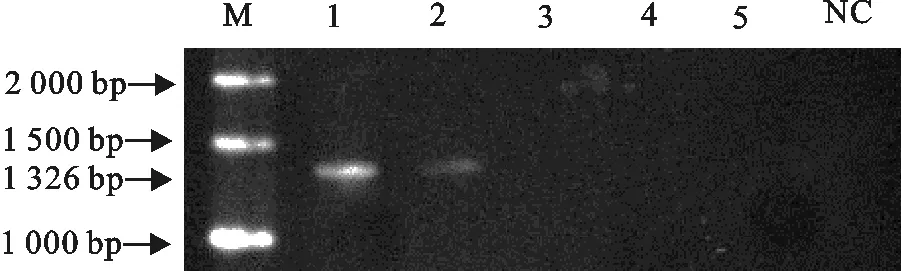
M.DNA 标准DL 2 000;1~5.1×104拷贝/μL~1×100拷贝/μL 5个不同浓度标准模板的常规PCR扩增产物;NC.阴性对照
M.DNA Marker DL 2 000;1-5.The conventional PCR products of 1×104copies/μL to 1×100copies/μL diluted standard template;NC.Negative control
图8常规PCR灵敏性试验
Fig.8 The conventional PCR sensitivity test
2.7 RT-qPCR重复性试验
以1×108、1×107、1×106拷贝/μL的标准模板为反应模板,每个模板做3个重复,进行组内重复试验(表1),每隔1周做1次,每次做3个重复,计算平均值,做3次,进行组间重复试验。结果表明,变异系数均在5%以下(表2),说明所建立的RT-qPCR方法在重复性较好。
2.8 检测方法的应用
对疑似的43份临床样品,用常规RT-PCR方法和建立的RT-qPCR方法进行检测。结果建立的RT-qPCR方法检测为42份阳性,1份阴性,用常规RT-PCR方法检测为40份阳性,3份阴性。说明本研究建立的RT-qPCR方法比常规 RT-PCR灵敏性高,可以在PEDV的临床检测中应用。

表1 RT-qPCR组内重复试验
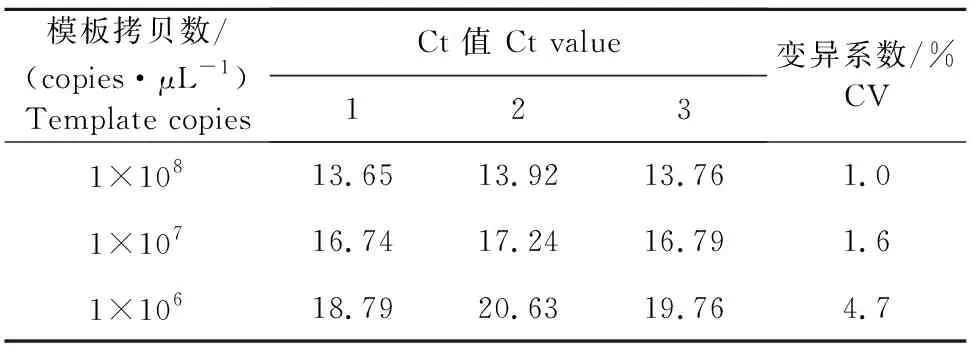
表2 RT-qPCR组间重复试验
3 讨论
由于PED对养猪业造成的损失很大,而且与其他传染病,尤其是TGE的临床症状和病理变化非常相似,在临床鉴别时比较困难,只能结合实验室检测才能确诊。在目前的检测方法(如常规RT-PCR、LAMP、ELISA和免疫荧光等技术)中,用荧光标记方法检测特异性产物的RT-qPCR技术,因其灵敏度高、重复性好、定量准确、耗时短、过程封闭等众多优点,逐渐在病原体检测、目的基因表达量、疫苗质量控制等方面得到广泛的使用[14]。因为荧光染料几乎可以和任何DNA双链结合,所以要求RT-qPCR荧光染料法的引物在设计时要认真考虑长度、退火温度、保守性、二聚体、发夹结构等问题,尤其是其中的引物二聚体和发夹结构问题,其关系到定量的准确性[15]。在试验过程中,还要注意做好防污染工作,尽管试验操作比较简单,但操作中的污染,如气溶胶的污染会出现假阳性的结果;在制作标准模板时,要使阳性质粒完全混合均匀,以此保证标准模板的浓度梯度正确性。这些问题考虑的越周全,得到的结果越稳定和可靠。
本研究根据NCBI上登录的PEDV N基因,设计了1对用于RT-qPCR扩增目的片段为192 bp的特异性引物,构建阳性质粒标准模板,使用Eva Green作为荧光标记染料,进行RT-qPCR扩增。结果表明,建立的PEDV RT-qPCR检测方法的标准曲线线性关系良好,各梯度标准模板扩增效率一致,熔解曲线峰型单一。本研究建立的PEDV RT-qPCR检测方法特异性强,只能检测出PEDV,最低检测拷贝数为1×101拷贝/μL,比常规 RT-PCR相比灵敏100倍。组内和组间重复性试验的变异系数均小于5%,重复性良好。用建立的RT-qPCR方法检测43份疑似PEDV感染样品,结果42份为阳性,而常规RT-PCR只能检测出40份阳性病料,漏检2份阳性病料。整个RT-qPCR扩增过程只需45 min,耗时短。在临床上应用本方法,可以特异、快速、定量的检测出PEDV,从而使养殖者迅速制定PEDV的防控措施,以减少经济损失。综上所述,本研究建立的猪流行性腹泻病毒实时定量PCR检测方法具有较好的特异性、敏感性和重复性,而且耗时短,可用于临床检测猪流行性腹泻病毒感染。

