实验性自身免疫性脑脊髓炎模型小鼠脾和中枢神经系统中CD4+ T细胞的动态变化
罗 会,郭晴晴,吕爱平,何小鹃*,马超英
(1.西南交通大学生命科学与工程学院,四川成都 610031;2.中国中医科学院中医临床基础医学研究所,北京 100700;3.香港浸会大学中医药学院,香港 999077)
多发性硬化(Multiple sclerosis,MS)是一类发生在人中枢神经系统(central nervous system,CNS)的自身免疫引起的神经退行性疾病[1]。目前MS仍无有效的治愈方法,只能利用药物减缓其进展,控制病症[2]。MS的发病机制尚未明确,近年来大多数的研究倾向于认为MS是由T淋巴细胞介导的自身免疫性疾病。当抗原递呈细胞在病毒感染或其他刺激因子的作用下活化的同时,共刺激分子与T细胞结合提供共刺激信号,特异性激活针对髓鞘抗原的自身反应性CD4+T细胞,后者增殖并分化穿过血脑屏障进入CNS与自身抗原结合,发生免疫反应,破坏血脑屏障,从而使大量免疫细胞进入CNS,并分泌多种淋巴因子破坏神经元、少突胶质细胞,从而导致以髓鞘脱失和轴索变性为特征的神经系统损伤[3-4]。
实验性自身免疫性脑脊髓炎模型(experimentally allergic encephalomyelitis,EAE))是人类模拟MS的经典实验动物模型,在临床表征和病理特征上与MS相似[5]。对MS和EAE动物模型发病机理的研究,均证明CD4+T细胞是对自身抗原免疫应答的主要细胞,在整个EAE的发生和发展过程中都发挥重要作用,也在多个部位,包括外周脾和CNS病灶部位都发挥致病效应[6]。因此,研究不同时期不同部位EAE模型的CD4+T细胞的特征,可以更清晰地了解CD4+T细胞在EAE疾病进程中的变化规律,有利于对EAE的疾病进展有更清晰的认识。
因此,本研究采用C57BL/6小鼠建立单向进展型EAE模型,通过检测外周脾和CNS在疾病不同时期CD4+T细胞,来研究不同部位的CD4+T细胞在疾病发展过程的动态变化。
1 材料与方法
1.1 材料
1.1.1实验动物SPF级雌性C57BL/6小鼠共25只,10周龄~12周龄,购自北京维通利华实验技术有限公司,动物许可证号:SCXK(京)2016—0011,饲养于中国中医科学院中医基础理论研究所动物实验室,动物许可证号:SYXK(京)2016—0021。所有动物试验前先进行适应性饲养1周,温度20℃~25℃,相对湿度40%~60%,维持昼夜交替12 h光照,自由饮水及进食,分笼(每笼5只)进行饲养。试验遵守中国中医科学院相关规则制度,符合动物伦理道德规范。
1.1.2试剂髓鞘少突胶质细胞糖蛋白35-55多肽(MOG35-55:H-Met-Glu-Val-Gly-Trp-Tyr-Arg-Ser-Pro-Phe-Ser-Arg-Val-Val-His-Leu-Tyr-Arg-Asn-Gly-Lys-OH),HPLC纯度98.79%,上海强耀生物科技有限公司合成;完全弗氏佐剂(complete Freund adjuvant,CFA:含热灭活结核分支杆菌H37Ra5 mg/mL),美国Chondrex公司产品;百日咳毒素(pertussis toxin,PTX)),美国List Biological Laboratories公司产品;流式CD3和CD4抗体, BD公司产品;免疫组化CD4抗体,美国Abcam公司产品;免疫组化二抗(SignalStain○RBoost IHC Detection Reagent,HRP,Rabbit)、DAB显色试剂盒(SignalStain○RDAB Substrate Kit),美国Cell Signaling Technology公司产品。
1.2 方法
1.2.1动物分组及EAE造模雌性C57BL/6小鼠按体重随机分为空白组、模型1、模型2、模型3和模型4组,共5组,每组5只。MOG35-55多肽用磷酸盐缓冲液(PBS)充分溶解并稀释后与CFA等体积混合,在冰浴中用匀浆机进行匀浆制得油包水状的抗原乳化物。Day 0于模型组小鼠上腹部分两点皮下注射含200 μg MOG35-55多肽的抗原乳剂共200 μL,并于Day 0、Day 2分别给予每只小鼠腹腔注射200 ng PTX,诱导单向进展型EAE模型[7]。
空白组于Day 0取材,模型1组于Day 17取材,模型2组于Day 25取材,模型3组于Day 40取材,模型4组于Day 52取材。
1.2.2检测
1.2.2.1动物一般情况观察从Day 0开始,每天对小鼠状态进行观察,对各组小鼠进行神经功能评分。评分标准参考5分评分法,双盲法进行如下评分:1分:尾部张力降低;2分:中度后肢或前肢无力;3分:重度后肢或前肢无力;4分:四肢完全瘫痪;5分:濒死状态或死亡。中间情况以±0.5分计,小鼠神经功能评分≥1分,即为发病[8]。
1.2.2.2脾单个核细胞分离处死小鼠,取脾,于细胞筛中研磨,细胞匀浆用细胞过滤器过滤,得到脾匀浆。脾匀浆于4℃、1 500 r/min离心5 min,收集脾细胞沉淀。加入红细胞裂解液2 mL,室温反应5 min,加入2 mL培养基终止裂解。离心去上清,PBS清洗,得到脾单个核细胞[9]。
1.2.2.3流式细胞仪检测将脾单个核细胞按照每管1×106细胞/管分装于流式管中,用200 μL PBS进行混悬,常温避光条件下添加CD3和CD4抗体染色20 min。流式管加入2 mL PBS,混匀后300 r/min离心5 min,倒弃上清,剩余50 μL~100 μL液体,加入100 μL PBS 重悬后,上机检测。
1.2.2.4脑和脊髓固定及切片小鼠用5 mg/mL戊巴比妥钠经腹腔注射麻醉,剪开胸部,将灌注针由左心室穿入主动脉,剪开左心耳,依次注入9 g/L生理盐水、40 g/L多聚甲醛灌注固定。然后完整取出全脑和脊髓,分别切取大脑视交叉层面2 mm左右的脑组织、脑干、颈髓、胸髓及腰髓固定于100 mL/L中性福尔马林48 h。固定的标本以0.01 mol/L pH 7.4的PBS冲洗,在梯度乙醇溶液(700、800、950、950、1 000、1 000 mL/L)中脱水,二甲苯透明、浸蜡、石蜡包埋制备成蜡块。组织切片机取5 μm厚度连续切片,每间隔20 μm取1张,60℃烤干切片备用。
1.2.2.5免疫组化石蜡切片脱蜡至水,置于0.01 mol/L柠檬酸盐缓冲液(pH6.0)在微波炉内微波辐射10 min进行抗原修复,之后取出自然冷却,蒸馏水洗3次,每次5 min。滴加30 mL/L H2O2室温孵育10 min,PBS洗3次,每次5 min。滴加30 mg/mL BSA封闭30 min,去除封闭液,滴加稀释1 000倍的CD4抗体,4℃孵育过夜,PBS洗3次,每次5 min。滴加二抗,室温孵育30 min,PBS洗3次,每次5 min。DAB显色5 min,脱水,封片。免疫组化切片按照同一采集参数拍摄,每张切片随机采集图像10张,采用IPP(Image Pro Plus)图像分析软件进行免疫组化定量分析,选择阳性细胞积分光密度值(integrated optical density,IOD)作为免疫组化结果半定量分析的指标。

2 结果
2.1 小鼠的病情变化
小鼠从Day 14开始发病,发病率为100%,EAE小鼠发病表现为活动少,进食少,精神颓靡。随后几天逐渐出现尾部松弛无力,步态蹒跚,双后肢依次呈现麻痹状态,行动困难的临床症状,临床评分随着时间延长加重,到达高峰期后症状稍微缓解,之后则基本保持在3分不变。发病过程如图1所示。
2.2 脾CD4+ T细胞的动态变化
流式细胞仪检测S1、S2、S3、S4这4个时期EAE小鼠的脾中CD4+T细胞比例,与空白组相比发病后CD4+T细胞比例显著增加,并出现先上升后降低的趋势,CD4+T细胞比例在S2期达到最大值,随后降低(图2)。
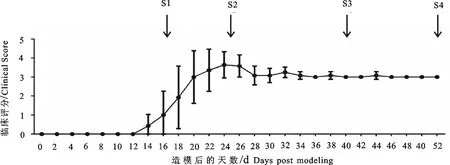
S1.发病初期;S2.发病高峰期;S3.平台初期;S4.平台后期
S1.Onset period;S2.Peak period;S3.Early platform period;S4.Late platform period
图1EAE小鼠发病评分
Fig.1Clinical score of EAE mice

S1.发病初期;S2.发病高峰期;S3.平台初期;S4.平台后期
S1.Onset period;S2.Peak period;S3.Early platform period;S4.Late platform period
图2不同时间点脾中CD4+T细胞流式结果
Fig.2The percentage of CD4+T cells in spleen detected by flow cytometry at different periods
2.3 中枢神经系统不同时期不同部位CD4+ T细胞的免疫组化结果
免疫组化检测S1、S2、S3、S4这4个不同时期,EAE小鼠大脑、脑干、颈髓、胸髓、腰髓的CD4+T细胞的浸润情况,结果如图3所示。相较于正常组小鼠,EAE小鼠的大脑、脑干和各段脊髓在各个时期中均出现较为明显的CD4+T细胞浸润,其中脊髓的浸润情况最明显,其次是大脑,再次脑干。在EAE的发展过程中,各个部位的CD4+T细胞的动态变化特点一致,均呈现先上升后下降的趋势。不同的是,大脑、脑干、胸髓和腰髓在S2期达到最大值,而颈髓在S3期达到最大值。
3 讨论
MS及其动物模型EAE是一类主要由T细胞介导的自身免疫性疾病,CD4+T细胞在EAE的发病中起到关键的作用[19]。对MS和EAE动物模型发病机理的研究,均证明CD4+T细胞是对自身抗原免疫应答的主要细胞[11]。而当激活的自身反应性CD4+T细胞进入CNS后,增殖分化,并分泌多种炎症因子,对CNS起到破坏作用[12]。因此,CD4+T细胞在整个EAE的发生和发展中都发挥重要作用,也在多个部位,包括外周脾和CNS病灶部位都发挥致病效应[13]。为了对EAE的发病过程以及CD4+T细胞在疾病发展过程中的作用有更加清楚地认识,了解在外周和CNS的CD4+T细胞随疾病进展的动态变化是十分必要的。

S1.发病初期;S2.发病高峰期;S3.平台初期;S4.平台后期
S1.Onset period;S2.Peak period;S3.Early platform period;S4.Late platform period
图3不同时期CNS不同部位CD4+T细胞免疫组化结果(200×)
Fig.3Immunohistochemistry result of CD4+T cells infiltration in different parts of CNS at different periods(200×)
本研究发现,相对于空白组小鼠,EAE小鼠的脾和CNS中的CD4+T细胞均显著增加,这与之前的研究是一致的,再次证明CD4+T细胞在EAE疾病发生发展过程中起到重要作用。另外,脾和CNS的CD4+T细胞随疾病进展的动态变化一致,基本于发病初期上升,发病高峰期出现峰值,平台初期下降,该结果提示CD4+T细胞可能在发病初期和发病高峰期发挥较重要的致病效应。在平台期,CD4+T细胞反而有所下降,考虑原因可能是机体对炎性改变的自我反应所致[14]。由于CNS中的CD4+T细胞是由外周进入的,脾和CNS的CD4+T细胞随疾病进展的动态变化一致,可以推测EAE小鼠CNS的CD4+T细胞浸润是受外周的CD4+T细胞数量变化的影响的,故可以通过干预外周CD4+T细胞的数量来降低CNS的CD4+T细胞浸润。
在EAE模型中,大脑、脑干和脊髓中均为炎症部位[15],研究CNS不同部位CD4+T细胞浸润情况,可以增加对EAE病理特点的认识,同时为进行EAE的CD4+T细胞相关研究的CNS取材部位提供参考。故选择大脑、脑干、颈髓、胸髓和腰髓进行实验,结果发现EAE小鼠CNS的不同部位中,以脊髓浸润最为明显。在EAE不同时期中,以发病初期、高峰期和平台初期的浸润较明显。本研究结果提示,选取C57BL/6小鼠建立单向进展型EAE模型进行有关CD4+T细胞的研究时,取材时间不宜过长。对于CNS进行CD4+T细胞的研究尽量选取脊髓,特别是腰髓段,若需要EAE小鼠发病较长时间后研究,尽量选择颈髓段。

