鲈鱼(Lateolabrax japonicus)蛋白抗氧化肽的酶解制备及结构鉴定
赵翊君,郑淋,蔡勇建,赵强忠
(华南理工大学食品科学与工程学院,广东广州 510640)
蛋白质经不同蛋白酶酶解后,可以得到生物活性肽。近年来许多研究表明,活性肽具有易吸收,高活性,低分子量等特点[1],可广泛应用于食品、化妆品和药品中。制备动物蛋白肽通常采用酶法水解,酶解法制备的产品因为生产条件温和,水解条件容易控制,水解产物的安全性也较高[2]。在酶法制备中,常用的商业蛋白酶有中性蛋白酶、木瓜蛋白酶、风味蛋白酶、Alcalase 2.4 L和复合蛋白酶等。
广东淡水鱼资源丰富,鲈鱼的产量尤其突出。鲈鱼(Lateolabrax japonicus),为真鲈科类动物。鲈鱼价格低廉,营养丰富,富含蛋白质,脂肪含量低,氨基酸组成平衡合理,开发潜力巨大[3]。目前对鲈鱼的研究主要集中在保鲜、繁殖和营养等方面[4~6],而对于酶解鲈鱼蛋白制备抗氧化肽的研究鲜见报道。因此,利用现代食品生物技术-控制酶解技术对鲈鱼进行深度开发,制备出具有抗氧化的富肽酶解物并开发系列保健食品,可提高现有资源的利用率,增加渔农的经济效益,为鲈鱼的深度加工提供一条新的途径。
近年来,研究人员发现相较于传统方法,色谱-质谱联用法鉴定多肽的结构具有诸多优势。色谱-质谱联用法既发挥了现代色谱对复杂样品的高分离能力,又应用了质谱具有的高选择性、高灵敏度以及能够准确提供化合物的分子量与结构信息的优点,适合鉴定多肽的结构,因此色谱-质谱联用法已经成为鉴定蛋白质和多肽的首选方法[7]。
本实验以鲈鱼肉蛋白为原料,以体外抗氧化活性(ABTS和ORAC)、水解度(DH)和蛋白回收率为指标,筛选出最佳水解酶,得到鲈鱼抗氧化肽,并通过 UPLC-MS/MS对鲈鱼抗氧化肽进行结构鉴定,然后进一步合成肽段验证其抗氧化活性,旨在探索鲈鱼深加工途径,为鲈鱼抗氧化肽的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
活体鲈鱼于夏季购于广州南沙农贸市场。
风味蛋白酶(500 LAPU/g)、复合蛋白酶(1.5 AU/g)、中性蛋白酶(1.5 AU/g)、及Alcalase 2.4 L(2.4 AU/g),丹麦 Novozymes公司;木瓜蛋白酶(200000 u/g),南宁庞博生物工程有限公司;邻苯二甲醛(OPA)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)、偶氮二异丁脒盐酸盐(AAPH)、荧光素钠、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),美国 Sigma公司;乙腈及甲醇等均为色谱纯级,美国 Sigma公司;合成的肽购于南京杰肽生物科技有限公司,包括 GGGAGMLLK、TDAETKTF、AGDSDGDGKIG、FIEEDELK、EYGTVVVFQ、ALTDAETKTF、HRDRLCVVQ、FIEEDELKLF及 AVIDQDKSGFIEEDELK,纯度均高于95%。其他化学试剂均为分析纯。
1.2 仪器与设备
UV-754N紫外可见光分光光度计,上海佑科仪器仪表有限公司;全波长扫描多功能读数仪,美国Thermo Fisher Scientific科技公司;ST 16R高速冷冻离心机,美国 Thermo Fisher Scientific科技公司;ACQUITY UPLC H-Class超高效液相色谱仪,美国Waters公司;Impact Ⅱ高分辨四级杆飞行时间质谱仪(UHR-QqTOF Mass),德国Bruker公司;数显pH计,上海精密科学仪器有限公司;Alpha 2-4 LDplus真空冷冻干燥机,德国Martin Christ Gefriertrocknungsanlagen公司。
1.3 方法
1.3.1 鲈鱼的酶解
将新鲜鲈鱼经去头去尾去骨去皮得到鲈鱼鱼肉,然后通过绞肉机制成鱼糜,取20 g鱼肉肉糜,加入40 mL纯净水,搅拌均匀,分别加入不同蛋白酶,加酶量为 0.5%(以鲈鱼鱼糜计),酶解温度为 50 ℃,在各酶的最适水解pH值下(木瓜蛋白酶:pH 7.0,复合蛋白酶:pH 7.0,中性蛋白酶:pH 7.0,风味蛋白酶:pH 7.0,Alcalase 2.4 L:pH 8.0)进行酶解,酶解时间6 h,酶解液经沸水浴灭酶15 min,4 ℃,8000 g下离心10 min,取上清液,冷冻干燥,即为鲈鱼蛋白酶解产物。
1.3.2 水解度(DH)的测定
水解度(degree of hydrolysis,简称DH)是指已断裂肽键所占百分比,使用邻苯二甲醛(OPA)[8]方法定量分析。3 mL OPA试剂与400 μL样品混匀作为样品组,水作对照组,0.97 mM丝氨酸作标准组,反应2 min,测定其在340 nm处的吸光度值。

1.3.3 蛋白回收率的测定
总氮的测定采用凯氏定氮法[9]。分别测定原料蛋白质含量和酶解液的蛋白质含量,按以下公式计算蛋白质回收率:

1.3.4 抗氧化活性的测定
1.3.4.1 ORAC法(Oxygen radical absorbance capacity)
ORAC的测定参照文献[10]的方法。该反应在 75 mM磷酸钠缓冲液(pH 7.4)体系中进行。取20 μL 0.1 mg/mL样品加入96孔荧光板为空中,再加入120 μL 70 mM荧光素溶液(最终浓度)。将混合物37 ℃预培养15 min后,迅速用多道移液器加入60 μL 12 mM AAPH溶液。读数前摇晃30 s,每1 min记录一次荧光值,记录100 min。激发波长和发射波长分别为485 nm和520 nm。空白组使用磷酸缓冲液代替抗氧化剂溶液。每个样品平行测定三次。荧光下的面积衰变曲线(AUC)计算为:
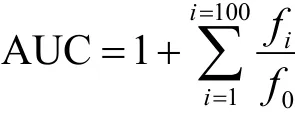
注:f0为初始荧光读数时间 0分,fi是荧光读数的时间 i分。
对应一个样品的净AUC计算如下:

计算出net AUC和Trolox浓度之间的线性回归方程。样品最终的ORAC值表示为μmoL的TE(Trolox当量)/g的抗氧化剂。
1.3.4.2 ABTS自由基清除能力法(Trolox equivalent antioxidant capacity)
ABTS自由基清除能力的测定参照文献[11]的方法。ABTS自由基清除能力法又称TEAC法。7 mM ABTS溶液与2.45 mM过硫酸钾等体积混合,在室温下放置 12~16 h 从而产生 ABTS·+。ABTS·+溶液采用50 mM pH=7.4 PBS稀释至空白组A734nm=0.70±0.02。在96微孔板中按下列方式加样后在30 ℃下反应30 min,每6 min测定一次A734。每个样品平行测定三次。
空白组:50 μL PBS+150 μL ABTS·+溶液;样品组:50 μL 0.1 mg/mL 样品+150 μL ABTS·+溶液。

其中,A0为空白组的吸光度值,AS为样品组的吸光度值。
以不同浓度(20~180 μM)的Trolox与ABTS清除率做标准曲线,样品的ABTS清除率代入标准曲线方程,求得的相当于Trolox浓度的值就是TEAC值。
1.3.5 UPLC-MS/MS鉴定肽结构[12]
将酶解产物溶于超纯水中,浓度为0.1 mg/mL,进样到在线连接RP-UPLC T3柱(2.1 mm×100 mm,1.8 μm)的电喷雾质谱仪。进样量5 μL,流动相A为水-甲酸(1000:1,V/V),流动相B为乙腈,所采用的梯度洗脱流程如下:0~1 min,0% B;1~9 min,0%~30.0% B(线性梯度);9~10 min,30.0% B(等量洗脱);10~13 min,30.0%~0% B(线性梯度);13~15min,0% B;流速:0.50 mL/min;检测波长:220 nm。样品以100 μL/min的流速进入质谱仪,采用正离子扫描模式,雾化气和干燥气为高纯氮气,扫描范围为质/核比 100~2000 u。
1.3.6 数据分析
所有的测定均重复三次,结果以平均值±标准偏差表示。数据采用IBM SPSS Statistics 20.0(SPSS Inc.,Chicago IL, USA)进行单因素方差分析,并以Duncans多重比较法进行显著性差异的分析(p<0.05)。
2 结果与讨论
2.1 鲈鱼蛋白酶解产物的酶解制备
2.1.1 不同蛋白酶酶解鲈鱼的酶解产物的水解度(DH)
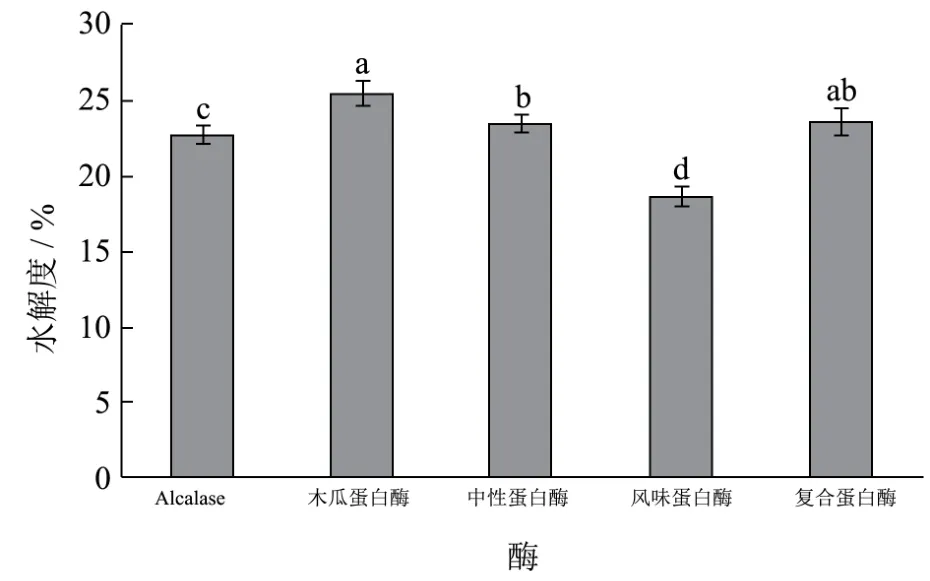
图1 不同蛋白酶酶解鲈鱼的酶解产物的水解度Fig.1 DH values of different enzymatic hydrolysates of bass
5种蛋白酶酶解鲈鱼得到的酶解产物水解度如图1所示,木瓜蛋白酶的水解度最高,为25.61%,但与复合蛋白酶(23.63%)无显著性差异,明显高于Alcalase 2.4 L和风味蛋白酶(分别为 22.85%和18.70%)。木瓜蛋白酶与复合蛋白酶水解度高有可能是由于这两种酶的酶切位点比较广,可以更好地水解鲈鱼蛋白,水解过程当中产生了更多小分子肽以及游离氨基酸[13]。
2.1.2 不同蛋白酶酶解鲈鱼的酶解产物的蛋白回收率

图2 不同蛋白酶酶解鲈鱼的酶解产物的蛋白回收率Fig.2 Protein recovery rates of different enzymatic hydrolysates of bass
从图2可以看出,不同蛋白酶酶解得到的酶解产物蛋白回收率有显著性差异(p<0.05)。其中酶解产物蛋白回收率从高到低依次所用的酶是木瓜蛋白酶>Alcalase 2.4 L>中性蛋白酶>复合蛋白酶>风味蛋白酶。由于酶自身的特异性,使之与蛋白底物的作用位点存在较大区别,因而各自水解得到的多肽数量有较大差别[14]。
2.1.3 不同蛋白酶酶解鲈鱼的酶解产物的抗氧化活性
2.1.3.1 不同蛋白酶酶解鲈鱼的酶解产物的ORAC值

图3 不同蛋白酶酶解鲈鱼的酶解产物的ORAC值Fig.3 ORAC values of different enzymatic hydrolysates of bass
从图3可知,不同蛋白酶对酶解产物的ORAC值有显著性差异(p<0.05),五种蛋白酶酶解得到的酶解产物均有一定的ORAC值,说明蛋白酶可有效水解鲈鱼中的蛋白,释放多肽,使之展现良好的抗氧化活性。其中,木瓜蛋白酶的ORAC值最高,为783.56 μmol TE/g,明显高于风味蛋白酶、复合蛋白酶、中性蛋白酶及Alcalase 2.4 L。
2.1.3.2 不同蛋白酶酶解鲈鱼的酶解产物的TEAC值
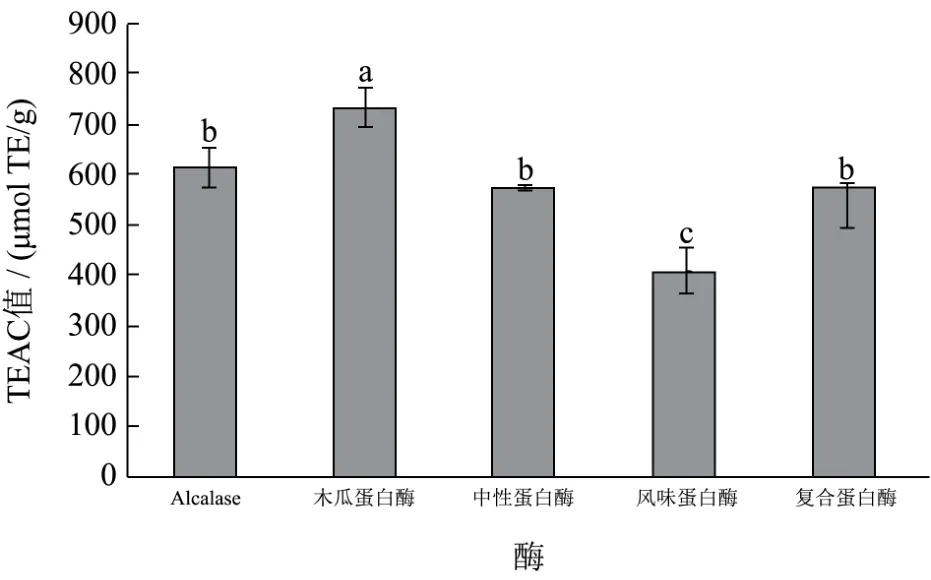
图4 不同蛋白酶酶解鲈鱼的酶解产物的TEAC值Fig.4 TEAC values of different enzymatic hydrolysates of bass
从图4可知,5种蛋白酶酶解鲈鱼得到的鲈鱼多肽均具有一定的TEAC值,木瓜蛋白酶的TEAC值最高,为734.55 μmol TE/g,明显高于风味蛋白酶、复合蛋白酶、中性蛋白酶及Alcalase 2.4 L。
木瓜蛋白酶酶解鲈鱼得到的鲈鱼多肽的抗氧化活性最高,这个可能是由于木瓜蛋白酶酶解鲈鱼产生了更多含有抗氧化氨基酸的肽段,此外,木瓜蛋白酶的DH也为最高,表明抗氧化活性和DH有关,因为鲈鱼鱼肉蛋白本身的结构使得其只有很小的抗氧化性,而酶水解后打断了这种紧密地结构,使得具有抗氧化性的活性氨基酸残基以及肽链暴露在外边,大大增强了其抗氧化能力。
不同蛋白酶均能有效水解鲈鱼,所得酶解产物的抗氧化活性不同,这可能是由于不同的蛋白酶酶切位点有差异,酶解得到的多肽分子量和序列不同,所以活性也会不一样[18]。其中木瓜蛋白酶所得酶解产物抗氧化活性最优。因而,本文进一步采用UPLC-MS/MS分析鉴定木瓜蛋白酶酶解产物的结构,并验证所得肽段的抗氧化活性。
2.2 鲈鱼抗氧化肽的结构鉴定

图5 木瓜蛋白酶酶解产物的BPC谱图Fig.5 Base peak chromatogram (BPC) of papain enzymatic hydrolysates

图6 木瓜蛋白酶酶解产物的UV谱图Fig.6 UV chromatogram at 220 nm of papain enzymatic hydrolysates
将木瓜蛋白酶酶解得到的鲈鱼酶解产物通过UPLC-MS/MS进行结构鉴定。图5和图6呈现了木瓜蛋白酶酶解产物的BPC (base peak chromatogram)谱图及在220 nm处的UV谱图。UV谱图中2 min处有一个主峰,经后续质谱鉴定这个峰是Tyr。由于Tyr含有苯环,在紫外区有很强的吸收,从而会对其他在紫外区响应较弱的物质造成掩蔽效应。游离的Tyr也具有一定的抗氧化活性,可能对木瓜蛋白酶酶解产物的抗氧化活性有贡献。
搜索MASCOT数据库,得到的鲈鱼酶解肽序列如表1所示。搜库一共得到9条肽段,最短为8肽,最长为17肽,其中6条肽段来源于小清蛋白,2条肽 段来源于肌球蛋白轻链,1条肽段来源于α-肌动蛋白。

表1 搜库得到的鲈鱼酶解肽序列Table 1 The sequence of peptides contained in the bass protein hydrolysates
2.3 鲈鱼酶解肽的抗氧化活性验证

图7 搜库得到的多肽序列的抗氧化活性Fig.7 Antioxidant activity of the synthetic peptides
搜库得到的9条肽段中,有6条肽段没有抗氧化活性,只有3条肽段展现出显著的抗氧化活性,分别为EYGTVVVFQ,HRDRLCVVQ和GGGAGMLLK,其抗氧化活性如图7所示。对比这3条肽段和谷胱甘肽(GSH)的抗氧化活性,发现:GSH的TEAC值最高,为 2.72 μmol TE/μmol,EYGTVVVFQ 次之,为2.34 μmol TE/μmol,HRDRLCVVQ 再次之,为 1.38μmol TE/μmol,GGGAGMLLK 没有 ABTS 自由基清除能力;3条肽段的ORAC值都高于GSH。对比Trolox可以看出,3条肽段的TEAC值都强于Trolox(>1.0 μmol TE/μmol);对于ORAC值,EYGTVVVFQ高于Trolox(>1.0 μmol TE/μmol),HRDRLCVVQ 和GGGAGMLLK比Trolox低。
EYGTVVVFQ中Tyr因含酚羟基可作为氢供体,可抑制由自由基引发的过氧化链反应。HRDRLCVVQ中Cys具有一个巯基(-SH),该基团上的氢原子非常活泼,可以直接清除自由基。GGGAGMLLK中Met上的S原子可以提供电子从而被氧化成Met亚砜,此外,它们由于具有共振结构而能维持抗氧化的稳定性。这些特点可能是这 3条肽段具有抗氧化活性的原因[15~18]。
3 结论
通过水解度、蛋白回收率和抗氧化活性的测定,确定制备鲈鱼酶解产物的最佳水解酶为木瓜蛋白酶。将木瓜蛋白酶水解得到的鲈鱼酶解产物通过UPLC-MS/MS进行结构鉴定,然后通过UniProt中的鲈鱼蛋白库进行搜库,得到9条多肽,体外合成这9条多肽并测定它们的抗氧化活性,其中EYGTVVVFQ,HRDRLCVVQ和GGGAGMLLK显示出一定的抗氧化活性。本实验中获得的鲈鱼酶解肽研究结果为其应用研究提供一定的科学理论依据。例如根据鲈鱼酶解肽的抗氧化性,可以将其作为天然的防止食品腐败变质的添加剂应用到食品中,以取代化学合成的防腐剂;也可将其作为抗衰老成分添加到化妆品中发挥养颜和延缓衰老的作用。

