在线固相萃取/高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测饲料中的黄曲霉毒素
刘 飞,任安书,葛 萍,丁年芳,娜仁·琪琪格
(南京华谱分析检测技术服务有限公司,江苏 南京 210001)

图1 4种黄曲霉毒素的结构Fig.1 Chemical structures of the four aflatoxins
黄曲霉毒素是一类化学结构类似的二氢呋喃香豆素衍生物,为黄曲霉菌和寄生曲霉菌等真菌经过聚酮途径产生的次生代谢产物,是一种天然存在的毒性极强的剧毒物质,并具有致突变、致畸形和致癌作用。1993年,黄曲霉毒素 B1就已被世界卫生组织(World Health Organization,WHO)的癌症研究机构认定为Ⅰ类致癌物[1-2]。研究表明:黄曲霉毒素B1的毒性为氰化钾的10倍,砒霜的68倍[3];且其致癌性是二甲基亚硝胺的70倍[4]。黄曲霉毒素是饲料中最常见的真菌毒素,因在自然条件下,玉米、花生、大米等粮食未能及时晒干或储藏不当受污染而产生。黄曲霉毒素严重威胁了饲料和食品的消费安全。天然产生的黄曲霉毒素根据化学结构不同主要包括黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2) 4种,其结构式如图1所示。
饲料中黄曲霉毒素的检测方法主要有薄层色谱法[5]、酶联免疫法(ELISA)[6-8]、液相色谱法[9-10]、液相色谱-串联质谱法[11-13]等。其中,薄层色谱法是测定饲料中黄曲霉毒素的传统方法之一,该方法对检测的规范和熟练程度要求较高,准确度较低,重现性较差[14];ELISA方法会对黄曲霉毒素及其类似物产生一定的交叉反应,可能产生假阳性或者假阴性的结果;液相色谱法检测黄曲霉毒素一般采用荧光检测器柱后衍生法,但该方法的检出限较高,且检测时间长;液相色谱-串联质谱法比液相色谱法具有更高的灵敏度和准确性,但可能存在基质抑制效应的影响。因此,建立一种简单、快速、准确度高的测定饲料中黄曲霉毒素的检测方法势在必行。
样品前处理是准确、有效测定黄曲霉毒素的基础,尤其是对于基质复杂的饲料样品,它甚至成为制约整个分析过程的决定性因素。本实验采用在线固相萃取富集技术,将饲料样品直接进样,通过优化在线富集条件和液相色谱-质谱条件,采用高效液相色谱-四极杆/静电场轨道阱高分辨质谱法进行分析,减少了人工操作的不确定因素,提高了方法的重现性,显著缩短了饲料样品的前处理时间。本方法具有前处理简便、分析时间短、测定结果准确、自动化程度高等特点,可用于饲料样品中黄曲霉毒素的测定。
1 实验部分
1.1 仪器、试剂与材料
四极杆静电场轨道阱高分辨质谱仪Q-Exactive(赛默飞世尔科技公司),配HESI-Ⅱ源,Spark SymbiosisTM在线固相萃取-液相色谱系统( Spark Holland,荷兰),包括系统自动进样器模块、二元高效液相色谱泵、SPE在线固相萃取仪(含溶剂混合高压注射泵和小柱接夹组件)柱温箱模块;高纯水发生器(英国ELGA公司);XW-80A型涡旋混合器(上海医科大学仪器厂);AFB1、AFB2、AFG1和AFG2(纯度≥99%,Sigma公司);乙腈(色谱纯,德国Merck公司);乙酸铵、甲酸(分析纯,南京化学试剂有限公司)。
1.2 标准溶液的配制
分别称取AFB1、AFB2、AFG1和AFG2标准品各10 mg于10 mL容量瓶中,用乙腈溶解并定容,配制成1 g/L的标准储备液,密封保存于4 ℃冰箱中。准确吸取1 g/L的4种单标准储备液各1 mL于10 mL容量瓶中,用乙腈定容得100 mg/L的混合标准溶液。根据需要,吸取一定量的标准溶液,用初始流动相将混合标准溶液稀释成系列标准工作溶液。
1.3 样品前处理
称取5 g样品于50 mL离心管中,加入1 g NaCl和20 mL乙腈-水(80∶20,体积比),溶解后,超声提取20 min,于8 000 r/min离心5 min,吸取乙腈层,用20 mmol/L乙酸铵溶液(pH 6.80~7.05)稀释10倍后进样;供高效液相色谱-四极杆静电场轨道阱高分辨质谱仪测定。
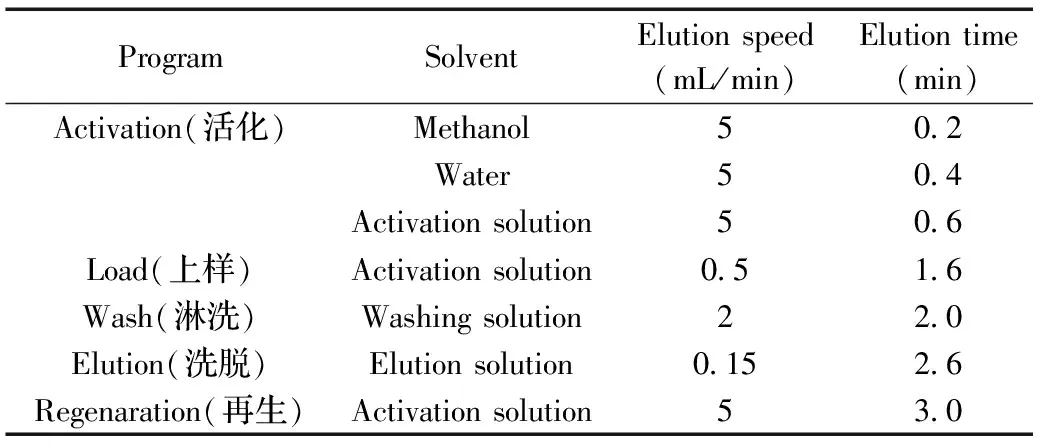
表1 固相萃取程序Table 1 Procedure of solid phase extraction
1.4 在线固相萃取条件
在线固相萃取柱为IMMUNOPREP®ONLINE AFLATOXIN(Part Code:P900),上样(活化)液:20 mmol/L乙酸铵溶液,调节pH值至6.80~7.00;淋洗液:含6%甲醇的20 mmol/L乙酸铵溶液,调至pH 8.30~8.50;洗脱液:含50 mmol/L乙酸铵的75% 甲醇水溶液,调至pH(2.00±0.05);稀释液:20 mmol/L乙酸铵溶液,调至pH 6.80~7.05;在线固相萃取程序如表1所示。
1.5 液相色谱条件
色谱分析柱为Diamonsil Plus(150 mm ×4.6 mm,5 μm);流动相为20 mmol/L 乙酸铵水溶液(A)-甲醇(B);流速0.70 mL/min;进样量10 μL;样品室温度25 ℃。色谱梯度洗脱程序为:0~2.00 min,95%A;2.00~2.05 min,95%~75%A;2.05~6.00 min,75%~5%A;6.00~8.00 min,5%A;8.00~8.05 min,5%~95%A;8.05~10.00 min,95%A。
1.6 质谱条件
可加热的电喷雾离子源(HESI-Ⅱ);毛细管温度为350 ℃,鞘气(N2)流速50 L/min,辅助气(N2)流速6 L/min,吹扫气(N2)流速3 L/min;喷雾电压为3 kV,透镜电压为50 V;采用正离子扫描模式;全扫描的分辨率R=35 000,扫描范围:100~500m/z。
2 结果与讨论
2.1 固相萃取柱与分析柱的选择
由于黄曲霉毒素在饲料中含量较低,直接进样分析需增大进样体积方能检出,但可能会超出色谱柱的承受范围,导致色谱柱寿命缩短,另一方面饲料中存在大量的矿物质、淀粉、蛋白质等干扰物质,国标GB/T 30955-2014中对黄曲霉毒素的检出限较高,必须进行富集。在AFB1、AFB2、AFG1和AFG2的分析前处理中,为提高目标化合物的分析效果,多选用免疫亲和柱作为分析小柱[15-17],因此本实验选用拜发公司生产的免疫亲和柱作为样品前处理固相萃取小柱;黄曲霉毒素在反相液相色谱柱上保留能力较强,选用C18基质的色谱柱作为分析柱,以乙酸铵水溶液和甲醇作为洗脱液进行梯度洗脱。固相萃取柱和分析柱具有一定的正交性,可降低分析柱分析结果的干扰[18]。
2.2 前处理方法的优化
本研究采用XLC分析模式,系统通过自动进样器采样后,经阀切换样品上样到活化的SPE小柱中,经固相萃取淋洗后,通过阀切换全量在线洗脱到LC分析柱上,然后进行液相分离-质谱分析。
以AFB1为靶标物质,本实验比较了以下3种前处理方式对回收率的影响。
①称取5 g样品于50 mL离心管中,加入20 mL乙腈-水(1∶1,体积比)溶解,加入4 g无水硫酸镁和1 g氯化钠,涡旋后,于8 000 r/min离心5 min,吸取1 mL乙腈层,用20 mmol/L乙酸铵溶液(pH=6.80~7.05)定容至10 mL;
②称取5 g样品于50 mL离心管中,加入20 mL乙腈-水(80∶20,体积比)溶解,于8 000 r/min离心5 min,吸取1 mL乙腈层,用20 mmol/L乙酸铵溶液(pH=6.80~7.05)定容至10 mL;
③称取5 g样品于50 mL离心管中,加入1 g NaCl,经20 mL乙腈-水(80∶20)溶解,超声提取后,于8 000 r/min离心5 min,吸取1 mL乙腈层,用20 mmol/L乙酸铵溶液(pH=6.80~7.05)定容至10 mL。
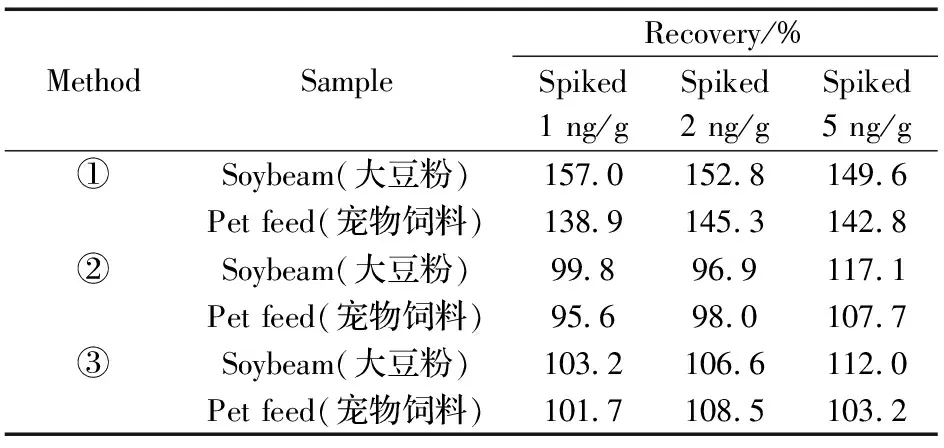
表2 3种前处理方法对样品加标回收率的影响Table 2 Influences of three pretreatment methods on recoveries of the sample

图2 50 μg/kg黄曲霉毒素标准溶液的提取离子流色谱图Fig.2 Extracted ion chromatograms of 50 μg/kg standard solution
结果表明:方法①的基质效应偏高,方法②和方法③的回收率明显优于方法①(见表2)。但在实际操作中发现,方法②中有些样品存在沉淀不彻底的现象,而方法③中NaCl的加入有助于杂质沉淀,使样品澄清,进样时不堵塞SPE柱,同时有利于延长SPE柱的使用寿命,因此选用方法③作为样品前处理方法。
2.3 在线固相萃取条件的优化
考虑到4种黄曲霉毒素从固相萃取小柱上洗脱,若与分析柱的流动相不一致,可能导致色谱峰拖尾。因此,确定分析柱的流动相和固相萃取柱的洗脱流动相均为乙酸铵和甲醇两种溶剂。通过调节甲醇-乙酸铵溶液的梯度比例,可将靶标物质与杂质分离。
在线固相萃取法处理样品包括3 个步骤:①样品组分由进样器与SPE 泵流动相引入到SPE 柱进行富集,干扰物(或基质)则从柱上流出并排至废液收集器,同时分析物黄曲霉毒素保留在SPE 柱上,分析柱处于清洗与平衡的过程;②通过阀切换,将4种靶标物质由SPE 柱转移至分析柱;③阀切换到初始位置,靶标物质在分析柱上保留洗脱,同时SPE 柱进行离线清洗和平衡,为下一针进样准备[19]。因此,阀切换时间和转移过程是在线固相萃取的核心步骤,本实验对标准品进行优化,以4种黄曲霉毒素均在质谱上提取出完整谱峰为依据,确定阀切换时间为2.6 min;SPE柱选择含50 mmol/L乙酸铵的75% 甲醇水溶液作为洗脱溶剂,将SPE柱吸附的4种靶标物质洗脱下来,同时将靶标物质保留在分析柱上,采用HPD共聚焦洗脱模式,确保所有靶标物质洗脱完全,提取质量数范围为10 ppm时4种黄曲霉毒素的提取离子流图如图2所示。
2.4 线性范围与定量下限
在优化条件下,对质量浓度分别为0.5、1.0、10.0、20.0、50.0 μg/L的AFB1、AFB2、AFG1和AFG2标准品进行分析。以黄曲霉毒素特征离子的色谱峰面积为纵坐标(y)、相应含量为横坐标(x,μg/L),绘制标准曲线,得到线性回归方程。由表3可知,4种黄曲霉毒素的相关系数(r)大于0.99,在0.5~50.0 μg/L范围内线性关系良好。分别以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)时对应的浓度为方法的检出限和定量下限,结果如表3所示。由表3可知,本方法对AFB1、AFB2、AFG1和AFG2的检出限为0.2 μg/kg,定量下限为0.5 μg/kg。
2.5 回收率与相对标准偏差
分别在浓缩饲料和发酵豆粕中添加0.5、1.0、5.0 μg/kg 3个水平的4种黄曲霉毒素标准品进行加标回收实验,每个水平平行测定5次,考察方法的回收率与精密度(见表4)。结果表明,4种目标化合物在饲料中的回收率为94.6%~114.3%,相对标准偏差(RSD)不大于8.3%。本方法的准确性较好,可用于实际饲料样品中4种黄曲霉毒素的检测。

表3 4种黄曲霉毒素的精确质量数、线性方程、相关系数、保留时间、检出限及定量下限Table 3 Accurate masses,regression equations,correlation coefficients(r),retention times,limits of detection(LOD,n=7) and limits of quantitation(LOQ,n=7) of AFB1,AFB2,AFG1 and AFG2
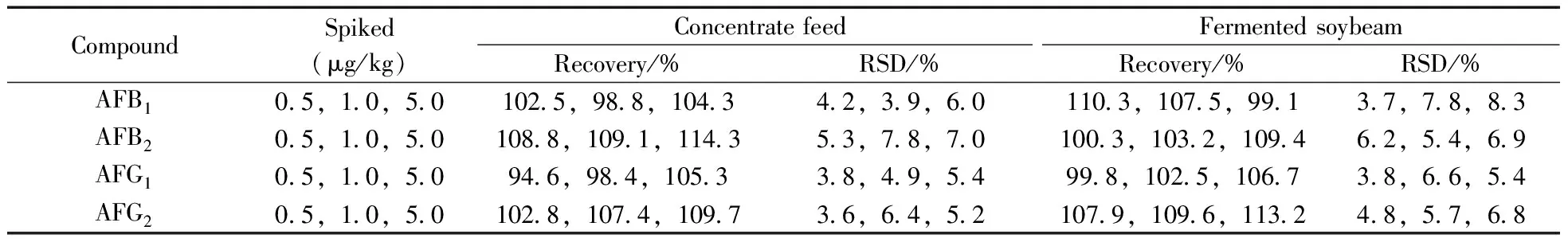
表4 饲料中4种黄曲霉毒素的加标回收率与相对标准偏差(n=5)Table 4 Recoveries and RSDs of AFB1,AFB2,AFG1 and AFG2 spiked in feeds(n=5)

图3 空白样品中加入黄曲霉毒素标准溶液(0.5 μg/kg)的提取离子流色谱图Fig.3 Extracted ion chromatograms from blank sample spiked standard solution(0.5 μg/kg)
2.6 实际样品的检测
运用本研究建立的方法,在上述测定条件下对30个进口饲料样品(包括宠物饲料、豆粕、浓缩饲料、配合饲料、发酵豆粕等)中4种黄曲霉毒素进行定性和定量分析,结果显示,30个样品均未检出AFB1、AFB2、AFG1和AFG2。其中,空白饲料中加入黄曲霉毒素标准溶液的提取离子流图如图3所示,可以看出,基质对4种化合物的分离分析无影响,本方法对饲料的测定准确、可靠。
2.7 与离线固相萃取/液相色谱-质谱方法的比较
与离线固相萃取/液相色谱-质谱法测定饲料中的4种黄曲霉毒素进行比较[20],本研究采用的自动化控制在线固相萃取方法,具有操作简单、整体分析时间短、全自动分析的特点。本方法的SPE柱理论上可进行100次饲料样品的分析,大大节约了检测成本。而且本方法通过阀切换技术和HPD共聚焦洗脱模式,使得样品中的大部分杂质可以直接流入废液中,仅靶标物质进入分析柱,从而延长了分析柱的使用寿命。此外,在线SPE方法的精密度更高,减少了人工操作的不确定性。
3 结 论
本研究通过阀切换技术将固相萃取与高效液相色谱-四极杆/静电场轨道阱高分辨质谱相结合,建立了在线固相萃取直接测定饲料中黄曲霉毒素的方法。样品经溶解、超声提取、稀释后直接进样测定,自动实现了靶标物质的在线富集和干扰杂质的在线去除。应用本方法可在13 min内完成整个检测过程,大大提高了检测效率。且该方法操作简单,能够满足饲料中4种黄曲霉毒素的分析要求。
参考文献:
[1] Egner P A,Wang J B,Zhu Y R.Proc.Natl.Acad.Sci.(USA),2001,98(25):14601-14606.
[2] Ren Y P,Zhang Y,Shao S L,Cai Z X,Feng L,Pan H F,Wang Z G.J.Chromatogr.A,2007,1143(1/2):48-64.
[3] Shyu R H,Shyu H F,Liu H W,Tang S S.Toxicon,2002,40(3):255-258.
[4] Papp E,H-Otta K,Záray G,Mincsovics E.Microchem.J.,2002,73(1/2):39-46.
[5] GB/T 8381-2008.Method for the Determination of Aflatoxin B1 in Feed——Semi-quantitative Thin Layer Chromatography.National Standards of the People’s Republic of China(饲料中黄曲霉毒素B1的测定 半定量薄层色谱法.中华人民共和国国家标准).
[6] Sun Q,Li G F,Deng Q M,Liu J M,Shi G Q.Environ.Chem.(孙清,李谷丰,邓乾民,刘杰民,石国庆.环境化学),2015,34(10):1845-1853.
[7] Li M,Ma F,Li P W,Zhang Q,Zhang W,Zhou H Y,Yin N R,Wang H L,Wu H.Chin.J.OilCropSci.(李敏,马飞,李培武,张奇,张文,周海燕,印南日,王恒玲,吴慧.中国油料作物学报),2014,36(6):802-807.
[8] Li H Q,Yu D W,Liu Z N,Li X,Xie X,Liu X C,Zhao Y,Song X D,Liu P P.FoodRes.Dev.(李海礁,喻东威,刘志楠,李欣,解鑫,刘晓川,赵媛,宋晓东,刘萍萍.食品研究与开发),2013,34(21):83-85.
[9] Li L,Li R,Xie G,Ye J,Wang S X.J.Instrum.Anal.(李丽,黎睿,谢刚,叶金,王松雪.分析测试学报),2017,36(6):800-804.
[10] GB/T 30955-2014.Method for the Determination of Aflatoxin B1,B2,G1,G2 in Seed Immunoaffinity Column Purification——High Performance Liquid Chromatography.National Standards of the People’s Republic of China(饲料中黄曲霉毒素B1、B2、G1、G2的测定 免疫亲和柱净化——高效液相色谱法.中华人民共和国国家标准).
[11] NY/T 2071-2011.Method for the Determination of Aflatoxins,Zearalenone and T-2 Toxins in Feed-Liquid Chromatography-Tandem Mass Spectrometry.Ministry of Agriculture of the People’s Republic of China(饲料中黄曲霉毒素、玉米赤霉烯酮和T-2 毒素的测定 液相色谱-串联质谱法.中华人民共和国农业部标准).
[12] Wang S M,Xu Y,Mao D,Zheng R,Wang K,Ji S.J.Pharm.Anal.(王少敏,许勇,毛丹,郑荣,王柯,季申.药物分析杂志),2011,31(5):907-911.
[13] Wang X P,Li P W,Yang Y,Zhang W,Zhang Q,Fan S F,Yu L,Wang L,Chen X M,Li Y,Jiang J.Chin.J.Chromatogr.(王秀嫔,李培武,杨扬,张文,张奇,范素芳,喻理,王琳,陈小媚,李英,姜俊.色谱),2011,(6):517-522.
[14] Liu L X,Zhang L,Xiang Y E,Huang Z W,Li H B,Cui J.LivestockFeedSci.(刘利晓,张亮,向艳娥,黄志伟,李洪波,崔佳.畜牧与饲料科学),2016,37(3):33-35.
[15] Han S,Liu Y,Lü M L,Li J Z,Wang J.Chin.J.Chromatogr.(韩深,刘萤,吕美玲,李建中,王金.色谱),2011,23:613-617.
[16] Sun X,Xi C X,Tang B B,Wang G M,Chen D D,Zhao H.Chin.J.Anal.Chem.(孙雪,郗存显,唐柏彬,王国民,陈冬东,赵华.分析化学),2016,44(6):970-978.
[17] Li J,Yu Y M,Tian M,Wang H W,Wei F,Li L,Wang X.Chin.J.Chromatogr.(李军,于一茫,田苗,王宏伟,卫锋,李莉,王雄.色谱),2006,24(6):581-584.
[18] Shen G H,Guo L P,Liu L S,Zhang W Y,Liu X D.Chin.J.Anal.Chem.(沈广虎,郭丽萍,刘利盛,张文英,刘晓达.分析化学),2014,42(12):1823-1827.
[19] Jia P Y,Zeng M F,Feng N J,Zheng D F,Sun F D,Sun R,Li C Y.Chin.J.Anal.Chem.(贾鹏禹,曾明飞,冯乃杰,郑殿峰,孙福东,孙蕊,李朝阳.分析化学),2014,42(12):1743-1749.
[20] Zhu C Y,Ying Y F,Wei M Y,Chen H H,Lu C B,Zhou W H,Lin X J,Luo C J.J.Chin.MassSpectrom.Soc.(朱聪英,应永飞,韦敏钰,陈慧华,陆春波,周文海,林仙军,罗成江.质谱学报),2010,31(4):240-246.

