超高效液相色谱-串联质谱法测定化妆品中6种生物碱
汪晨霞,张瑞瑞,寻知庆,郭新东,王 强,黄金凤
(广州质量监督检测研究院,广东 广州 511447)
生物碱(Alkaloids)是一类含氮有机化合物,多数为含氮杂环结构,生物活性显著,是中草药中重要的有效成分之一[1]。如藜芦碱是一类以西伐丁(Cevadine)、藜芦定(Veratridine)为主的甾体类生物碱,具有降压、抑菌及灭虫作用,可添加在化妆品中用以除菌杀螨以及治疗疥疮皮炎等[2];麦角碱类可促进子宫和血管收缩,对神经系统有一定作用;秋水仙碱在临床试验中有抑制细胞增长的作用,可用于治疗白血病、皮肤癌等。尽管生物碱大多具有显著的生物活性,但同时也具有潜在的毒害性[3],如藜芦碱是一种脂溶性神经毒素,可引起呕吐、心律不齐、昏迷、呼吸抑制;麦角生物碱可引起失眠、幻觉及中枢神经效应[4];秋水仙碱在人体内产生的衍生物二秋水仙碱,会腐蚀人体肠胃和泌尿系统[5]。
近年来,随着消费者对安全、健康、有效的护理方法的关注,越来越多的化妆品中开始添加纯植物提取的中草药成分,以达到提高保湿、抗菌、抗衰老等护肤功效。商家添加中草药在追求功效的同时,有可能会引入生物活性显著,但具有毒性的生物碱类化合物。长期使用这类化妆品将会给消费者的身体健康带来损伤[6-7]。因此《化妆品安全技术规范》(2015版)[8]及欧盟化妆品法规(EC) No1223/2009[9]已明确将藜芦碱及其盐类、秋水仙碱及其盐类、麦角菌属产生的麦角碱类、萝芙木引入的萝芙碱等多种生物碱类列入禁用物质名单,但目前国内针对化妆品中这几类生物碱的相关检测方法及标准却明显滞后。因此,建立一个快速、高效、灵敏的化妆品中生物碱的检测方法对于化妆品的安全性评价及风险监测均具有十分积极的意义。
目前生物碱的检测方法主要集中在体液[10]、中草药材[11]、农产品[12]及食品[13]等基质,所采用的分析方法有高效液相色谱法(HPLC)[14]、气相色谱-质谱联用法(GC-MS)[15]和液相色谱-串联质谱法(LC-MS/MS)[16-18]等,其中,HPLC操作简单,但检测器的检出限高,不适用于生物碱的痕量分析,且选择性差,易出现假阳性;由于大多数生物碱具有热不稳定性、高沸点,因此若采用GC-MS检测方法,需对生物碱进行衍生化处理,操作复杂,重现性差;而LC-MS/MS法结合了高效液相色谱和质谱的特点,适用范围广、选择性强、灵敏度高,特别是质谱的多反应监测技术可大大提高选择离子的灵敏度,在痕量分析方面具有很大优势,适用于化妆品这种基质复杂、目标物含量低的样品的检测分析。本文采用SPE净化结合超高效液相色谱-串联质谱法(UPLC-MS/MS)建立了一种同时测定化妆品中6种生物碱(秋水仙碱、萝芙碱、麦角胺、藜芦定、西伐丁、麦角克碱,结构式见图1)的检测方法,该方法操作简单,定性定量分析准确,适用于化妆品中生物碱的安全性评价分析。

图1 6种生物碱的分子结构式Fig.1 Molecule structures of six alkaloids
1 实验部分
1.1 仪器与试剂
Thermo Ultimate 3000 超高效液相色谱仪及TSQ Endura三重四极杆质谱仪(美国Thermo公司);TurboVap LV氮吹仪(美国Caliper公司);KQ-250DV数控超声波清洗器(昆山超声仪器有限公司);3K15 离心机(德国Sigma公司);Milli-Q超纯水器(美国Millipore公司);MS3涡旋仪(德国IKA公司)。
秋水仙碱、萝芙碱购自德国Dr.Ehrenstorfer GmbH;麦角胺购自以色列Fermentek公司;麦角克碱购自加拿大TRC公司;藜芦定、西伐丁盐酸盐购自美国IL公司;上述6种生物碱标准品的纯度均大于97%。乙腈、甲酸、氨水、甲醇(色谱级)购自美国Merck公司;HLB固相萃取柱(500 mg/6 mL)购自CNW公司;Cleanert PCX-SPE(500 mg/6 mL)、Cleanert PEP(500 mg/6 mL)购自天津Agela Technologies公司。
样品:随机购买本地市售添加了植物草本的化妆品30种,其中包括10种爽肤水、10种膏霜类和10种香波类化妆品。取样前混合均匀。
1.2 标准溶液的配制
生物碱混合标准中间液(100 μg/L):分别称取适量的6种生物碱标准品,用乙腈配成单标储备液(1 000 μg/L);然后分别吸取适量的单标储备液,用乙腈稀释成质量浓度均为100 μg/L的6种生物碱混合标准中间液。
生物碱混合标准工作液:吸取适量的生物碱混合标准中间液用空白基质提取液稀释定容,得到质量浓度分别为0.2、0.5、1.0、2.0、5.0、10、20 μg/L的混合标准工作溶液。
所有标准溶液均保存于4 ℃条件下。
1.3 实验方法
1.3.1样品提取称取0.5 g(精确至0.001 g)样品于10 mL具塞比色管中,加入4 mL 0.1%甲酸水-乙腈(1∶3,体积比,下同),涡旋振荡30 s使样品混合均匀,超声提取15 min,用0.1%甲酸水-乙腈(1∶3)定容至5.0 mL,涡旋混合均匀。吸取1.5 mL 提取液于高速离心管中,以10 000 r/min离心2 min,取1.0 mL上清液待净化。
1.3.2样品净化依次用5 mL甲醇和5 mL水活化Cleanert PCX固相萃取柱,取1.0 mL上清液上样,待溶液全部通过小柱后,用5 mL甲醇淋洗萃取柱,再用5 mL 5%(体积分数)氨化甲醇洗脱样品,收集洗脱液,氮吹至近干,用0.1%甲酸水-乙腈(9∶1)定容至1 mL,涡旋混匀,过0.22 μm有机系滤膜后待测。
1.4 检测条件
色谱柱:Thermo Hypersil GOLD 液相色谱柱(2.1 mm×100 mm×1.9 μm);柱温30 ℃;进样量为5 μL;流速0.3 mL/min;流动相:A为0.1%甲酸-乙腈,B为0.1%甲酸-水,梯度洗脱程序:0~3 min,60% B;3~6 min,60%~20% B;6~7 min,20%~60% B;7~8 min,60% B。
质谱条件:电喷雾离子源(ESI+);数据采集:多反应监测(MRM);离子化温度:310 ℃,辅助气流速:12 L/min;喷雾器温度:330 ℃,鞘气流速:40 L/min;电喷雾电压:3 500 V;碰撞气:氩气,1.5 mTorr;化合物的母离子及定性定量离子、碰撞电压和射频电压见表1。

表1 6种生物碱的质谱参数Table 1 The multiple MS parameters of 6 alkaloids
*quantitative ion
2 结果与讨论
2.1 检测条件的优化
2.1.1色谱柱的选择考察了Agilent Eclipse Plus C18(2.1 mm×100 mm×1.8 μm)、Waters ACQUITY UPLC BEH(2.1 mm×100 mm×1.7 μm)和Thermo Hypersil GOLD(2.1 mm×100 mm×1.9 μm) 3种液相色谱柱对6种生物碱的分离效果。结果发现:Agilent Eclipse Plus C18和Waters ACQUITY UPLC BEH柱对生物碱的保留能力较差,目标化合物峰形出现分叉,拖尾严重,而所有目标化合物在Thermo Hypersil GOLD柱上均能实现有效保留及分离,且重现性好,因此实验选用该色谱柱对样品进行分离。
2.1.2流动相的优化在正离子化模式下,水相中加入酸性介质有利于碱性化合物的正离子化,可以增强目标物的色谱峰响应。由于生物碱一般呈碱性,在流动相中加入乙酸铵可能会改善目标物的峰形和分离效果。因此实验考察了流动相的水相分别为0.1%甲酸、0.1%三氟乙酸和10 mmol/L 乙酸铵时的分离效果。结果表明:0.1%甲酸作为水相时色谱峰响应最高,峰形对称,分离度和灵敏度均能满足检测要求,可能因为呈碱性的生物碱与甲酸形成了中性的离子对化合物,与非极性固定相的作用增强,从而改善了分离效果,因此在水相中加入0.1%甲酸。分别以甲醇和乙腈作为有机相进行考察,结果显示,两种有机相下目标物的质谱响应相当,但有机相为乙腈时,色谱峰形更好、色谱柱柱压更低,因此选用乙腈作为有机相。综上,实验选择乙腈与0.1%甲酸混合溶液作流动相,此时目标物的检测灵敏度高,分离度好而且能有效改善色谱峰的拖尾现象,可以满足6种生物碱的检测分析要求。






图2 6种生物碱的提取定量离子色谱图 Fig.2 MRM chromatograms of six alkaloids
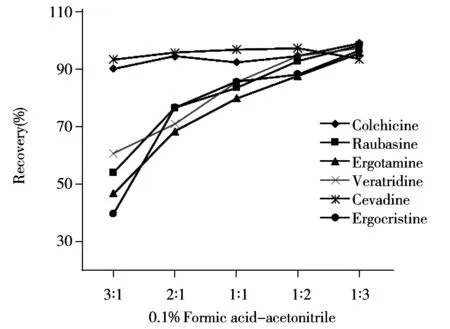
图3 不同提取溶剂回收率的对比Fig.3 Recoveries comparison of different extraction solvents

图4 不同固相萃取柱回收率的对比Fig.4 Recoveries comparison of different SPE columns the compounds numbers denoted were the same as those in Table 1
在最优UPLC-MS/MS检测条件下6种生物碱的提取定量离子色谱图如图2所示。
2.2 实验条件的优化
2.2.1样品提取方式的影响有文献[19]对比了超声水浴、涡旋振荡和水平振荡提取水、乳和霜类化妆品样品的效果,由于膏霜类和香波类化妆品的黏度较大,超声水浴提取可使样品分散均匀,与提取溶剂接触更充分。因此本实验选用超声水浴提取化妆品中的生物碱。由于提取时间的长短会对样品的回收效果产生显著影响,本实验考察了不同超声时间(0、5、10、15、20 min)对化妆品样品中6种生物碱提取效率的影响。结果显示,生物碱的回收率随着超声时间的延长而逐渐增大,到15 min之后回收率增长不明显,为节约时间,本实验的超声时间选用15 min。
2.2.2样品提取溶剂的影响化妆品的基质较为复杂,水溶性和脂溶性物质均较多,而6种生物碱的水溶性与脂溶性也存在差异,因此实验选择混合溶剂进行提取。生物碱的极性较大,且呈碱性,在酸性溶液中溶解性较好,所以采用0.1%甲酸-乙腈混合溶剂对膏霜类加标样品进行提取。对比了不同配比的0.1%甲酸-乙腈溶剂对样品的提取效果(如图3)。结果表明,脂溶性好的萝芙碱、麦角胺、藜芦定和麦角克碱随着乙腈比例的增加回收率逐渐增大;而秋水仙碱结构中存在酰胺基,西伐丁结构中存在酯基和羟基使得它们均具有较好的亲水亲脂性,因此经不同配比的0.1%甲醇-乙腈混合溶剂提取的回收率差异不大。实验最终选择以体积比为1∶3的0.1%甲酸-乙腈为提取溶剂,各待测物均能得到较好的回收效果。
2.2.3样品净化方法的影响生物碱类化合物作为禁用物质在化妆品中的含量通常很低,且化妆品中同时含有大量油脂和表面活性剂,基质复杂,若提取后直接上机,会对生物碱的检测产生严重干扰,因此需对提取液净化后再上机分析。目前报道的化妆品常用净化方法有正己烷除脂[19]、PSA分散固相萃取净化[20]及固相萃取柱净化[21]等。固相萃取技术(SPE)是近年来发展迅速的一种样品预处理技术,广泛应用于化工、食品和环境等领域。它将液固萃取和柱液相色谱技术相结合,可将目标物与干扰物有效分离,回收效果好。因此本实验选用SPE净化提纯目标物。由于固相萃取柱的种类较多,考虑到生物碱类化合物大部分呈碱性,极性较大,在硅胶和C18基质的固相萃取柱上保留较差,故选取以高分子聚合物为填料的Cleanert PEP 和Oasis HLB 以及适用于离子型化合物的Cleanert PCX柱进行研究。加标样品提取液上样后,Cleanert PEP和Oasis HLB先用5 mL水淋洗再用5 mL甲醇洗脱,Cleanert PCX用5 mL甲醇淋洗再用5 mL 5%氨化甲醇洗脱。所得回收率结果如图4所示,3种SPE柱对6种生物碱均有一定的保留,Cleanert PCX的回收率最高,这可能是因为在酸性条件下生物碱类带正电,净化过程中首先通过正负电荷的相互作用紧密吸附在阳离子交换固相萃取柱上,然后用强碱将其置换下来,因此阳离子交换柱对6种生物碱的保留能力较强、选择性好。本实验选用Cleanert PCX对样品进行净化。
2.3 方法验证
2.3.1基质效应化妆品基质较为复杂,基质引入的物质可能会干扰目标物的离子化效果从而影响其质谱响应。因此为消除样品基质效应,本实验采用空白基质提取液配制标准工作液,称取适量空白样品按照样品前处理方法操作,制备空白基质溶液,将标准储备液用空白基质溶液逐级稀释得到系列标准工作溶液,使得标准工作溶液和样品溶液均具有相似的离子化环境,从而确保了检测方法定性与定量分析的准确性。
2.3.2线性范围与检出限在最优的色谱和质谱条件下,分别测定质量浓度为0.2~20 μg/L的系列6种生物碱的混合标准工作液,以混合标准工作液的质量浓度为横坐标(x,μg/L),以各生物碱的定量离子对色谱峰面积为纵坐标(y)进行线性回归计算,得到6种生物碱的线性方程(见表2)。结果表明,6种生物碱在一定质量浓度范围内线性关系良好,相关系数均大于0.999 0。

表2 6种生物碱的线性方程、线性范围、相关系数、检出限及定量下限Table 2 Linear equations,linear ranges,correlation coefficients(r2),LODs and LOQs of six alkaloids
通过测定质量浓度为0.2 μg/L(秋水仙碱、萝芙碱、麦角胺)和0.5 μg/L(藜芦定、西伐丁、麦角克碱)的标准工作液,计算得到各化合物的仪器检出限(LOD,S/N=3)为0.06~0.16 μg/kg,结合前处理过程和回收率情况,最终计算得到6种生物碱的方法定量下限(LOQs,S/N=10)为2.0~5.3 μg/kg,结果见表2。该方法的灵敏度高,适用于化妆品中此6种生物碱的检测分析。
2.3.3精密度与回收率由于化妆品的样品基质各不相同,对方法的回收率及精密度影响较大。因而在最优实验条件下,选取3种基质(爽肤水、面霜、香波)的阴性样品进行加标回收实验。每种基质分别添加3个浓度,每个浓度平行测定6次,计算回收率和相对标准偏差(RSD)。结果表明,3种加标浓度的回收率为83.9%~101.1%,RSD为0.7%~6.6%(见表3)。方法的回收率和精密度均能满足日常检测的要求。

表3 6种生物碱的加标回收率及相对标准偏差(n=6)Table 3 Spiked recoveries and RSDs of six alkaloids(n=6)
2.4 实际样品的测定
为评价该方法的有效性,本实验测定了市售的爽肤水、膏霜、香波类等30种化妆品,所有样品中6种生物碱的检测结果均小于检出限。
3 结 论
本文以0.1%甲酸水-乙腈混合溶剂超声提取化妆品,Cleanert PCX柱净化,经超高效液相色谱-串联质谱法分离检测后,可同时测定化妆品中6种生物碱。实验通过对检测条件、样品前处理过程及净化手段的优化,使得该方法应用于水、膏霜和香波3种化妆品基质中均能得到较好的回收效果及重现性。本方法操作简单、可行性强、回收率高、结果准确、检出限低,方法学各项技术指标均满足定性、定量分析要求,适用于化妆品中有毒生物碱的测定,并为化妆品中生物碱禁用组分的风险监控提供了有效的技术支持。
参考文献:
[1] Kittakoop P,Mahidol C,Ruchirawat S.Curr.Top.Med.Chem.,2014,14:239-252.
[2] Zheng S Z,Cui C Q,Liu Y Z.J.Med.Sci.YanbianUniv.(郑善子,崔春权,刘永镇.延边大学医学学报),2004,27(1):31-32.
[3] Cushnie T P,Cushnie B,Lamb A J.Int.J.Antimicrob.Agents,2014,44:377-386.
[4] Mavungu J D,Malysheva S V,Sanders M,Larionova D,Robbens J,Dubruel P,Peteghem C,Saeger S D.FoodChem.,2012,135:292-303.
[5] Song J P,Wang T,Chen X M,Yang J,Zhang F C,Shang J.Chin.Pharmacol.Bull.(宋金萍,王涛,陈雪梅,杨洁,张富春,尚靖.中国药理学通报),2011,27(7):1019-1023.
[6] Gavaraskar K,Dhulap S,Hirwani R R.Fitoterapia,2015,106:22-35.
[7] Kozak M,Sobczak P,Zukiewicz-Sobczak W.HealthProblemsofCivilization,2016,10:64-70.
[8] People's Republic of China State Food and Drug Administration.Cosmetics Safety Specifications.2015 ed.Beijing:China Standard Press(中华人民共和国国家食品药品监督管理总局.化妆品安全技术规范.2015版.北京:中国标准出版社),2016.
[9] European Parliament and the Council.Regulation(EC) No 1223/2009 of the European Parliament and the Council of 30 November 2009 on Cosmetic Products.[2009-12-22].http://eur-lex.europa.eu/legal-content/ EN/TXT/PDF/uri=CELEX:32009R1223&qid=1488848613844&from=en.
[10] Sun J N,Chen J,Shi Y P.J.Chromatogr.A,2014,1352:1-7.
[11] Su M X,Song M,Yang D S,Shi J F,Di B,Hang T J.J.Chromatogr.B,2015,990:31-38.
[12] Guo Q Z,Shao B,Du Z X,Zhang J.J.Agric.FoodChem.,2016,64:7033-7039.
[13] Ma X F,Liang T Z,Song W,Feng H B,Zhang Y.FoodSci.(马晓斐,梁天佐,宋炜,冯浩彬,张岩.食品科学) ,2014,35(8):226-229.
[14] Qi L,Zhang J,Zhang Z Q.Chin.J.Chromatogr.(亓亮,张婧,张志琪.色谱),2013,31(3):249-253.
[15] Wu H Q,Zhang C H,Huang X L.J.Instrum.Anal.(吴惠勤,张春华,黄晓兰.分析测试学报),2013,32(9):1031-1037.
[16] Lin A H,Su X C,She D,Qiu K,He Q.J.Chromatogr.B,2016,1008:65-73.
[17] Li C,Li J M,Gu L H.Pharm.Today(李纯,栗建明,顾利红.今日药学),2018,28(3):152-154,161.
[18] Lorena L,Roberta M,Alessandra R,Clara M,Francesca C.FoodAnal.Methods,2016,9(6):1825-1836.
[19] Lin L,Zhang Y,Tu X K,Xie L Q,Yue Z F,Kang H N,Wu W D,Luo Y.Chin.J.Chromatogr.(林黎,张毅,涂小珂,谢丽淇,岳振峰,康海宁,吴卫东,罗耀.色谱),2015,33(3):275-281.
[20] Xun Z Q,Liu D H,Huang R R,He S,Hu D,Guo X D,Xian Y P.J.Sep.Sci.,2017,40(9):1966-1973.
[21] Luo H T,Huang X L,Wu H Q,Zhu Z X,Huang F,Lin X S,Ma Y F,Deng X,Zhou P C,Zhang Q Y,Jian Y T.J.Instrum.Anal.(罗辉泰,黄晓兰,吴惠勤,朱志鑫,黄芳,林晓珊,马叶芬,邓欣,周培才,张秋炎,简艳婷.分析测试学报),2016,35(2):119-126.

