基于Zn2+高灵敏检测的多肽荧光化学传感器的合成及荧光性质研究
王 鹏
(西华师范大学 化学化工学院,四川 南充 637009)
锌是人体所必需的微量元素,主要以离子状态作为酶的辅助成分存在于人体细胞和组织中[1-3]。锌参与细胞内几乎所有的新陈代谢过程,在细胞分裂、激素分泌、基因表达以及蛋白质和核酸合成等各方面扮演着重要角色。近年来,检测Zn2+的荧光化学传感器被广泛报道[4-5]。相比于其他类型荧光化学传感器,利用多肽固相合成技术设计并合成的多肽荧光化学传感器因为合成简便,水溶性好,灵敏度高,检测限低及响应时间短等优势被化学工作者所青睐[6-12]。在已有研究工作的基础上,我们设计并合成了一个基于荧光比率响应模式检测Zn2+的多肽荧光化学传感器L (Dansyl-His-His-Tyr-Pro-Gly-Tyr-His-His-Trp-Gly-NH2),在传感器L中,色氨酸(Trp)作为电子供体,脯氨酸(Pro)与甘氨酸(Gly)形成的二肽(Pro-Gly)折叠结构作为连接体,丹磺酰氯(Dansyl)作为电子受体,四个组氨酸(His)作为结合Zn2+的识别基团,根据软硬酸碱理论,组氨酸的咪唑基团可以很好与Zn2+发生配位结合作用。L具有很好的水溶性和很高的灵敏度,在290 nm激发条件下,当Zn2+存在时,基于荧光共振能量转移效应(FRET),色氨酸的发射峰(360 nm)下降,丹磺酰氯的发射峰(510 nm)上升,在HEPES缓冲溶液中实现了对Zn2+的比率型快速灵敏检测。
1 实验部分
1.1 药品、试剂和仪器
药品与试剂:Fmoc-Rink Amide 树脂(0.45 mmol/g),丹磺酰氯(97%),Fmoc-Tyr(tBu)-OH(99%),Fmoc-His(Trt)-OH(99%),Fmoc-Pro-OH(99%),Fmoc-Gly-OH(99%),Fmoc-Trp(Boc)-OH(99%)和O-苯并三氮唑-四甲基脲六氟磷酸酯(98%)购置于上海淘普生物科技有限公司,脱Fmoc保护基试剂 (六氢吡啶:N,N-二甲基甲酰胺=1∶4,V/V),接肽试剂 (二异丙基乙胺:N,N-二甲基甲酰胺=174:826,V/V)和多肽裂解液 (三氟乙酸:三异丙基硅烷:蒸馏水=9.5∶0.25∶0.25,V/V/V)在实验室自行配制;氢氧化钠(99%),氯化钠(99%),苯酚(99%),茚三酮(99%),三氟乙酸(99%),吡啶(99%),4-(2-羟乙基)-1-哌嗪乙磺酸(99%),二异丙基乙胺(98%)和三异丙基硅烷(97%)购置于上海九鼎化学有限公司;二氯甲烷,N,N-二甲基甲酰胺,无水乙醇,乙腈,无水乙醚,三乙胺和六氢吡啶等化学试剂均为分析纯,购置于利安隆博华(天津)医药化学有限公司。所有化学试剂直接使用,没有进一步处理。
仪器:精骐牌BC—4201摇床(上海鼎科科学仪器有限公司),25 mL多肽合成管(上海鼎科科学仪器有限公司),FD—1 Ultra-low freeze dryer型冷冻干燥机(北京比朗实验设备有限公司),Agilent1200液相色谱仪(美国安捷伦科技有限公司),C18半制备分离柱(美国安捷伦科技有限公司),湘仪牌H1850型高速离心机(湖南湘仪实验室仪器开发有限公司),Precisa XB120A型电子天平(上海天美天平仪器有限公司),Bruker Esquire HCT离子阱质谱仪(美国布鲁克公司),岛津RF—5301PC 型荧光分光光度计(日本岛津公司)。
1.2 L的合成与表征
(1)在电子天平上称取0.20 g Fmoc-Rink Amide 树脂,倒入25 mL多肽合成管中,加入10 mL二氯甲烷,浸泡30 min,然后用 N,N-二甲基甲酰胺洗涤3次,向多肽合成管加入脱除Fmoc保护基试剂5 mL,在3D摇床上反应30 min;分别用N,N-二甲基甲酰胺,二氯甲烷,无水乙醇,N,N-二甲基甲酰胺各洗涤3次,抽干树脂,进行K氏检测,若树脂颜色变成蓝紫色,则说明Fmoc-Rink Amide 树脂上Fmoc保护基已经完全被脱除,可以进行多肽缩合反应。
(2)称取0.10 g Fmoc-Gly-OH和0.20 g HBTU,用N,N-二甲基甲酰胺溶解,加入到上述多肽合成管中,加入的接肽试剂(40 μL),在3D摇床上反应1 h。抽干,进行K氏检测,若树脂颜色不变,说明缩合反应进行完全。向多肽合成管加入5 mL脱除Fmoc保护基试剂,在3D摇床上反应30 min。然后进行K氏检测,若树脂颜色变成蓝紫色,则进行下一步。
(3)重复上述(2)操作,直至十肽(His-His-Tyr-Pro-Gly-Tyr-His-His-Trp-Gly-NH2)全部合成完毕,将肽链缩合反应完的最后一个组氨酸的Fmoc保护基脱除。然后进行K氏检测,若树脂颜色变成蓝紫色,则说明组氨酸的Fmoc保护基已经完全被脱除,可以进行下一步。
(4)称取丹磺酰氯(0.1 g),用N,N-二甲基甲酰胺溶解,然后加入上述多肽合成管中,加入三乙胺(40 μL),在3D摇床上反应4 h。分别用N,N-二甲基甲酰胺,二氯甲烷,无水乙醇洗涤3次,抽干。
(5)现配4 mL的多肽裂解液,加入多肽合成管中,在3D摇床上反应4 h。将裂解得到的多肽产物倒入离心管中,加入-20℃无水乙醚,离心,弃去上清液,即得粗产物。
(6)利用高效液相色谱将粗产物进行纯化,由高效液相色谱纯化图可知产物的纯度高达95.65%,符合各项荧光检测的要求。利用Esquire 6 000离子阱质谱仪对L进行结构表征,由质谱图得到两个最高质谱峰分别为1 522.3578 g/mol和1 544.308 6 g/mol,最高质谱峰值分别对应[L+ H]+和[L +Na]+。由两个质谱峰可以看出是我们得到了目标产物。
2 结果与讨论
2.1 金属离子选择性研究
配置浓度为10-2mol/L,pH=7.4的HEPES缓冲溶液,10-3mol/L的荧光传感器L溶液和15种10-3mol/L的金属离子(Ag+,Al3+,Ca2+,Cd2+,Co2+,Cr3+,Cu2+,Fe3+,Hg2+,K+,Mn2+,Na+,Ni2+,Pb2+,Zn2+)溶液。在荧光比色皿中加入2 mL,10-2mol/L的HEPES缓冲溶液,依次分别加入20 μL,10-3mol/L的L溶液和20 μL,10-3mol/L的15种金属离子,并在荧光分光光度计中检测L对于15种金属离子的选择性识别检测情况(图1)。由图1a可以看出,若用290 nm激发,在含有L的HEPES缓冲溶液中加入Zn2+之后,由于色氨酸和丹磺酰氯之间存在荧光共振能量转移效应,荧光能量从色氨酸转移到丹磺酰氯,因此色氨酸的发射峰(360 nm)下降,丹磺酰氯的发射峰(510 nm)上升,荧光检测呈比率模式;当其他14种金属离子加入传感器L之后,L的荧光响应强度与L单独存在时相同,基本没有变化,所以在15种金属离子中,L可以通过比率型模式特异性识别Zn2+,而其他相关金属离子没有相同的比率模式响应。由图1b可以看出,当Zn2+加入传感器L后,荧光比率(F510/F360):增强了约8倍。这充分说明在290 nm激发下,在10-2mol/L,pH=7.4的HEPES缓冲溶液中,L可以实现对Zn2+的高选择性快速检测,而且荧光响应信号变化明显。
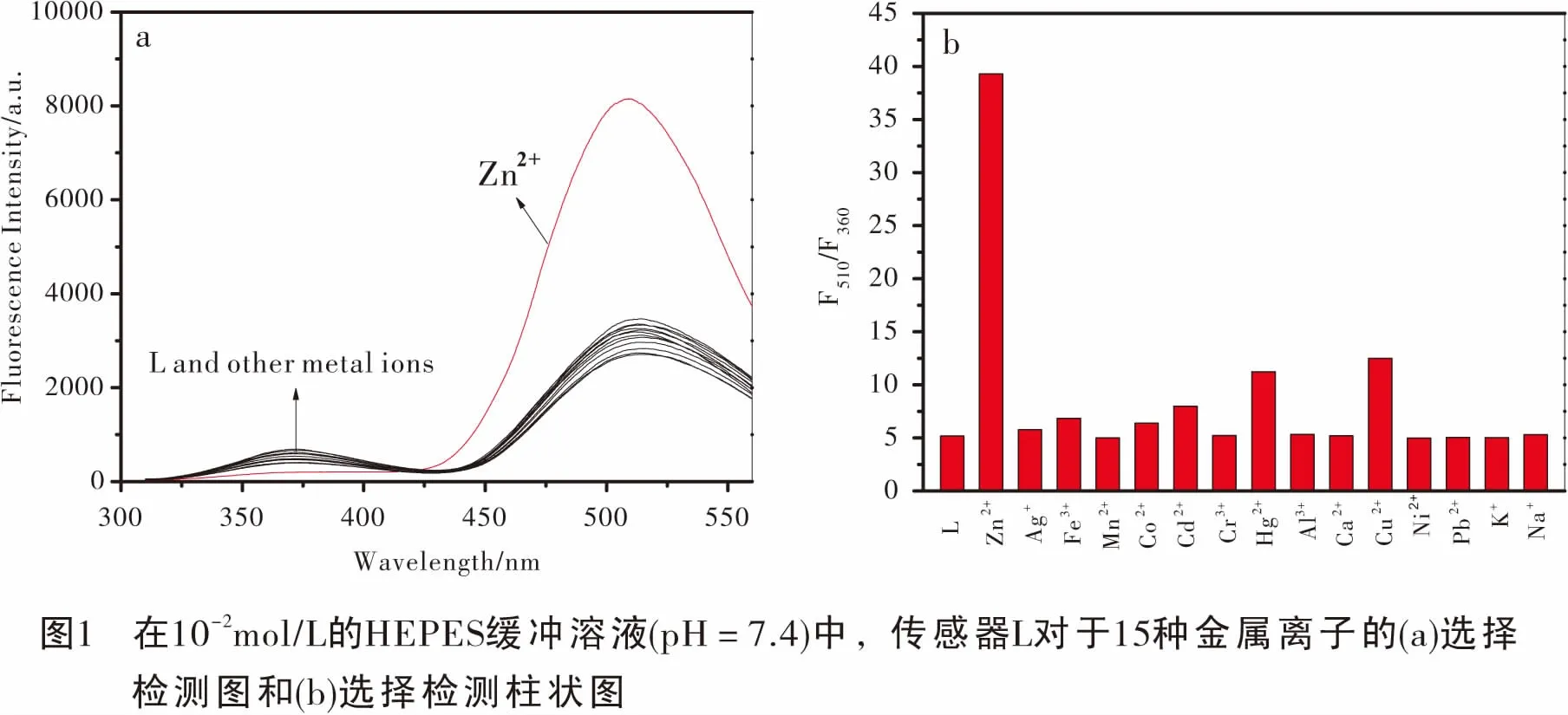
2.2 金属离子竞争性研究
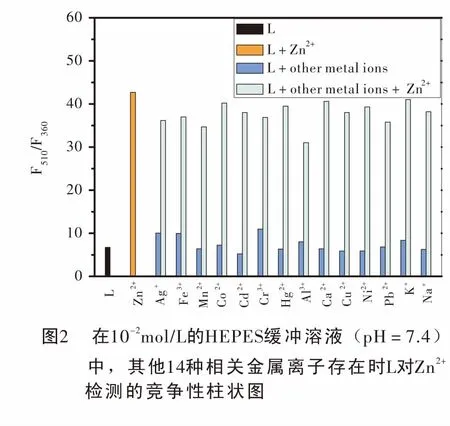
探讨化学传感器的荧光性质时,必须考察传感器抗其他相关金属离子干扰的能力。因此我们做了其他14种相关金属离子对Zn2+检测的荧光竞争实验。在荧光比色皿中加入2 mL,10-2mol/L的HEPES缓冲溶液 (pH=7.4),20 μL,10-3mol/L的L溶液和20 μL,10-3mol/L的Zn2+,记录下最大荧光发射峰值,然后分别在上述L-Zn混合溶液中加入20 μL,5×10-3mol/L其他14种金属离子,记录下最大荧光发射峰值,然后得到荧光干扰竞争图,由图2可以看出,传感器L在检测Zn2+的过程中,即使加入5倍量的其他金属离子,除过Al3+,其他金属离子几乎不存在竞争和干扰现象,但Al3+的干扰也在预期的误差范围之内。实验现象表明L具有良好的抗干扰能力,可应用于其他金属离子存在的复杂环境中实现对Zn2+的特异性检测。
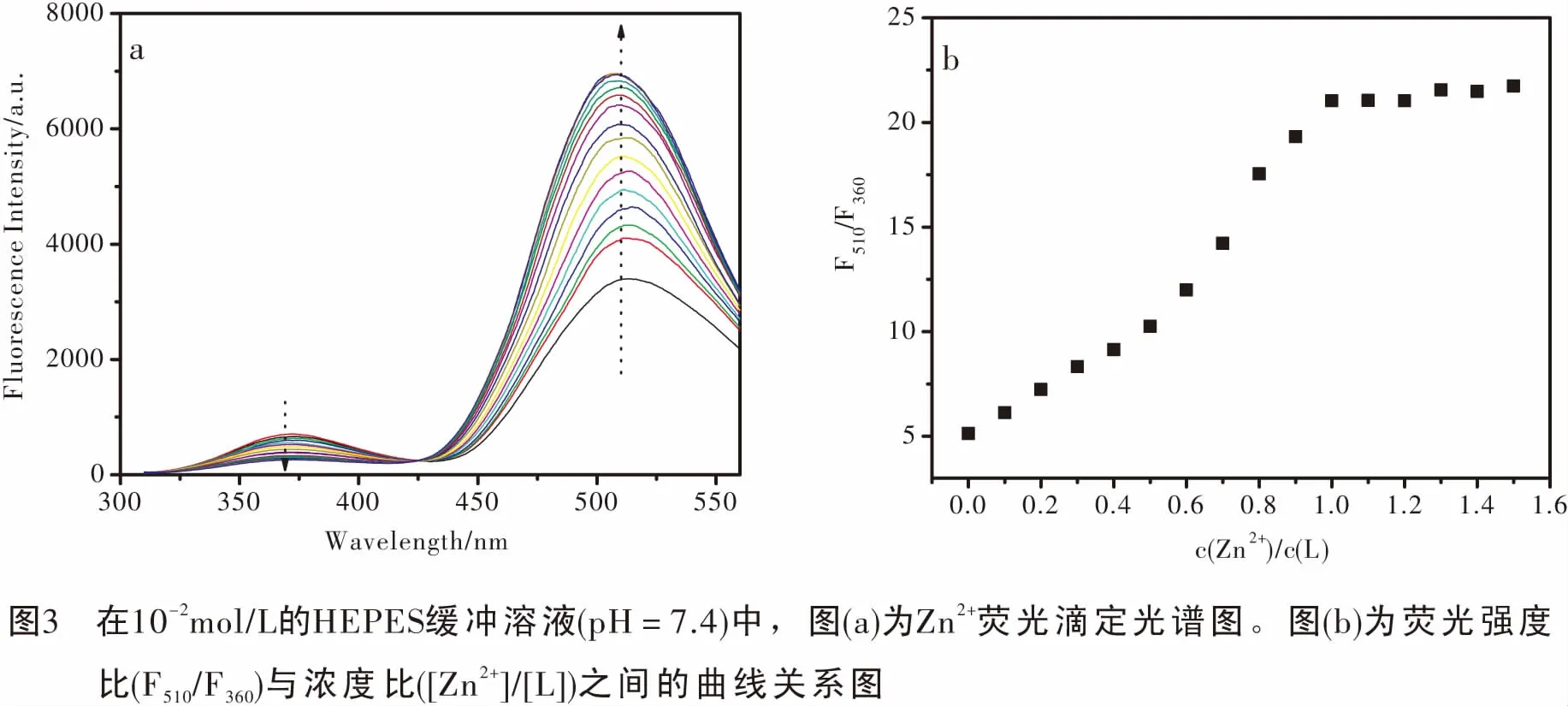
2.3 Zn2+荧光滴定研究
为了确定传感器L与Zn2+的配位结合模式,我们做了Zn2+的荧光滴定实验。在荧光比色皿中加入2 mL,10-2mol/L的HEPES缓冲溶液 (pH=7.4)和20 μL,10-3mol/L的L溶液,然后累计依次加入0~1.5 eq.的10-3mol/L的Zn2+进行荧光测量,记录下360 nm和510 nm处的最大荧光发射峰值,得到Zn2+的荧光滴定图和荧光滴定趋势图(图3)。从荧光滴定图(图3a)可以看出,在290 nm激发下,随着Zn2+浓度依次递增,传感器L中色氨酸的发射峰(360 nm)逐渐下降,相应的丹磺酰氯的发射峰(515 nm)逐渐上升,能量从色氨酸转移到丹磺酰氯。从荧光滴定趋势图(图3b)可以看出,当Zn2+浓度滴加到达20 μL时,荧光滴定达到饱和,由此可以得出L和Zn2+的结合比例是1∶1,即一个L分子结合一个Zn2+。
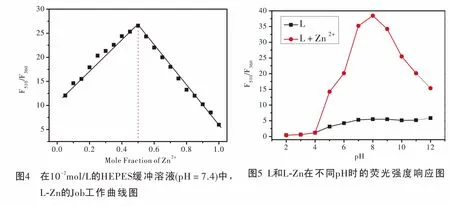
2.4 Job工作曲线测定
Job工作曲线也是确定传感器和金属离子结合模式的重要手段之一。在290 nm激发下,我们分别向荧光比色皿中加入2 mL,10-2mol/L的HEPES缓冲溶液 (pH=7.4),然后加入10-3mol/L的L和10-3mol/L的Zn2+离子,L体积在20 μL~0 μL范围内依次等梯度递减,同时Zn2+的体积在0~20 μL范围内依次等梯度递增,且两者体积之和始终为20 μL。记录下各比例条件下的最大荧光发射峰值,作图后的丹磺酰氯和色氨酸荧光强度比(F510/F360)最大时的浓度比即为L和Zn2+的结合比。根据配体L-Zn的Job曲线图(图4)再次证实L与Zn2+以1∶1的方式进行结合。
2.5 pH响应研究
将多肽化学荧光传感器应用于生理条件范围内检测Zn2+具有重大的生物应用意义。为此我们做了pH荧光响应实验,即在pH=2,3,4,5,6,7,8,9,10,11,12的10-2mol/L的HEPES缓冲溶液中分别测试20 μL,10-3mol/L的L和20 μL,10-3mol/L的L-Zn的比率荧光强度变化情况。图5为传感器L和L-Zn的荧光强度随pH变化的响应趋势图。由该图可以清晰的看出,当传感器L溶液单独存在时,丹磺酰氯和色氨酸荧光强度比(F510/F360)在pH为 2~12范围内基本没有什么变化,然而在L溶液中加入Zn2+形成配合物后,在6~10的pH范围内丹磺酰氯和色氨酸荧光强度比(F510/F360)明显高于L单独存在时的荧光强度比。文献报道人体生理pH值约为7.0~7.4,因此L可以在生理范围内实现对Zn2+的荧光检测研究。
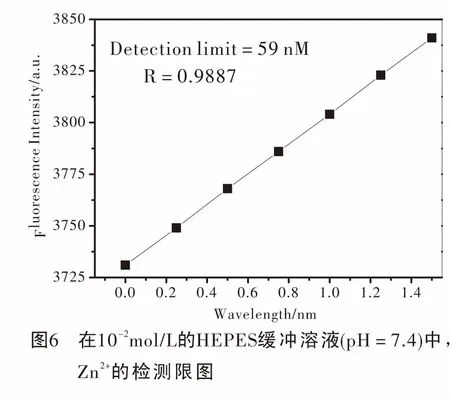
2.6 Zn2+的检测限研究
通过荧光滴定数据,我们可以计算出Zn2+的检测限。在2 mL,10-2mol/L的HEPES缓冲溶液 (pH=7.4)中,通过逐次等量递增Zn2+浓度,在发射波长在510 nm处测得系列荧光强度数据。重复三组平行实验取最好的一组并求标准偏差得到图6,从图6可以观察到,在Zn2+浓度为0~1.5 μM范围内呈现良好线性曲线(R=0.9887)。最后,利用检测限LOD=3σ/k公式计算出Zn2+的最低检测限为59 nM。该实验结果表明传感器L可以在体外实现对Zn2+的高灵敏检测。
3 结 论
合成了一个新颖的多肽荧光化学传感器L(Dansyl-His-His-Tyr-Pro-Gly-Tyr-His-His-Trp-Gly-NH2),基于荧光能量共振转移机理,在HEPES缓冲溶液中实现了对Zn2+的高灵敏比率型检测。通过荧光选择实验分析发现L对Zn2+具有很好的特异性荧光检测性能;通过Zn2+荧光滴定实验和Job工作曲线可知L和Zn2+的以1∶1的结合方式进行配位结合;通过相关金属离子竞争性实验得到其他14种金属离子对Zn2+的检测基本没有干扰作用;通过pH响应实验得知L对Zn2+在人体生理范围内均有较好的识别能力;最后,通过计算得到Zn2+的最低检测限为59 nM。综上所述,在HEPES缓冲溶液中,传感器L能够高灵敏特异性实现对Zn2+离子的比率模式检测。
参考文献:
[1] HENKEL G,KREBS B,Metallothioneins:Zinc,cadmium,mercury,and copper thiolates and selenolates mimicking protein active site features-structural aspects and biological implications[J].Chemical Reviews,2004,104(2):801-824.
[2] KOBAYASHI H,OGAWA M,ALFORD R,et al.New strategies for fluorescent probe design in medical diagnostic imaging[J].Chemical Reviews,2009,110(5):2620-2640.
[3] HOU F.P,HUANG L,XI P X,et al.A retrievable and highly selective fluorescent probe for monitoring sulfide and imaging in living cells[J].Inorganic Chemistry,2012,51(4):2454-2460.
[4] KOBAYASHI H,OGAWA M,ALFORT R,et al.New strategies for fluorescent probe design in medical diagnostic imaging[J].Chemical Reviews,2009,110(5):2620-2640.
[5] SENGUPTA P,VAN ENGELENBURG S B,LIPPINCOTT-SCHWARTZ J.Superresolution imaging of biological systems using photoactivated localization microscopy[J].Chemical Reviews,2014,114(6):3189-3202.
[6] KIM H N,REN W X,KIM J S,et al.Fluorescent and colorimetric sensors for detection oflead,cadmium,and mercury ions[J].Chemical Society Reviews,2012,41(8):3210-3244.
[7] LIU Z,HE W,GUO Z,Metal coordination in photoluminescent sensing[J].Chemical Society Reviews,2013,42(4):1568-1600.
[8] THIRUPATHI P,LEE K H,A ratiometric fluorescent detection of Zn (II) in aqueous solutions using pyrene-appended histidine[J].Bioorganic & Medicinal Chemistry Letters,2013,23(24):6811-6815.
[9] WANG P,WU J,LIU L X,et al.A peptide-based fluorescent chemosensor for measuring cadmium ions in aqueous solutions and live cells[J].Dalton Transactions,2015,44(41):18057-18064.
[10] KIM J M,LOHANI C R,NEUPANE L N,et al.Highly sensitive turn-on detection of Ag+in aqueous solution and live cells with a symmetric fluorescent peptide[J].Chemical Communications,2012,48(24):3012-3014.
[11] NEUPANE L N,OH E T,PAK H J,et al.Selective and sensitive detection of heavy metal ions in 100% aqueous solution and cells with a fluorescence chemosensor based on peptide using aggregation-induced emission[J].Analytical Chemistry,2016,88(6):3333-3340.
[12] JUNG K H,OH E T,PARK H J,et al.Development of new peptide-based receptor of fluorescent probe with femtomolar affinity for Cu+and detection of Cu+in Golgi apparatus[J].Biosensors and Bioelectronics,2016,85:437-444.

