以硼替佐米为基础的化疗方案治疗多发性骨髓瘤的疗效及其对血液指标的影响
李鑫
多发性骨髓瘤(multiple myeloma,MM)是一种以骨髓中浆细胞异常增生并伴有异常球蛋白分泌的B细胞来源的恶性血液系统肿瘤[1]。有资料显示,我国MM发病率约为1/10万,西方国家发病率为4/10万,发病年龄50~60岁,男性多于女性[2]。近年来,随着新型靶向治疗药物蛋白酶抑制剂硼替佐米的出现,MM的临床治疗效果得到明显改善[3]。硼替佐米是二肽硼酸盐类似物,是一种可逆的蛋白酶体抑制剂。硼替佐米的靶点为蛋白酶体,可抑制糜蛋白酶和胰蛋白酶的活性,从而发挥抗肿瘤作用[4]。为此,回顾性分析我院近年来收治的MM患者既往治疗的病例资料,旨在观察以硼替佐米为基础的化疗方案治疗MM的疗效及其对血液指标的影响。现报告如下。
1 资料与方法
1.1 一般资料 病例资料来源于我院2010—2017年收治的MM患者的临床资料,入组病例均有明确的化疗方案(含或不含硼替佐米);化疗前后有详细的血液化验结果(包括血小板、凝血指标和纤溶指标);化疗效果可量化评价;剔除不符合上述要求的病例。本研究最终入组MM患者119例,依据化疗方案是否含有硼替佐米分为对照组61例和观察组58例。对照组男32例、女29例;年龄52~71岁,中位年龄61岁;依据国际分期系统(ISS)分期Ⅰ期21例、Ⅱ期25例、Ⅲ期15例。观察组男30例、女28例;年龄51~70岁,中位年龄62.3岁;ISS分期Ⅰ期19例、Ⅱ期23例、Ⅲ期16例。两组患者性别、年龄、分期等基线资料差异无统计学意义(P>0.05),具有可比性。
1.2 化疗方案
1.2.1 对照组 患者采用的化疗方案不包括硼替佐米,具体包括VAD和VTD方案。VAD方案:长春地辛1 mg,D1~4,静脉滴注;表阿霉素15 mg/m2,D1~4,静脉滴注;地塞米松40 mg,D1~4、9~12、17~20,口服。VTD方案:长春地辛1 mg,D1~4;沙利度胺200 mg,D1~28;地塞米松40 mg,D1~4、9~12、17~20,口服。
1.2.2 观察组 患者采用的化疗方案含有硼替佐米,具体方案包括:PD、PAD和PCD方案。PD方案:硼替佐米1.3 mg/m2,D1、4、8、11,静脉推注;地塞米松40 mg,D1~4、8~11、15~18,口服。PAD方案:硼替佐米1.3 mg/m2,D1、4、8、11,静脉推注;表阿霉素15 mg/m2,D1~4,静脉滴注;地塞米松40 mg,D1~4、8~11、15~18,口服。PCD方案:硼替佐米1.3 mg/m2,D1、4、8、11,静脉推注;环磷酰胺400 mg/m2,D1,静脉滴注;地塞米松40 mg,D1~4、8~11、15~18,口服。两组均以28 d为1个化疗周期,重复4~8周期[5-6]。
1.3 疗效判定 完全缓解(CR):血清和尿M蛋白免疫固定电泳均为阴性;软组织浆细胞瘤消失;溶骨病变在范围或数量上没有增加;骨髓浆细胞<0.05。部分缓解(PR):血清M蛋白下降≥50%;24 h尿轻链下降>90%或<200 mg/24 h;软组织浆细胞瘤缩小≥50%;溶骨病变在范围或数量上没有增加。微小缓解(MR):血清M蛋白水平下降25%~49%;24 h尿轻链下降50%~89%,但>200 mg/24 h;软组织浆细胞瘤缩小25%~49%;溶骨病变在范围或数量上没有增加。疾病稳定(SD):无进行性骨髓瘤相关性器官或功能损害的证据以及M蛋白和24 h尿轻链分泌水平变化<25%并持续>3个月。疾病进展(PD):血清M蛋白水平上升大于基线水平的25%和(或)绝对值增加>5 g/L;24 h尿轻链分泌增加大于基线水平的25%和(或)绝对值增加200 mg;骨髓浆细胞比例增加大于基线水平的25%,绝对值增加10%;原有的溶骨损害或软组织浆细胞瘤体积较前增大;出现新的溶骨病变或软组织浆细胞瘤;出现其他原因不能解释的高钙血症,校正后的血清钙>2.8 mmol/L[7]。
1.4 检测方法 本研究仅对观察组患者的血液指标进行观察,血样采集时间点为首次化疗前、化疗1 d和4 d用药后。采用比浊法检测测血小板最大凝集率(PAGm);运用全自动凝血分析仪检测血浆凝血时间(TT)、活化部分凝血活酶时间(aPTT)和血浆凝血酶原时间(PT);运用酶联免疫吸附法(ELISA)检测D-二聚体(DD);运用发色底物法检测纤溶酶原活性(PLG)、组织型纤溶酶原激活物活性(t-PA)、纤溶酶原激活抑制物活性(PAI)、α2-抗纤溶酶抑制物活性(α2-PI)[8]。
1.5 统计分析 采用SPSS 20.0软件,计量资料以均数±标准差表示,不同时间点比较采用方差分析检验;计数资料以率表示,组间比较采用χ2检验,检验水准α=0.05。
2 结果
2.1 治疗效果 对照组CR 5例、PR 11例、MR 9例、SD 7例、PD 29例,总有效率为52.5%;观察组CR 11例、PR 14例、MR 10例、SD 8例、PD 15例,总有效率为74.1%,两组总有效率差异有统计学意义(χ2=5.996,P<0.05)。
2.2 血液指标变化 观察组患者PAGm随时间推移逐渐降低,不同时间点差异有统计学意义(P<0.05);DD随时间推移逐渐升高,不同时间点差异有统计学意义(P<0.05);而其他指标变化不明显,不同时间点差异无统计学意义(P>0.05)。见表1。
3 讨论
多发骨髓瘤(MM)是B细胞淋巴瘤的一种,主要特征为骨髓浆细胞异常增生,并伴有单克隆免疫球蛋白过度生成[9]。MM虽然为血液科常见的疾病之一,但该病早期常无典型症状,常以贫血、高钙血症、肾损伤等为首发症状,尤其是对于老年患者来说,更是容易导致漏诊、误诊等[10]。临床上,MM的主要治疗包括干细胞移植及化疗等,由于干细胞治疗治疗目前难以得到推广,因此MM治疗仍以化疗为主。
硼替佐米是第一个被批准用于治疗复发难治性骨髓瘤的蛋白酶体抑制剂(PI)。该药能够通过稳定TκB,有效抑制MM细胞内NF-κB的活性,有效逆转其NF-κB高表达所导致的肿瘤细胞的异常增生,从而发挥抗肿瘤生长作用。此外,硼替佐米还可通过阻断白细胞介素、血管内皮细胞生长因子的合成,影响MM细胞的黏附,导致肿瘤细胞凋亡[11]。有资料显示,硼替佐米单药有效率不高,仅为30%左右,然而与激素类或免疫调节剂联用,有效率可达60%~90%[12]。
本研究中,我们旨在比较以硼替佐米为基础的化疗方案治疗MM的疗效及其对血液指标的影响。结果显示,含有硼替佐米为基础的化疗方案在总有效率方面,明显优于不含硼替佐米的化疗方案。而且,我们在进一步血液分析中发现,硼替佐米仅对血小板和DD有一定影响,而在整体上对止凝血功能影响不大。
综上所述,我们推荐初始治疗的MM患者应该尽可能选择含有硼替佐米的化疗方案,以期获得更大的治疗收益。
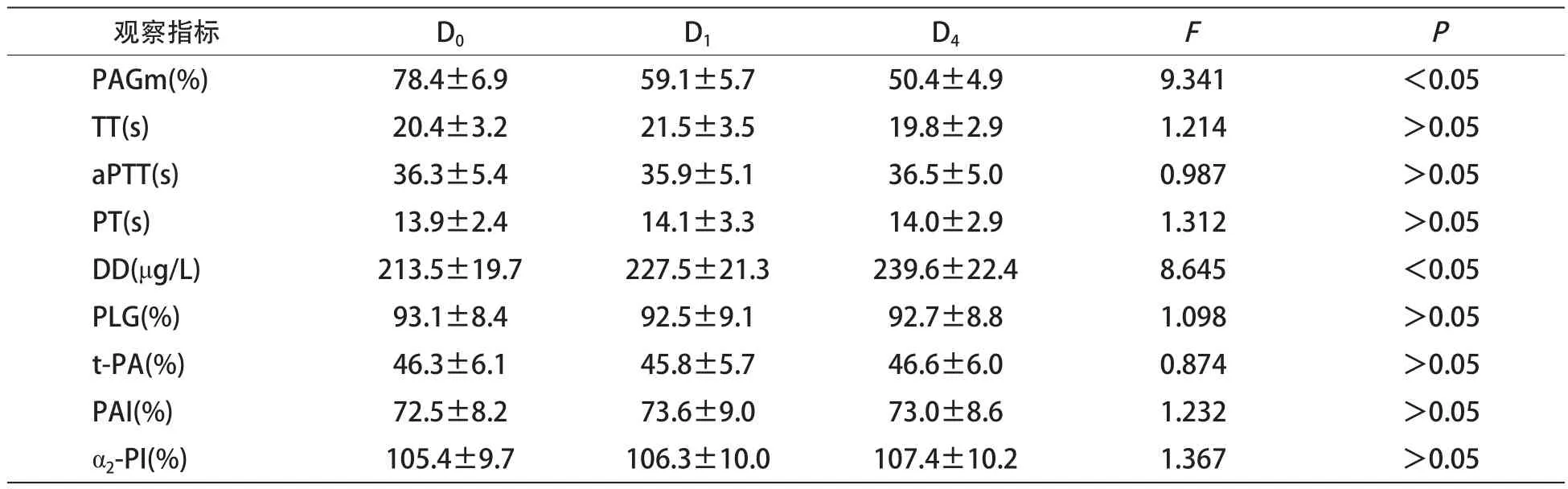
表1 观察组不同时间点血液指标变化
[1] 武贤达,孙丽霞,吕鸿雁,等.多发性骨髓瘤治疗新进展[J].临床荟萃,2017,32(7):627-632.
[2] 路瑾.多发性骨髓瘤诊断标准的变迁及其对治疗的影响[J].中国肿瘤临床,2014,41(13):819-822.
[3] 容建创,陈海燕.硼替佐米联合地塞米松治疗多发性骨髓瘤的效果研究[J].北方药学,2017,14(9):72-73.
[4] 周黎.硼替佐米联合地塞米松治疗初发多发性骨髓瘤的疗效分析[J].数理医药学杂志,2018,31(1):103-104.
[5] 葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2014:602-606.
[6] 汪世花,赵国祥,杨国彪,等.含硼替佐米的联合化疗对多发性骨髓瘤的治疗效果及不良反应[J].大家健康,2017,11(36):178-179.
[7] 中国多发性骨髓瘤工作组.中国多发性骨髓瘤诊治指南[J].中华内科杂志,2008,47(10):869-872.
[8] 韩东海,高大.以硼替佐米为基础的化疗方案对骨髓瘤患者血小板、凝血及纤溶功能的影响[J].血栓与止血学,2017,23(5):750-752.
[9] 任羽,贺爱军.硼替佐米在多发性骨髓瘤中的疗效与应用[J].中国继续医学教育,2017,9(3):138-140.
[10] 刘光美.硼替佐米联合地塞米松治疗多发性骨髓瘤的疗效分析[J].中外医疗,2017(32):133-134,137.
[11] 李光彩,付存玉,张志刚,等.改良硼替佐米、地塞米松及环磷酰胺方案治疗多发性骨髓瘤的临床效果分析[J].药品评价,2017,14(20):19-22.
[12] 施玲玲,翟勇平.多发性骨髓瘤细胞对硼替佐米耐药机制的研究进展[J].中国实验血液学杂志,2017,25(5):1576-1579.

