生存素对淀粉样前体蛋白代谢的调节作用
蒋伟青,袁欣,刘晨,任潇,王永刚
(1.上海交通大学医学院附属仁济医院 神经内科,上海 200127;2.郑州大学第一附属医院 神经内科,河南 郑州 450052)
阿尔兹海默病(Alzheimer’s disease,AD)病理学特点表现为脑内淀粉样斑块和神经原纤维缠结[1]。淀粉样斑块由β-淀粉样蛋白(β-amyloid protein,Aβ)沉积所形成,而Aβ由淀粉样前体蛋白(amyloid precursor protein,APP)经过蛋白水解作用而产生,APP代谢异常会导致Aβ的产生和清除失衡而导致Aβ过度沉积[2-3]。凋亡参与许多神经退行性疾病如AD的神经元死亡过程[4]。生存素(survivin)是凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族的重要成员之一,在抑制凋亡和调控细胞分裂中起重要作用[4]。本研究探讨survivin对APP代谢的调节作用。
1 材料和方法
1.1 材料 原代大鼠海马神经元、PC12细胞购自上海赛傲公司。survivin抗体、APP抗体及GAPDH内参抗体购自英国Abcam公司。细胞凋亡检测试剂盒购自上海翊圣公司。Lipofectamine 2000购自美国Invitrogen公司。
1.2 方法
1.2.1 免疫荧光技术:细胞爬片用PBS浸洗后,用4%多聚甲醛固定15 min,PBS浸洗后,0.5% Triton X-100(PBS配制)室温通透20 min,PBS浸洗后用山羊血清室温封闭30 min,4 ℃孵育一抗过夜,PBST浸洗后,室温避光孵育荧光二抗,PBST浸洗后,封片,在荧光显微镜下观察采集图像。
1.2.2 质粒转染:转染前1 d,将细胞接种到6孔板。次日,吸尽培养基,用Opti-MEM培养基洗涤细胞2次。对于每孔细胞,用200 μL Opti-MEM培养基分别稀释空载体1 μg、HA-APP质粒1 μg、HAAPP质粒和GFP-survivin质粒[5]各1 μg,混匀放置10 min后将Lipofectamine 2000与质粒混合,混匀后室温放置25 min,加入到6孔板的细胞中推匀,将培养板放入37 ℃孵育,转染48 h后进行蛋白提取或凋亡染料染色。
1.2.3 Western blot:利用CockTail/RIPA(1∶100)裂解细胞提取总蛋白,测定蛋白浓度后定量加样进行SDS-PAGE电泳,转PVDF膜后用5% BSA于室温慢摇封闭2 h,TBST洗涤后,4 ℃摇孵育一抗(5% BSA稀释)过夜,TBST洗涤后,室温慢摇孵育HRP二抗(5%BSA稀释)2 h,TBST洗涤后进行压片显影。
1.2.4 流式细胞仪检测:凋亡染色利用细胞凋亡检测试剂盒,PI和Annexin V染色后进行流式细胞仪分析,利用CellQuest软件对结果进行分析、绘制散点图。
1.3 统计学处理方法 采用SPSS21.0进行统计学分析。计量资料以±s表示,2组间比较采用独立样本t检验,3组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 免疫荧光染色结果 通过免疫荧光染色后,利用激光共聚焦显微镜观察,发现在体外原代培养的大鼠海马神经元内survivin与APP可以共存。这一结果提供了survivin在神经系统内调节APP代谢的形态学证据(见图1)。

图1 大鼠海马神经元survivin与APP免疫荧光染色结果(×63)
2.2 Western blot检测结果 将构建好的HA-APP质粒分别单转染或者与GFP-survivin质粒共转染具有神经元反应性的PC12细胞,转染48 h后,裂解细胞,通过Western blot检测APP在PC12细胞内的表达。结果显示,APP和survivin共转染组与APP单转染组比,APP表达量明显降低,差异有统计学意义(P<0.01),见图2。这表明survivin可以抑制APP在PC12细胞内的表达。
2.3 流式细胞仪检测结果 将APP单转染与APP和survivin共转染PC12细胞用凋亡染料PI和Annexin V染色后,经流式细胞仪检测发现,APP单转染后出现了大量的细胞凋亡,APP和survivin共转染后凋亡率明显下降,差异均有统计学意义(P<0.01),见图3。表明APP过量表达可以诱发细胞凋亡,survivin可以抑制APP所引起的细胞凋亡。
3 讨论
本研究发现,体外原代培养的大鼠海马神经元内survivin与APP可以共存,survivin可以抑制APP在PC12细胞内的表达,APP过量表达可以诱发细胞凋亡,survivin可以抑制APP所引起的细胞凋亡。
凋亡是许多神经退行性疾病中神经元死亡过程的重要参与因素[4]。虽然一些临床和亚临床的研究已经报道IAP的神经保护作用,但是它们的临床益处尚不清楚。Survivin在胚胎组织及有细胞增殖的组织均有表达[6-7],且在炎症组织[8]、创伤性脑损伤[9-10]和肿瘤组织[11-13]中有过表达。通过操纵survivin来抑制凋亡和调控有丝分裂从而达到神经元的保护作用,因此可在神经修复和保护中得以利用。细胞实验已证明survivin基因(杆状病毒IAP重复序列)突变体对分化后神经细胞具有促进分裂和增殖的作用[14],另有动物研究报道,在脑损伤后,survivin参与调节成年小鼠海马DG区神经前体细胞活性并抑制神经元凋亡或程序性死亡[15]。另外,已有不同survivin突变体用于肿瘤治疗的研究[16],借鉴类似的方法,有助于开拓对神经退行性
疾病治疗的新思路。
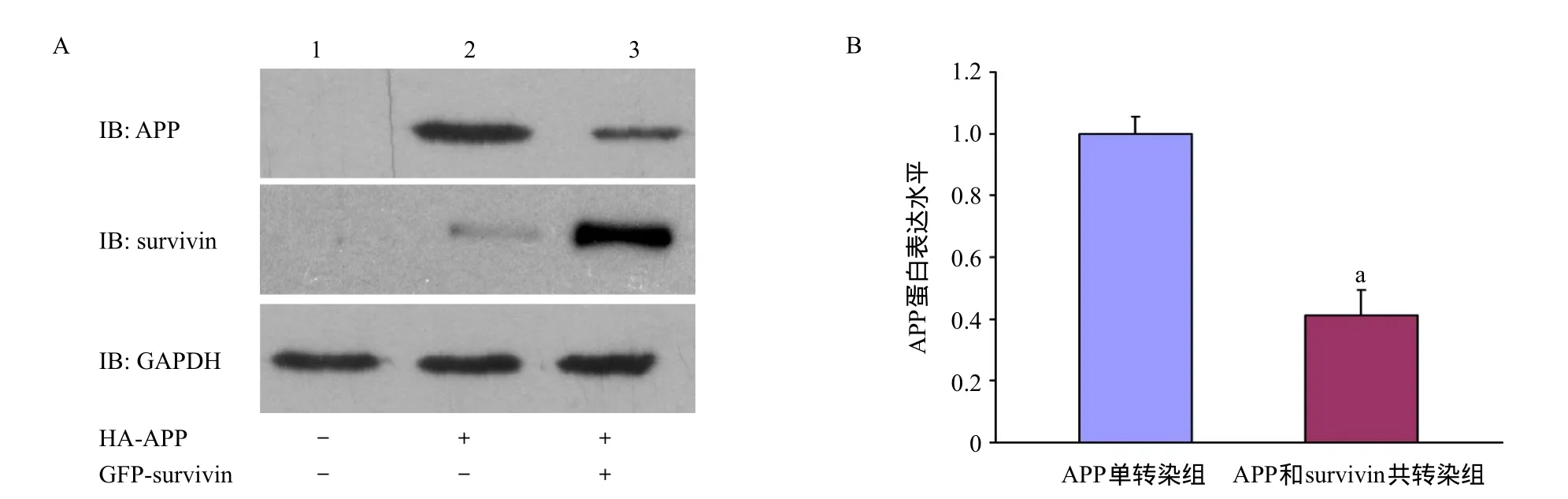
图2 Survivin抑制APP在PC12细胞内的表达
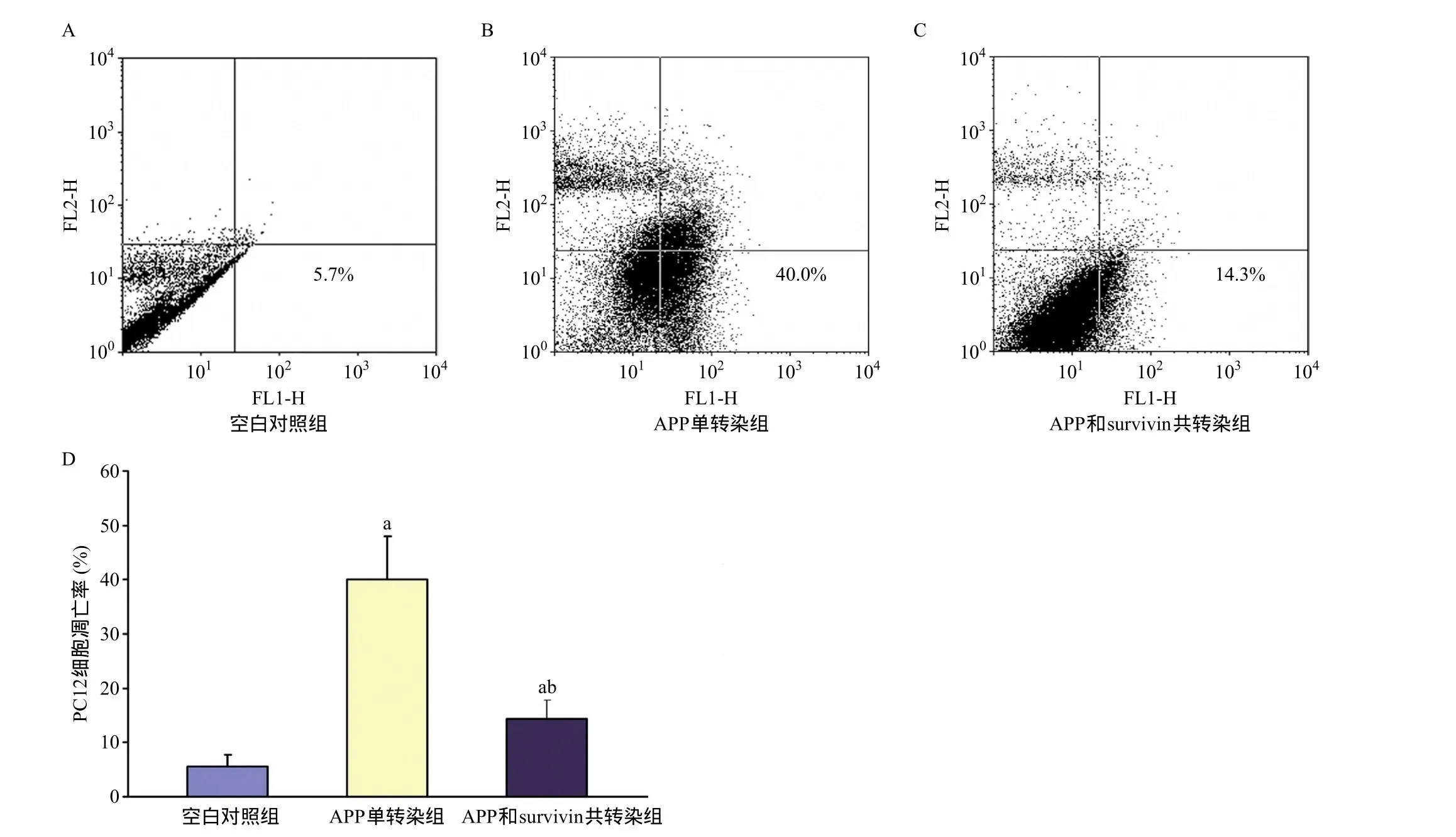
图3 Survivin抑制APP诱导的PC12细胞凋亡
APP是APP家族蛋白成员之一,不同的酶促作用使其产生具有不同生理作用的衍生物。APP参与引起痴呆的最常见的退行性疾病,即AD的病理生理过程。另外,有报导发现唐氏综合征的患者中APP表达升高。因此,研究参与调控APP代谢的机制对相关疾病的治疗研究具有一定价值[17]。目前关于AD的病理生理解释包括胆碱能假说、Aβ假说、tau蛋白假说和免疫假说[18]。其中主流的Aβ假说认为,APP代谢异常会导致Aβ的产生和清除失衡而导致Aβ过度沉积[2-3]。目前临床上对于AD的治疗策略包括乙酰胆碱酯酶抑制剂和NMDA受体拮抗剂[19],对于AD治疗策略的研究方向主要以Aβ和tau蛋白为靶点[18,20]。虽然目前尚未有利用survivin达到AD治疗效果的报导,但是,最近的一项研究发现,予转基因AD小鼠亚硒酸钠饮食,可上调Wnt/β-catenin信号通路并反式激活包括survivin在内的基因表达,同时可减少APP磷酸化从而减少APP裂解和Aβ形成[21],表明survivin在调节APP代谢中的潜在作用。本研究发现,survivin可以抑制APP在细胞内的表达,同时survivin可以抑制APP过表达所引起的细胞凋亡。本研究结果对未来suivivin参与AD治疗方面的研究提供了一定理论基础。
[1] KUMAR A, SINGH A, EKAVALI. A review on Alzheimer’s disease pathophysiology and its management: an update[J].Pharmacol Rep, 2015, 67(2): 195-203.
[2] SALOMONE S, CARACI F, LEGGIO G M, et al. New pharmacological strategies for treatment of Alzheimer’s disease: focus on disease modifying drugs[J]. Br J Clin Pharmacol, 2012, 73(4): 504-517.
[3] SCHENK D, BARBOUR R, DUNN W, et al. Immunization with amyloid-beta attenuates Alzheimer-disease-like pathology in the PDAPP mouse[J]. Nature, 1999, 400(6740): 173-177.
[4] BARATCHI S, KANWAR R K, KANWAR J R. Survivin:a target from brain cancer to neurodegenerative disease[J].Crit Rev Biochem Mol Biol, 2010, 45(6): 535-554.
[5] YAO L L, WANG Y G, CAI W J, et al. Survivin mediates the anti-apoptotic effect of delta-opioid receptor stimulation in cardiomyocytes[J]. J Cell Sci, 2007, 120(Pt 5): 895-907.
[6] 王会恩, 谷建琦. 生存素研究进展[J]. 中国医疗前沿, 2011,6(12): 13, 40.
[7] KOBAYASHI K, HATANO M, OTAKI M, et al. Expression of a murine homologue of the inhibitor of apoptosis protein is related to cell proliferation[J]. Proc Natl Acad Sci U S A,1999, 96(4): 1457-1462.
[8] TUMES D J, CONNOLLY A, DENT L A. Expression of survivin in lung eosinophils is associated with pathology in a mouse model of allergic asthma[J]. Int Immunol, 2009, 21(6): 633-644.
[9] JOHNSON E A, SVETLOV S I, WANG K K, et al. Cellspecific DNA fragmentation may be attenuated by a survivin-dependent mechanism after traumatic brain injury in rats[J]. Exp Brain Res, 2005, 167(1): 17-26.
[10] OZISIK K, OZISIK P, YILDIRIM E, et al. Expression of antiapoptotic survivin and aven genes in rat heart tissue after traumatic brain injury[J]. Transplant Proc, 2006, 38(9):2784-2787.
[11] KANWAR J R, SHEN W P, KANWAR R K, et al. Effects of survivin antagonists on growth of established tumors and B7-1 immunogene therapy[J]. J Natl Cancer Inst, 2001, 93(20): 1541-1552.
[12] SHI Z, LIANG Y J, CHEN Z S, et al. Overexpression of Survivin and XIAP in MDR cancer cells unrelated to P-glycoprotein[J]. Oncol Rep, 2007, 17(4): 969-976.
[13] 金晓昇, 安慧敏, 黄智铭. 生存素和P T E N在良恶性胃溃疡中的表达[J]. 温州医科大学学报, 2017, 47(6): 456-458.
[14] BARATCHI S, KANWAR R K, CHEUNG C H, et al. Proliferative and protective effects of SurR9-C84A on differentiated neural cells[J]. J Neuroimmunol, 2010, 227(1-2): 120-132.
[15] ZHANG Z, WANG H, JIN Z, et al. Downregulation of survivin regulates adult hippocampal neurogenesis and apoptosis, and inhibits spatial learning and memory following traumatic brain injury[J]. Neuroscience, 2015, 300: 219-228.
[16] YAN H, THOMAS J, LIU T, et al. Induction of melanoma cell apoptosis and inhibition of tumor growth using a cellpermeable Survivin antagonist[J]. Oncogene, 2006, 25(52):6968-6974.
[17] CORONEL R, BERNABEU-ZORNOZA A, PALMER C,et al. Role of amyloid precursor protein (APP) and its derivatives in the biology and cell fate specif i cation of neural stem cells[J]. Mol Neurobiol, 2018 .
[18] KURZ A, PERNECZKY R. Novel insights for the treatment of Alzheimer’s disease[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2011, 35(2): 373-379.
[19] SILVESTRELLI G, LANARI A, PARNETTI L, et al. Treatment of Alzheimer’s disease: from pharmacology to a better understanding of disease pathophysiology[J]. Mech Ageing Dev, 2006, 127(2): 148-157.
[20] ANAND R, GILL K D, MAHDI A A. Therapeutics of Alzheimer’s disease: Past, present and future[J]. Neuropharmacology, 2014, 76 Pt A: 27-50.
[21] JIN N, ZHU H, LIANG X, et al. Sodium selenate activated Wnt/β-catenin signaling and repressed amyloid-β formation in a triple transgenic mouse model of Alzheimer’s disease[J]. Exp Neurol, 2017, 297: 36-49.

