人巨细胞病毒UL138基因表达对胃癌细胞免疫相关功能的影响
叶乐乐,张佳丽,陈文静,沈贤,胡畅远,丁宁,薛向阳
(1.温州医科大学 微生物学与免疫学教研室 分子病毒与免疫研究所,浙江 温州 325035;2.温州医科大学 仁济学院,浙江 温州 325035;3.温州医科大学附属第一医院 胃肠外科,浙江 温州325015;4.温州医科大学附属第二医院育英儿童医院 胃肠外科,浙江 温州 325027)
UL138基因位于人巨细胞病毒(human cytomegalovirus,HCMV)ULb’区,与UL133、UL135及UL136等HCMV基因以多顺反子形式转录,编码的蛋白是一种多功能蛋白[1]。有研究发现,UL138基因是HCMV在人外周血单核细胞及CD34+髓系前体细胞内潜伏感染的建立与维持所必需的基因,其表达抑制单核细胞HCMV增殖,促进病毒潜伏,UL138基因缺失将损害HCMV潜伏状态的维持,为此,UL138被认为是HCMV潜伏相关基因[2-3]。我们前期的研究发现,UL138基因的表达不影响正常胃黏膜细胞的基本生物学特征,但却在胃癌细胞中扮演着抑癌基因的角色,通过封闭热休克蛋白70(heat shock protein 70,HSP70),可显著抑制胃癌细胞增殖,促进胃癌细胞凋亡[4],但UL138对肿瘤细胞免疫相关功能的影响尚不清楚。为此,本研究利用UL138重组质粒转染胃癌细胞BGC-823,通过转录组差异基因分析结合免疫原性细胞死亡相关标志检测,分析UL138基因表达对胃癌细胞免疫相关功能的影响。
1 材料和方法
1.1 材料
1.1.1 质粒和细胞株:pcDNA3.1-flag/UL138重组质粒由本实验室构建并长期保存于-80 ℃冰箱。胃癌细胞BGC-823购自中国科学院细胞库/干细胞库。
1.1.2 主要试剂、工具酶和抗体:脂质体LipofectamineTM2000购自美国Life Technology公司;FBS、1640培养基购自美国Gibco公司;Trizol试剂购自美国Invitrogen公司;质粒大量抽提试剂盒购自美国OMEGA公司;RealMaster Mix试剂盒、ReverTra Ace反转录试剂盒购自日本Toyobo公司;细胞因子定量PCR检测试剂购自常州楚天生物科技有限公司;Flag抗体购自美国Sigma公司;FITC标记的羊抗兔抗体购自杭州联科生物技术股份有限公司;GAPDH抗体购自杭州贤至生物科技有限公司;HSP70抗体购自武汉Proteintech公司;ERp57抗体购自美国CST公司。
1.2 方法
1.2.1 重组质粒转染胃癌细胞:将胃癌细胞接种于六孔板,待细胞生长至底面积的70%~80%时,将2 μg每孔的pcDNA3.1-flag/UL138重组质粒转染胃癌细胞,操作按LipofectamineTM2000产品说明书进行,同时设空载质粒pcDNA3.1作为阴性对照组。
1.2.2 Western blot法:收集转染后的胃癌细胞,PBS洗涤2次,于冰上加入含有蛋白酶抑制剂的细胞裂解液(PMSF∶RIPA 1∶100)裂解10 min,加入loading buffer后沸水煮沸10 min,于-80 ℃冰箱保存待用。样品经SDS-PAGE胶分离后并转移至PVDF膜,37 ℃下5%的脱脂牛奶封闭1.5 h,分别加入一抗(兔抗GAPDH 1∶1000、兔抗Flag标签抗体1∶1000、兔抗HSP701∶5000、兔抗ERp571∶1000)4 ℃孵育过夜。TBST洗涤5次,5 min/次。于37 ℃加入二抗(羊抗兔1∶5000),摇床室温孵育2 h,TBST洗涤5次,5 min/次。PVDF膜加入ECL显色液后于GelDoc2000仪器显色并拍照。
1.2.3 细胞免疫荧光:将转染后的胃癌细胞弃去原有培养液,预冷的PBS洗涤3次,5 min/次。加入4%多聚甲醛37 ℃孵育10 min,PBS洗涤3次,5 min/次。再经0.3% Triton X-100室温下处理10 min,弃液并PBS洗涤3次,5 min/次。于37 ℃下5%山羊血清封闭1 h,兔抗Flag抗体(1∶800)4 ℃孵育过夜,PBS洗涤3次,5 min/次。FITC标记的羊抗兔抗体孵育1.5 h,加入1 μg/mL DAPI室温下染色10 min,PBS洗涤3次,5 min/次。加入抗荧光猝灭剂并于荧光显微镜下观察并拍照。
1.2.4UL138表达对胃癌细胞转录组的影响:参照Trizol试剂使用说明书,提取UL138重组质粒及对照质粒转染后的胃癌细胞总RNA,使用DNA去除试剂盒去除DNA污染并进行基因芯片的分析。按照P<0.05,Fold change≥2确定差异表达基因。通过Metacore网站(https∶//portal.genego.com/),分别进行Maps和Diseases分析,在各功能下载入UL138重组质粒及对照质粒转染胃癌细胞后2组间的差异基因,按需求进行相应选项分析。
1.2.5 候选差异表达基因验证:选择部分差异表达的趋化因子及趋化因子受体进行RT-PCR验证。参照ReverTra Ace反转录试剂盒说明书进行操作,产物于-20 ℃保存。RT-PCR条件为:95 ℃ 2 min,95 ℃15 s,60 ℃ 1 min,40 cycles。每个基因设立3个复孔,以GAPDH为内参,以Fold change分析。
1.3 统计学处理方法 采用SPSS22.0软件进行统计学分析。计量资料以±s表示,2组间比较采用配对t检验。P<0.05为差异有统计学意义。

图1 UL138重组质粒转染胃癌细胞及蛋白表达
2 结果
2.1UL138重组质粒转染胃癌细胞及蛋白表达的验证 以本实验室保存的HCMV分离株为模板,含flag标签的UL138全长基因正向引物及反向引物扩增UL138基因,经限制性内切酶双酶切载体pcDNA3.1后,将PCR产物克隆至pcDNA3.1质粒中,琼脂糖凝胶电泳及测序结果表明成功构建了含有UL138基因的重组质粒(见图1A)。将pcDNA3.1(+)-flag/UL138重组质粒转染胃癌细胞24 h后,收集胃癌细胞的总蛋白,使用flag标签抗体进行Western blot验证,结果显示,重组质粒转染的胃癌细胞能够表达UL138蛋白,不含目的基因的对照质粒未检测到UL138蛋白表达(见图1B)。此外,免疫荧光显示UL138蛋白主要表达于胃癌细胞的胞浆中(见图1C)。
2.2UL138基因表达对胃癌细胞基因表达谱的影响
基因芯片差异基因分析显示,UL138表达的胃癌细胞较对照组中存在576个基因差异表达(P<0.05,Fold change>2),其中370个表达上调,206个表达下调。生物信息学分析显示UL138蛋白的表达参与细胞骨架重构WNT途径和细胞骨架重构、免疫反应IL-1信号通路、免疫反应IL-8信号通路、细胞黏附纤维蛋白溶酶信号途径、免疫反应IL-5 JAK/STAT信号途径、肿瘤组织因子表达靶位信号途径、细胞黏附和趋化因子、免疫应答的MIF介导的激素调控、关节炎中PDE4细胞趋化因子途径、狼疮性肾炎肾小管间质损伤等通路(见图2)。
2.3UL138基因表达对胃癌细胞免疫相关分子的影
响 生物信息学分析显示UL138蛋白的表达与消化系统疾病相关(见图3)。基因芯片分析显示,UL138表达上调免疫相关分子IL1A、IL6、IL11、IL8、IL1RL1、IL7R、IL13RA2、CCL3L1、CCL5、TNFAIP3、TNFRSF21、VEGFA、CD44、CD55、CD59、CD274基因表达,下调CXCL10及IFNAR1基因表达。选择与炎症相关的部分基因进行验证,结果显示,定量PCR结果与基因芯片检测结果相符(见图4)。

图2 Maps分析UL138在胃癌细胞中的表达参与的信号通路
图3 Diseases分析与UL138表达相关的疾病

图4 不同方法验证UL138表达对胃癌细胞免疫相关分子表达的影响
2.4UL138基因表达对胃癌细胞免疫原性死亡相关蛋白的影响 将pcDNA3.1-flag/UL138质粒转染胃癌细胞18、24 h后,通过Western blot验证ERp57、HSP70蛋白表达,结果显示,UL138在胃癌细胞中表达18、24 h后,ERp57蛋白表达量增加(P<0.01),而HSP70蛋白表达量差异无统计学意义(P>0.05),见图5。
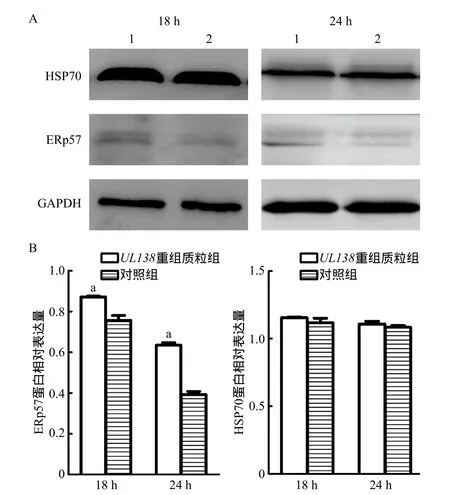
图5 UL138表达对免疫原性死亡相关蛋白的影响
3 讨论
UL138是HCMV基因组ULb’区中一个基因[5],其编码的蛋白是一种高尔基体定位的多功能蛋白[1]。我们前期的研究发现,UL138基因是一个新的病毒源性抑癌基因,具有抑制肿瘤生长并促进胃癌细胞凋亡的作用[6]。与癌旁正常胃黏膜组织比较,HCMV阳性的胃癌组织UL138表达水平明显降低,尤其是在低分化胃癌组织。
已经明确细胞死亡存在凋亡、坏死、自噬性细胞死亡、二次坏死、有丝分裂灾难等多种方式[7]。其中坏死、自噬性细胞死亡及部分的凋亡过程可改变细胞表面免疫分子表达并分泌炎症相关的细胞因子,促进炎症反应[8]。为分析UL138诱导胃癌细胞过程免疫相关功能变化,本研究通过基因芯片分析UL138表达的胃癌细胞基因表达谱,结果发现,UL138基因表达对IL1、IL8等免疫相关信号通路及细胞骨架重构等通路产生影响,IL1A、IL6、IL8、IL11等促炎因子表达上调。这些结果提示,UL138诱导胃癌细胞过程可促进炎症。既往的研究已经明确,IL6及其他趋化因子的上调表达,与肿瘤细胞转移等恶性表型相关[9-12],表明UL138表达明显影响胃癌细胞免疫相关功能,但UL138对胃癌细胞的这些影响是否促进恶性表型,有待于进一步研究。
有研究提示,在某些诱导因素存在下,肿瘤细胞可出现免疫原性死亡(immunogenic cell death,ICD)的特征,能激发机体免疫细胞对肿瘤细胞的识别与攻击[13]。ICD的细胞表面高表达钙网蛋白、热休克蛋白、高迁移率族迁徙族蛋白B1等特征性的蛋白分子[14-18]。为此,我们进一步评价UL138表达对胃癌细胞ICD的影响,结果显示,UL138表达尽管不改变HSP70表达,但刺激胃癌细胞在短时间内表达与免疫原性死亡相关的蛋白(ERp57)。有研究表明,ERp57影响CRT从内质网转至细胞膜,敲除ERp57后,肿瘤细胞死亡过程中CRT不能向细胞膜表面转移[13],从而控制细胞的免疫原性。此外,与对照组比较发现,UL138可明显诱导胃癌细胞IL1A、IL6、IL11、IL1RL1、IL7R、IL13RA2、CCL3L1、CCL5、TNFAIP3、TNFRSF21、VEGFA、CD44、CD55、CD59、CD274等免疫相关因子基因表达上调。提示,这些促炎细胞因子将提高树突状细胞对肿瘤抗原的识别和提呈的能力,促进肿瘤特异性细胞毒T细胞对肿瘤的攻击,增强抗肿瘤的作用[7,19]。
综上,UL138不但可诱导肿瘤细胞凋亡,发挥抑癌作用,还可通过改变肿瘤细胞免疫相关分子表达,进而激发机体免疫细胞对肿瘤细胞的识别与攻击。
[1] PETRUCELLI A, UMASHANKAR M, ZAGALLO P, et al.Interactions between proteins encoded within the human cytomegalovirus UL133-UL138 locus[J]. J Virol, 2012, 86(16):8653-8662.
[2] GOODRUM F, REEVES M, SINCLAIR J, et al. Human cytomegalovirus sequences expressed in latently infected individuals promote a latent infection in vitro[J]. Blood, 2007,110(3): 937-945.
[3] UMASHANKAR M, PETRUCELLI A, CICCHINI L, et al.A novel human cytomegalovirus locus modulates cell typespecif i c outcomes of infection[J]. PLoS Pathog, 2011, 7(12):e1002444.
[4] CHEN W, LIN K, ZHANG L, et al. The cytomegalovirus protein UL138 induces apoptosis of gastric cancer cells by binding to heat shock protein 70[J]. Oncotarget, 2016, 7(5):5630-5645.
[5] LANDOLFO S, GARIGLIO M, GRIBAUDO G, et al. The human cytomegalovirus[J]. Pharmacol Ther, 2003, 98(3):269-297.
[6] CHEN W, LIN K, ZHANG L, et al. The cytomegalovirus protein UL138 induces apoptosis of gastric cancer cells by binding to heat shock protein 70[J]. Oncotarget, 2016, 7(5):5630-5645.
[7] GREEN D R, FERGUSON T, ZITVOGEL L, et al. Immunogenic and tolerogenic cell death[J]. Nat Rev Immunol,2009, 9(5): 353-363.
[8] GREEN D R. The end and after: how dying cells impact the living organism[J]. Immunity, 2011, 35(4): 441-444.
[9] EL-SERAG H B, RUDOLPH K L. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132(7): 2557-2576.
[10] BOLLRATH J, PHESSE T J, VON B V A, et al. gp130-mediated Stat3 activation in enterocytes regulates cell survival and cell-cycle progression during colitis-associated tumorigenesis[J]. Cancer Cell, 2009, 15(2): 91-102.
[11] GRETEN F R, ECKMANN L, GRETEN T F, et al. IKKbeta links inf l ammation and tumorigenesis in a mouse model of colitis-associated cancer[J]. Cell, 2004, 118(3): 285-296.
[12] THIEM S, PIERCE T P, PALMIERI M, et al. mTORC1 inhibition restricts inf l ammation-associated gastrointestinal tumorigenesis in mice[J]. J Clin Invest, 2013, 123(2): 767-781.
[13] 王清, 王艳林. 肿瘤细胞免疫原性死亡相关分子的研究进展[J]. 细胞与分子免疫学杂志, 2013, 29(1): 109-111.
[14] YANG Y, LI X J, CHEN Z, et al. Wogonin induced calreticulin/annexin A1 exposure dictates the immunogenicity of cancer cells in a PERK/AKT dependent manner[J]. PLoS One, 2012, 7(12): e50811.
[15] KEPP O, TESNIERE A, SCHLEMMER F, et al. Immunogenic cell death modalities and their impact on cancer treatment[J]. Apoptosis, 2009, 14(4): 364-375.
[16] DE BRUYN M, WIERSMA V R, HELFRICH W, et al. The ever-expanding immunomodulatory role of calreticulin in cancer immunity[J]. Front Oncol, 2015, 5: 35.
[17] ARDELT P U, KNEITZ B, ADAM P, et al. Reactive antibodies against bacillus Calmette-Guerin heat-shock protein-65 potentially predict the outcome of immunotherapy for high-grade transitional cell carcinoma of the bladder[J].Cancer, 2010, 116(3): 600-609.
[18] 张峻岭, 李卫泊, 李冬斌, 等. 肿瘤细胞免疫原性死亡中特征性表达抗原在抗瘤免疫应答中的作用[J]. 免疫学杂志,2010, 26(8): 730-734.
[19] OBEID M, TESNIERE A, GHIRINGHELLI F, et al. Calreticulin exposure dictates the immunogenicity of cancer cell death[J]. Nat Med, 2007, 13(1): 54-61.

