芽孢杆菌S6内切葡聚糖酶基因的克隆及功能鉴定
, , ,
(济南大学 生物科学与技术学院, 山东 济南 250022)
目前被广泛应用的生防菌主要为芽孢杆菌,种类有枯草芽孢杆菌(Bacillussubtilis)[1-2]、多粘芽孢杆菌(Bacilluspolymyxa)[3]、巨大芽孢杆菌(Bacillusmegaterium)、地衣芽孢杆菌(Bacilluslicheniformis)[4]、苏云金芽孢杆菌(Bacillusthuringiensis)[5]、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)[6-7]、蜡样芽孢杆菌(Bacilluscereus)等[8],其中,生防芽孢杆菌抑制病害的机理主要为拮抗作用[9-10]。人们已从拮抗菌中提取出了多种抗菌物质, 有小分子的抗生素、蛋白性的抗菌物质、多肽抗生素以及次生代谢产生的抗菌物质等[11]。
真菌的细胞壁主要由葡聚糖和几丁质构成, 葡聚糖酶和几丁质酶共同作用,可以破坏真菌菌丝体顶端细胞壁,使菌丝体顶端膨胀、破碎,最终死亡[12]。根据葡聚糖酶作用于糖苷键位点的不同,可分为β-1, 2、β-1, 3、β-1, 4、β-1, 6-葡聚糖酶。葡聚糖水解作用是由上述多种葡聚糖酶共同作用的结果。魏艳丽[13]等从巨大芽孢杆菌AP25中克隆了内切葡聚糖酶编码基因。本文中以自行分离筛选得到的能够产生β-1, 4-内切葡聚糖酶基因(glu)的天然芽孢杆菌S6为出发菌株,进行glu的克隆和序列分析,并在大肠杆菌(Escherichiacoli,E.coli)中进行表达,为开发高效的拮抗新产品提供理论依据和应用基础。
1 材料与方法
1.1 菌株和载体
菌株:BacillussubtilisS6,本实验室自主筛选;E.coliJM110和E.coliBL-21,本实验室保存;
载体:pGEM-T载体体系(带有氨苄抗性),天根生化科技(北京)有限公司;pET-21b(带有氨苄抗性),本实验室保存。
1.2 培养基及主要试剂
大肠杆菌液体培养基: 酵母粉5 g, 胰蛋白胨10 g, 氯化钠10 g, 定容至1 000 mL, pH=7.0, 121 ℃高压蒸汽灭菌20 min。
羧甲基纤维素培养基:羧甲基纤维素10 g,磷酸氢二钾 1.87 g,柠檬酸1.252 g,琼脂粉10~15 g,定容至1 000 mL,pH=7.0,121 ℃ 高压蒸汽灭菌20 min。
琼脂糖凝胶电泳: 称取0.8 g琼脂糖, 溶于100 mL电泳缓冲液, 混匀,微波炉加热煮沸至琼脂糖全部溶解。
限制性内切酶、 T4脱氧核糖核酸(DNA)连接酶,宝生物工程有限公司; 聚合酶链式反应试剂,南京诺唯赞生物科技有限公司; 氨苄青霉素,国药化学试剂公司; DNA分子量标记物,北京博迈德公司; 蛋白分子量标记物,北京天为时代公司; 回收试剂盒和β-半乳糖苷酶的显色底物,Promega公司;异丙基-β-D-硫代半乳糖苷,Fermentas公司。引物合成、测序工作,由北京擎科新业生物技术有限公司完成;其余实验所用试剂均为分析纯。
1.3 芽孢杆菌S6内切葡聚糖酶基因的聚合酶链式反应扩增
以芽孢杆菌S6基因组为模板,根据基因序列数据库(GenBank)登陆的β-1, 4-内切葡聚糖酶基因(登录号为AP009484.1、 CP001982.1、 AE017355.1)同源性序列,设计聚合酶链式反应(PCR)引物为上游序列(S-GLU-S02):5’-ATGAAACGGTCAATCTCTAT-3’;下游序列(S-GLU-A02):5’-CTAATTTGGTTCTGTTCCCC-3’。PCR反应程序如下:94 ℃预变性10 min,94 ℃变性60 s,48 ℃退火45 s,72 ℃延伸90 s,循环次数为35;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳分离,使用北京博迈德琼脂糖凝胶DNA回收试剂盒回收DNA片段。
1.4 芽孢杆菌S6内切葡聚糖酶基因序列的测定和分析
将琼脂糖凝胶电泳回收产物与pGEM-T Easy载体连接,转化E.coliJM110感受态细胞,筛选阳性转化子进行测序。用SignalP3.0 Server 和TMHMM2.0在线软件对基因序列及氨基酸序列进行序列分析。
1.5 芽孢杆菌S6内切葡聚糖酶基因原核表达
以重组质粒为模板,根据测序所得序列设计引物为上游序列(S-GLU-S03):5’-GAATTCGCATATGAAACGGTC-3’;下游序列(S-GLU-A03): 5’-CACCAAAGCTTCTAATTTGG-3’。将纯化后的PCR产物和表达载体pET-21b分别用NdeI和HindIII双酶切后进行连接与转化入表达菌株E.coliBL21中, 挑取单菌落37 ℃培养至光密度(optical density,OD)值为0.6左右, 加入诱导剂异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)至终质量浓度为100 mg/L, 37 ℃培养3 h,收集菌体、裂解,以未诱导的菌体裂解液做对照,聚丙烯酰胺凝胶电泳分析内切葡聚糖酶基因的表达。
1.6 芽孢杆菌S6内切葡聚糖酶基因功能鉴定
将转入pET-21b-glu质粒的BL-21菌株经诱导后点接在羧甲基纤维素固体培养基,37 ℃培养约2 h;在平板中加入1 mL(质量浓度为1 g/L)的刚果红溶液染色20 min,倒去染色液并用氢氧化钠NaOH(浓度为1 mol/L)溶液冲洗,去掉表面附着的刚果红,观察是否出现透明水解圈。
2 结果与分析
2.1 芽孢杆菌S6内切葡聚糖酶基因的PCR扩增
以芽孢杆菌S6基因组DNA为模板进行PCR扩增,PCR产物经琼脂糖凝胶电泳检测,获得大小约1 500 bp的条带(见图1),与预期的内切葡聚糖酶基因大小一致。

M为200 bp蛋白分子量标记物;1为PCR产物。图1 聚合酶链式反应(PCR)扩增芽孢杆菌S6基因组上的glu基因
2.2 芽孢杆菌S6内切葡聚糖酶基因序列的测定和分析
PCR产物经过T载体克隆后验证并测序,测序结果分析得到1 500 bp含有完整阅读框的基因序列,经过比对分析,初步确定该序列为内切葡聚糖酶基因全长序列,并于GenBank上注册,GenBank登录号为HQ650233。
分别将1 500 bp阅读框架及其编码产物在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)中进行核苷酸序列比对(见表1)和氨基酸序列比对(见表2)。芽孢杆菌S6内切葡聚糖酶基因与Bacilluslicheniformiscellulase内切葡聚糖酶基因具有98%相似,而与不同属的PaenibacilluspolymyxaCel5A的仅有69%的一致性。说明内切葡聚糖酶基因在同属菌株中序列相似性很高,进化保守;而不同属间的相似性低,进化趋异。
2.3 芽孢杆菌S6内切葡聚糖酶二级结构分析
用SignalP3.0 Server在线软件对芽孢杆菌S6内切葡聚糖酶氨基酸序列中的信号肽序列进行了分析, 结果如图2所示。 用TMHMM2.0在线软件对芽孢杆菌S6glu氨基酸序列中可能的跨膜区段进行了分析,结果如图3所示。 芽孢杆菌S6内切葡聚糖酶氨基酸序列第1—29氨基酸具有明显的信号肽序列信号, 蛋白的成熟位点在第29、 30的氨基酸残基之间, 第1—30氨基酸为跨膜螺旋信号, 初步推测第1—30个氨基酸序列是芽孢杆菌S6glu的信号肽序列。

表1 芽孢杆菌S6 β-1, 4-内切葡聚糖酶基因的序列对比分析结果
表2 芽孢杆菌S6 β-1, 4-内切葡聚糖酶的序列对比分析结果
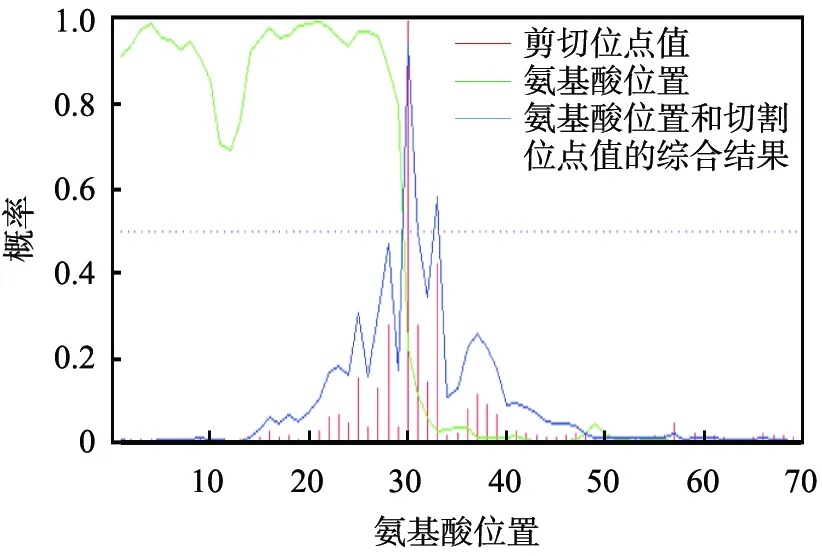
图2 芽孢杆菌S6 glu 信号肽序列分析结果

图3 芽孢杆菌S6 glu跨膜螺旋信号分析结果
2.4 芽孢杆菌S6内切葡聚糖酶基因原核表达
将构建好的表达载体进行NdeⅠ和EcoRⅠ酶切验证,琼脂糖凝胶电泳检测得到大小约为1 500 bp的条带,与预期的酶切条带大小相符(见图4)。将该重组质粒进一步测序,通过测序结果得知构建完成pET-21b-glu表达载体,同时拥有正确的阅读框。将含有pET-21b-glu重组质粒的E.coliBL21菌株,经过IPTG诱导之后,以未诱导的E.coliBL21菌株作为对照,通过聚丙烯酰氨凝胶电泳,发现在分子量约50 ku处有明显的表达条带,是内切葡聚糖酶基因蛋白表达的产物,对照在该位置未出现明显的表达条带(见图5),表明了表达载体pET-21b-glu在E.coliBL21菌株中成功表达。
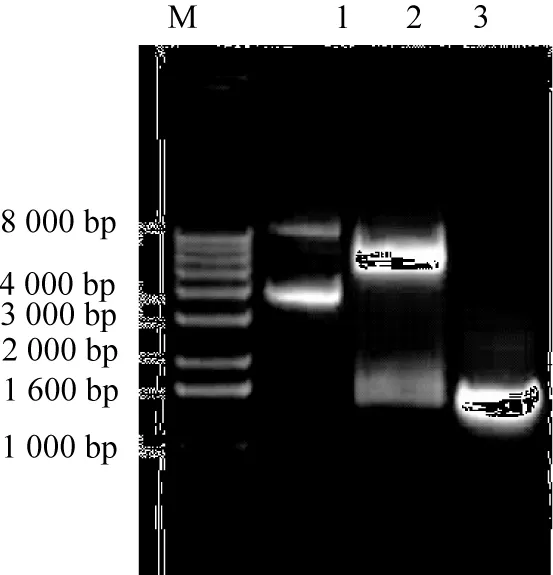
M为1 kb蛋白分子量标记物;1为pET-21b-glu质粒;2为NdeⅠ、Hind Ⅲ双酶切质粒pET-21b-glu;3为菌落PCR。图4 pET-21b-glu质粒双酶切与聚合酶链式反应(PCR)电泳结果

M为即时可用的蛋白质分子量标记物MW,ku;1—3为GLU诱导表达;4—5为对照。图5 聚丙烯酰氨凝胶电泳检测
2.5 芽孢杆菌S6内切葡聚糖酶基因功能的鉴定
将转入pET-21b-glu质粒的BL-21菌株经诱导后点接在羧甲基纤维素固体培养基上,培养2 h,经刚果红染色,观察到该菌株产生明显的内切葡聚糖酶水解圈,见图6。

图6 β-1, 4-内切葡聚糖酶活检测
3 结果与讨论
芽孢杆菌S6是本实验室从采集自中国农业科学院植物保护研究所黄萎病、 枯萎病发病较轻的试验棉田的根围土中分离出的, 是一种对棉花黄萎病、 枯萎病病菌具有明显拮抗作用的芽孢杆菌。 用同源克隆的方法获得了芽孢杆菌S6的β-1, 4-内切葡聚糖酶基因。 基因序列分析该基因读码框为1 500 bp, 编码499个氨基酸。陈惠等[14]将外源的内切葡聚糖酶基因转入巨大芽孢杆菌WH320中,获得有效表达。本文中首次从本实验室具有自主知识产权的高效拮抗菌芽孢杆菌S6中获得β-1, 4-内切葡聚糖酶基因。
真菌细胞壁主要由葡聚糖和几丁质构成,根据葡聚糖酶作用于葡聚糖的位点不同,可以将葡聚糖酶分为β-1, 3-葡聚糖酶、β-1, 4-葡聚糖酶等。葡聚糖酶和几丁质酶共同作用,可以破坏真菌菌丝体顶端细胞壁,使菌丝体顶端膨胀、破碎,最终使病原菌生长受阻或细胞死亡,阻止病害的发生和发展。Hong等[15]报道,一株类芽孢杆菌产生的β-1, 3-葡聚糖酶能破坏植物病原真菌瓜果腐霉菌和立枯丝核菌的细胞壁结构。 本文中从芽孢杆菌S6中克隆得到的内切葡聚糖酶基因为与枯草芽孢杆菌C-36的β-1, 4-葡聚糖酶的基因具有99%的相似性。 通过构建原核表达载体, 将其转入表达宿主大肠杆菌BL-21中进行glu原核表达检测, 发现芽孢杆菌S6的β-1, 4-葡聚糖酶基因表达产物为分子量约50 ku的蛋白。 通过对β-1, 4-内切葡聚糖酶活性进行检测,发现芽孢杆菌S6的β-1, 4-葡聚糖酶基因在大肠杆菌中实现表达并且具有显著的酶活性。目前,正在进行几丁质酶基因的克隆,将几丁质酶基因和β-1, 4-葡聚糖酶基因共同构建植物表达载体,并转染作物,以期获得多功能的抗性植株。

