右美托咪定对大鼠离体心脏缺血再灌注损伤心肌组织炎症反应和氧化应激损伤的影响
任国强 陈 萍 于金贵
(山东大学齐鲁医院麻醉科山东省精神卫生中心,山东 济南 250014)
近年来,急性心肌梗死的发病人数和年龄有着明显升高和年轻化的趋势〔1,2〕。目前,心肌血运重建术是临床上急性心肌梗死治疗的主要手段,而缺血再灌注损伤(I/R)是影响治疗过程中常见生理病理因素。右美托咪定(Dex)是一种在血管疾病围术期起到麻醉和镇痛作用的常用药物。已有大量文献证实,Dex对I/R有一定的改善作用,但其具体的作用机制尚不明确〔3~6〕。本研究从炎症和氧化应激反应出发,探讨Dex改善I/R的相关机制。
1 材料与方法
1.1实验材料 健康SPF级雄性SD大鼠30只,体质量220~250 g,购于昆明医科大学实验动物中心,Dex购于江苏恒瑞医药有限公司。超氧化物歧化酶(SOD)、丙二醛(MDA)、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6试剂盒和二喹啉甲酸(BCA)蛋白检测试剂盒购于杭州四季青公司。放射免疫沉淀法(RIPA)蛋白裂解液、逆转录试剂盒和总RNA提取试剂盒购于碧云天生物技术研究所,核转录因子(NF)-κB p65和血红素加氧酶(HO)-1蛋白、β肌动蛋白(β-actin)和辣根过氧化物酶(HRP)标记的二抗购于美国Santa Cruz公司。K-H灌流液配方参照郑凌云等〔7〕研究。Langendorff灌流系统和张力换能器连接多道生理信号采集系统购于成都仪器厂。
1.2方法
1.2.1大鼠实验分组及离体心脏I/R模型的制备 实验分组:将30只大鼠随机分为对照组、I/R组、Dex-M组(2.3 ng/ml),每组10只。对照组大鼠在心脏离体平稳30 min后,持续灌注150 min,I/R组、Dex-L组、Dex-M组和右美托咪定-H组大鼠均在心脏离体平稳30 min后,停罐30 min,再灌注120 min。离体心脏I/R模型制备:将大鼠以10%水合氯醛进行腹部麻醉后,迅速取出心脏,主动脉插管后,将心脏固定在Langendoff灌流装置上。常温下,以含5%CO2和95%O2的K-H溶液进行恒温恒压灌流,连通生理信号采集处理系统,心脏稳定30 min后,在心肌张力和心率恢复正常时,停灌30 min,根据实验分组进行加药,灌注120 min。记录并收集心功能心率(HR)、左心室舒张压(LVDEP)、冠脉流量(CF)、室内压最大上升速率(+dp/dtmax)和室内压最大下降速率(-dp/dtmax)等指标。
1.2.2心肌组织中炎症因子和氧化应激指标的测定 在灌流结束后,收集各组大鼠的心肌组织,于4℃下制成匀浆(浓度10%),离心取上清液,根据试剂盒操作步骤测定各组大鼠心肌组织中TNF-α、IL-6、MDA含量及SOD活性。每组重复检测3次。
1.2.3心肌组织中NF-κB p65和HO-1蛋白的测定 灌流结束后,将各组大鼠心肌组织剪碎后,加入蛋白裂解液提取总蛋白,并采用BCA试剂盒检测其浓度。将蛋白样品与loading buffer混匀后,置于100℃水浴中变性。将蛋白样品60 μg滴加到十二烷基硫酸钠聚丙烯酰胺凝胶孔中,开始以70 V电压,后改用90 V电压电泳分离。待电泳结束后,以250 mA的电流将蛋白样品转至聚偏二氟乙烯膜上,再置于含有脱脂奶粉的封闭液中处理2 h。于4℃下加入一抗(NF-κB p65、HO-1和β-actin)反应过夜。次日,以封闭液洗涤后,室温下加入二抗反应1 h。洗涤后,于避光条件下,加入电化学试剂显色,以凝胶成像系统采集图片,图像软件分析各目的蛋白的表达水平。每组实验重复3次。
1.2.4心肌组织中NF-κB p65和HO-1 mRNA的测定 在灌流结束后,收集各组大鼠的心肌组织,剪碎,以总RNA提取试剂盒提取总RNA,并参照逆转录试剂盒合成DNA。将20 μl反应体系按照设定的扩增条件上PCR仪,以β-actin作内参,2-△△Ct法测定NF-κB p65和HO-1 mRNA的相对表达水平。扩增条件: 94℃ 预变性5 min,95℃变性15 s,56℃退火15 s,72℃ 延伸30 s,32个循环。β-actin上游引物为5′-GGACCTGACTGACTACC-TC-3′,下游引物为5′-TACTCCTGCTTGCTGAT-3′。其中NF-κB p65上游引物为5′-CGGGATGGCTACTATGAGGCTGAC-3′,下游引物为5′-GATTCGCTGGCTAATGGCTTGC-T-3′;HO-1上游引物为5′-TCCGATGGGTCCTTACACTC-3′,下游引物为5′-AAGGAAGCCAGCCAAGAGA-3′。
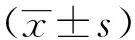
2 结 果
2.1Dex对心功能的影响 与对照组相比,I/R组中HR、CF、+dp/dtmax和-dp/dtmax指标均明显降低,LVDEP指标明显升高,心功能减弱;在I/R基础上给予Dex后,HR、CF、+dp/dtmax和-dp/dtmax指标明显升高,而LVDEP指标明显降低,心功能有所改善。差异具有统计学意义(P<0.05)。见表1。
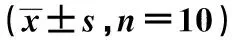
表1 Dex对心功能的影响
与对照组相比:1)P<0.05;与I/R组相比:2)P<0.05;下表同
2.2Dex对心肌组织中炎症反应的影响 与对照组相比,I/R组和Dex组大鼠心肌组织中IL-6和TNF-α含量均明显升高,但Dex组中两种因子的含量又明显低于I/R组,差异均有统计学意义(P<0.05)。表明Dex明显改善大鼠离体心脏I/R损伤引起的炎症反应。见表2。
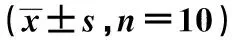
表2 Dex对心肌组织中IL-6、TNF-α含量及SOD活性和MDA含量的影响
2.3Dex对心肌组织氧化应激反应的影响 与对照组比较,I/R组和Dex组大鼠心肌组织中SOD活性均明显降低,而MDA含量均明显升高;与I/R组相比,Dex组中SOD活性升高,而MDA含量下降。提示Dex明显改善大鼠离体心脏I/R损伤引起的氧化应激损伤,差异均有统计学意义(P<0.05)。见表2。
2.4Dex对心肌组织中NF-κB p65和HO-1蛋白的影响 与对照组相比,I/R组和Dex组中NF-κB p65和HO-1蛋白的表达水平均明显升高;Dex组中NF-κB p65的表达水平下降,而HO-1蛋白的表达升高,与I/R组相比,差异有统计学意义(P<0.05)。见图1、表3。
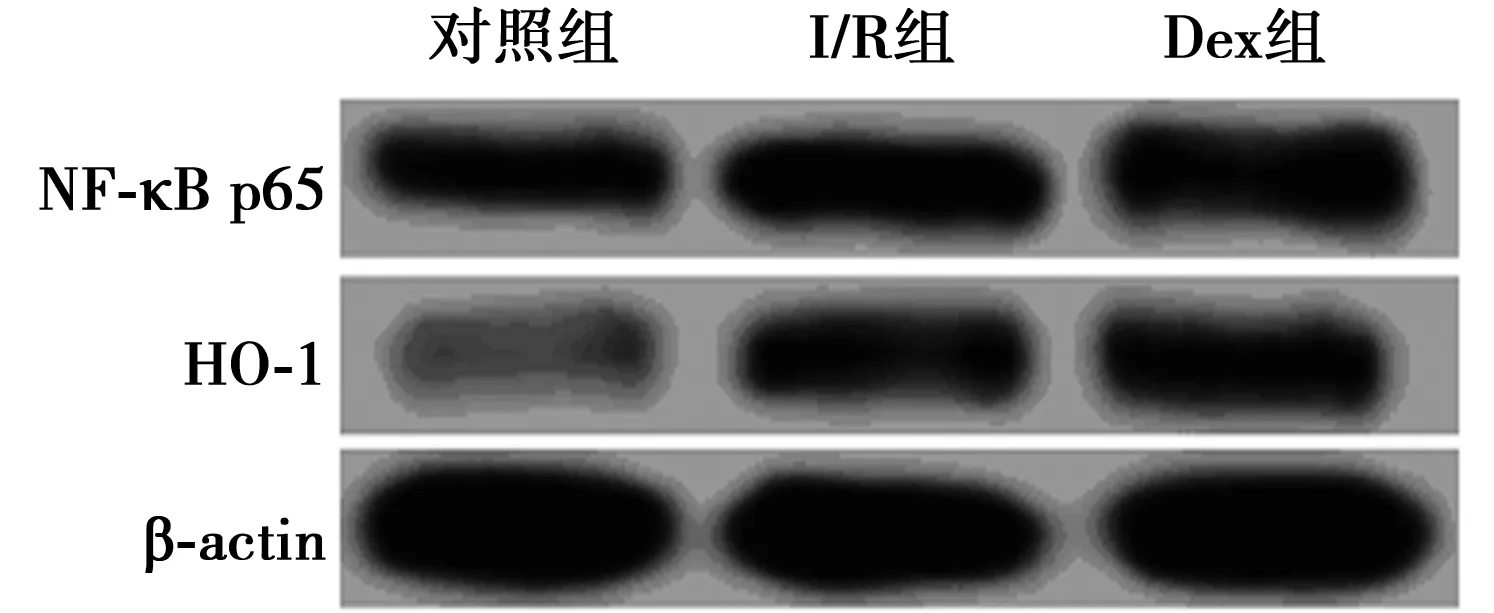
图1 Western印迹法检测结果
2.5Dex对心肌组织中NF-κB p65和HO-1 mRNA表达的影响 RT-PCR检测各组大鼠心肌组织中NF-κB p65和HO-1 mRNA的表达。I/R组和Dex组中NF-κB p65和HO-1 mRNA的表达水平均明显升高,与对照组相比,差异有统计学意义(P<0.05);与I/R组相比,Dex组中NF-κB p65 mRNA的表达水平下降,而HO-1 mRNA的表达升高,差异有统计学意义(P<0.05)。见表3。
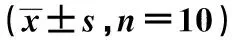
表3 各组大鼠心肌组织中NF-κB p65和HO-1蛋白及mRNA的相对表达量
3 讨 论
I/R是影响急性心肌梗死治疗的重要因素。HR、LVDEP、CF、+dp/dtmax和-dp/dtmax指标的改变是反映I/R的重要表现。本研究发现,与对照组相比,I/R组和Dex组中HR、CF、-dp/dtmax和-dp/dtmax指标降低,LVDEP指标升高,表明I/R模型构建成功。同时,与I/R组相比,Dex组中HR、CF、+dp/dtmax和-dp/dtmax指标升高,LVDEP指标下降。表明Dex可以改善离体心脏I/R。这一结果与陈雪君等〔8〕得到Dex后处理能够改善缺血再灌注左心室功能,减轻心肌缺血再灌注损伤的结论相吻合。
心肌I/R是一个复杂的过程,炎症和氧化应激是其形成和发展的重要机制〔9,10〕。TNF-α是机体受到刺激后,发挥关键始动作用、激活细胞因子级联反应的重要物质,反映了炎症反应的程度;IL-6是由巨噬细胞、T细胞和单核细胞等产生,反映组织损伤早期情况的物质,两者均在炎症反应中起促进作用,是常用的炎症检测指标。MDA是脂质过氧化反应过程中产生的一种具有生物毒性的代谢产物,可反映自由基的损伤程度;SOD是一种具有清除自由基功能的抗氧化酶,可反映机体清除氧自由基的能力;两者是常用的氧化应激指标。张玉辉等〔11〕研究指出,Dex通过抑制促炎因子TNF-α和IL-6的释放,减轻了心脏瓣膜置换术患者心肌缺血再灌注引起的损伤。Zeng等〔12〕发现,在糖尿病大鼠短暂脑缺血再灌注诱导的氧化应激和炎症反应中,Dex可通过下调MDA、NOX2、TNF-α和IL-6等减弱氧化应激和炎症反应。本研究结果发现,在I/R基础上,给予Dex处理后,心肌组织中IL-6、TNF-α和MDA含量下降,而SOD活性升高。表明Dex能够减轻离体心脏缺血再灌注损伤中的炎症反应和氧化应激损伤。
NF-κB是炎症反应的重要转录因子,在调控活性氧、炎性因子和细胞因子等的产生和分泌过程中扮演着重要角色〔13〕。HO-1是一种血红素降解的限速酶,在阻止炎症过程和氧化性组织损伤中发挥着重要的保护作用〔14,15〕。Wang等〔16〕指出,Dex可通过抑制NF-κB表达减弱炎症反应,进而发挥了保护脑缺血/再灌注损伤的作用。王宇恒等〔17〕研究发现,Dex能够上调细胞中HO-1蛋白的表达,发挥抗氧化应激损伤的作用。本研究发现,与I/R组相比,Dex组中NF-κB p65蛋白和mRNA的表达下降,而HO-1 蛋白和mRNA的表达升高。提示Dex可能通过下调NF-κB p65和HO-1表达,抑制离体心脏缺血再灌注损伤过程中的炎症和氧化应激过程。
综上所述,右美托咪定可减轻离体心脏I/R损伤,其作用机制可能与下调NF-κB p65炎症通路及上调HO-1抗氧化通路,改善心肌组织的炎症和氧化应激水平有关。这为离体心脏I/R的发生和发展提供了新的线索,也为右美托咪定改善离体心脏I/R损伤提供了新的依据。
4 参考文献
1Writing GM,Mozaffarian D,Benjamin EJ,etal.Executive summary:heart disease and stroke statistics-2016 update:A report from the American heart Association〔J〕.Circulation,2016;133(4):447.
2黄振华,叶 子,蒋 鹏,等.miRNAs在急性心肌梗死诊断中的研究进展〔J〕.岭南心血管病杂志,2017;23(3):347-50.
3Sun H,Zhou M,Zhong M,etal.Dexmedetomidine pretreatment reduces myocardial ischemia and reperfusion injury in rats by altering JAK/STAT and PI3K/Akt levels〔J〕.Intern J Clin Exp Med,2016;9(2):3785-9.
4Yoshikawa Y,Hirata N,Kawaguchi R,etal.Dexmedetomidine maintains its direct cardioprotective effect against ischemia/reperfusion injury in hypertensive hypertrophied myocardium〔J〕.Anesthesia,2018;126(2):443-52.
5Cakir M,Polat A,Tekin S,etal.The effect of dexmedetomidine against oxidative and tubular damage induced by renal ischemia reperfusion in rats〔J〕.Renal Failure,2015;37(4):704-8.
6Chen S,Hua F,Lu J,etal.Effect of dexmedetomidine on myocardial ischemia-reperfusion injury〔J〕.Inter J Clin Exp Med,2015;8(11):21166.
7郑凌云,岑柏宏,梁燕玲,等.乌榄叶水提取物对大鼠离体心脏缺血再灌注损伤的保护作用〔J〕.实用医学杂志,2017;33(6):885-9.
8陈雪君,雷 凡,周 芳.右美托咪啶后处理对大鼠离体心脏缺血再灌注的影响〔J〕.现代中西医结合杂志,2013;22(33):3660-2.
9Hu H,Zhai C,Qian G,etal.Protective effects of tanshinone IIA on myocardial ischemia reperfusion injury by reducing oxidative stress,HMGB1 expression,and inflammatory reaction〔J〕.Pharmaceut Biol,2015;53(12):1752-8.
10Yao BJ,He XQ,Lin YH,etal.Cardioprotective effects of anisodamine against myocardial ischemia/reperfusion injury through the inhibition of oxidative stress,inflammation and apoptosis〔J〕.Mol Med Rep,2018;17(1):1253-60.
11张玉辉,高亚坤,肖连波,等.右美托咪啶对体外循环下心脏瓣膜置换术患者心肌缺血再灌注损伤的影响〔J〕.临床心血管病杂志,2015;31(11):1195-7.
12Zeng X,Wang H,Xing X,etal.Dexmedetomidine protects against transient global cerebral ischemia/reperfusion induced oxidative stress and inflammation in diabetic rats〔J〕.PloS one,2016;11(3):e0151620.
13Gambhir S,Vyas D,Hollis M,etal.Nuclear factor kappa B role in inflammation associated gastrointestinal malignancies〔J〕.World J Gastroenterol:WJG,2015;21(11):3174.
14Onyiah JC,Sheikh SZ,Maharshak N,etal.Carbon monoxide and heme oxygenase-1 prevent intestinal inflammation in mice by promoting bacterial clearance〔J〕.Gastroenterology,2013;144(4):789-98.
15Ben-Ari Z,Issan Y,Katz Y,etal.Induction of heme oxygenase-1 protects mouse liver from apoptotic ischemia/reperfusion injury〔J〕.Apoptosis,2013;18(5):547-55.
16Wang L,Liu H,Zhang L,etal.Neuroprotection of dexmedetomidine against cerebral ischemia-reperfusion injury in rats:involved in inhibition of NF-κB and inflammation response〔J〕.Biomolecules Therapeutics,2017;25(4):383.
17王宇恒,焦晶华,李明选,等.右美托咪定对低氧诱发人支气管上皮细胞氧化应激损伤的影响〔J〕.解剖科学进展,2017;23(6):630-3.

