胸腺素β4促进结肠癌细胞上皮间质转化的机制
宁 登 陈 劲 程 琪 刘秋梦 李 雪 姜 立
(华中科技大学同济医学院附属同济医院胆胰外科,湖北 武汉 430030)
结肠癌为常见的消化道肿瘤,有着恶性率高、预后差、病死率高等特点,其发病和致死率在消化道肿瘤中居于前列〔1〕。结肠癌病情的严重程度与肿瘤细胞的侵袭与转移、耐药性密切相关。上皮间质转化(EMT),指上皮细胞在一定条件下向间充质细胞转化的现象,能让肿瘤细胞获得并增强侵袭与转移、耐药性等能力〔2,3〕,严重影响结肠癌的临床治疗,显著降低患者生活质量和预后质量。胸腺素β4(Tβ4)是一种小分子极性多肽,在细胞内起着重要的作用,广泛存在于生物体的各个组织之中。已有研究〔4〕表明,Tβ4过表达往往伴随着E-钙黏蛋白(E-cadherin)表达减弱与肿瘤细胞迁移能力增强,即表现为促进EMT。然而Tβ4促进EMT的具体机制尚未明朗。整合素相连激酶(ILK)是一种丝氨酸/苏氨酸蛋白激酶,可与细胞内许多骨架蛋白相互作用,参与调节细胞形态、细胞黏附等。ILK在多种肿瘤细胞中均表达异常,ILK的高表达与肿瘤转移密切相关。ILK的表达受多种机制调节,而Tβ4是否可通过调节ILK表达从而影响结肠癌细胞的EMT表型及转移能力尚不清楚。本研究采用过表达及沉默策略,结合实时定量PCR(qRFPCR)、Western印迹、免疫组化等多种分子生物学技术,检测结肠癌细胞中Tβ4的表达改变是否会改变细胞ILK表达、EMT表型及细胞侵袭转移能力,为发生转移的结肠癌患者的治疗提供新的治疗策略和理论依据。
1 材料与方法
1.1细胞培养及试剂 人结肠癌细胞SW480购自上海酶研生物科技有限公司,于37℃,5% CO2的条件中无菌培养。培养液为含有10%胎牛血清的L-15细胞培养基(含200 U/ml青霉素,100 μg/ml链霉素)。L-15培养基购自赛默飞世尔公司。胎牛血清购自Biological Industries公司。Taq2000 DNA聚合酶购自上海前尘生物科技有限公司。稳定转染细胞系筛选所用的G418购自中科瑞泰公司。硝酸纤维素膜购自颇尔公司。人E-cadherin单克隆抗体、人N-catenin单克隆抗体、人Akt多克隆抗体均购自Cell Signal公司。人p-Akt(Ser473)单克隆抗体购自上海信裕公司。人ILK单克隆抗体和人β-tubulin多克隆抗体购自Abcam公司。所有其他生化试剂均采用国产分析纯。
1.2病例选择 29例经同济医院病理确诊并手术切除的结肠癌组织,均选取了癌组织中心、癌旁组织和远端正常黏膜组织为对照。病例术前均已接受一个疗程的5-氟脲嘧啶(5-FU)加亚叶酸钙(LV)联合化疗方案,但未接受放疗。其中女7例,男22例。按结肠癌TNM病理分期标准归类如下:Ⅰ期3例,Ⅱ期21例,Ⅲ期5例。标本均用10%甲醛溶液固定,常规石蜡包埋、切片。
1.3Tβ4过表达的稳定转染细胞的构建及培养 在37℃、5%CO2环境下,将SW480细胞加入含有10%胎牛血清的L-15培养基中常规培养。选取生长情况良好的数对细胞按3×105接种于6孔板中。当细胞融合率达到70%左右时,转染带G418抗性的Tβ4过表达质粒,该质粒购自维真生物公司,将Tβ4的CDS区序列克隆至pBK-CMV载体。将细胞分为两组,分别转染48 h、72 h,观察Tβ4在不同时间点的表达水平。以0.8 mg/ml浓度的G418培养基培养2 w,4 w后获得稳定表达的细胞株,分别命名为Tb3(转染48 h)、Tb4(转染72 h)。
1.4Tβ4干扰腺病毒的构建及感染 将Tβ4基因与GFP DNA片段分别链接到pShuttle-CMV载体上,使用PmeⅠ线性化,再转染至BJ5183细胞中。使用PacⅠ酶切断后若出现3 kb或4.5 kb DNA片段,则证明转染成功。获得的腺病毒基因组经PacⅠ酶线性化之后,通过脂质体转染入Ad293细胞中。48 h之后,用反复冻融提取病毒,并继续通过Ad293细胞扩增。制备出足够的病毒之后,在无血清的环境中感染细胞1 h。再将培养基置换成完全培养基,在标准条件中培养细胞。
1.5qRT-PCR 用Trizol试剂(美国Invitrogen公司)提取细胞总RNA。按RNA反转录试剂盒说明制备cDNA第一链,使用Taq2000 DNA 聚合酶按以下引物序列扩增Tβ4,正向:5′-ATGTCTGACAAACCCGATATG-3′,反向:5′-GCTAGCCAGACCATCAGATG-3′。用SYRB Green染料(大连宝生物工程有限公司)法对mRNA水平进行相对定量检测。Tβ4定量引物正向:5′-ATGTCTGACAAACCCGATATG-3′,反向:5′-GCTAGCCAGACCATCAGATG-3′,内参引物β-Actin序列如下:正向:TCATGAAGTGTGACGTGGACAT;反向:CTCAGGAGGAGCAATGATCTTG。反应采用两步法,在实时荧光定量PCR仪(美国伯乐Bio-RADiCycler实时荧光定量PCR仪7500)上进行,反应程序为:95℃,10min;95℃,30s;60℃,1 min。重复第二步,共40个循环。采用2-ΔΔCt方法表示各基因mRNA相对表达量,进行3次独立实验。病毒感染前后分别按说明实时定量测量Tβ4基因的表达。将Tβ4与β-actin比值作为Tβ4表达水平的参数,进行定量分析。每次测试重复3次。
1.6总蛋白、胞质蛋白提取 总蛋白提取按照RIPA细胞裂解液操作流程裂解。参照说明书操作,收集细胞;加入冰上预冷的 PBS,重悬细胞沉淀;离心后弃上清,称量细胞质量,根据说明书推荐量加入冰预冷的CERⅠ溶液(含有蛋白酶抑制剂),涡旋振荡15 s重悬细胞,冰浴10 min;加入CERⅡ溶液,涡旋5 s后冰上孵育1 min,再涡旋震荡5 s,4℃离心10 min,吸取上清即得到胞浆蛋白。
1.7Western印迹检测蛋白表达水平 用聚丙烯酰胺凝胶(PAGE)电泳,然后转染硝酸纤维膜(NC膜),室温封闭1 h;4℃结合ILK、E-cadherin、β-cadherin、α-Parvin、GAPDH一抗过夜;TBST洗3次,每次10 min;室温结合羊抗兔IgG-HRP为二抗1h;TBST洗3次,每次10 min ;ECL发光系统显示蛋白质表达。
1.8Tβ4、ILK、E-cadherin的免疫组织化学染色法 石蜡包埋经甲醛固定的样本。切片,常规脱蜡至水。以Tβ4染色为例,以人多克隆Tβ4抗体为一抗(1∶200),生物素标记兔抗为二抗(1∶500),加入链霉菌抗生物素蛋白-过氧化物酶连结复合物。二氨基联苯胺(DAB)染色5~10 min,在显微镜下掌握染色程度,充分水洗后脱水,制片,随机选取视野照相(奥林巴斯显微镜CX31),免疫组织化学结果分析由染色强度(弱、中、强分别为1,2,3分)和阳性染色百分比(<25%为1分,25%~75%为2分,>75%为3分)两者的评分乘积决定,小于4分为低表达,大于等于4分为高表达。ILK和 E-cadherin与此类似。

2 结 果
2.1Tβ4促进SW480结肠癌细胞发生EMT 本研究构建了Tβ4过表达的稳定转染细胞系,并选取Tβ4表达最高的两个稳转克隆命名为Tb3和Tb4进行后续研究。PCR结果显示,与亲本SW480细胞和稳定转染空载的对照细胞(BK)相比,Tb3和Tb4细胞中的Tβ4显著升高(图1)。形态学上,Tb3和Tb4细胞排列松散、无规律,呈游离样分别;细胞轮廓呈拉长纺锤形态,部分细胞伴有丝状伪足形成(图2)。Western印迹检测结果显示,在Tb3与Tb4细胞中,E-cadherin显著降低而N-catenin显著上升(图3)。

图1 PCR方法检测各细胞的Tβ4表达水平

图2 Tb3、Tb4的形态(×400)

图3 Western印迹检测各细胞的E-cadherin、 N-catenin表达水平
2.2Tβ4过表达的细胞中ILK表达及活性上升 在Tβ4过表达细胞中,不论是全胞溶解产物(总蛋白,T)还是胞液部分(胞质蛋白,C)之中,ILK的含量都较高,而α-Parvin的含量并无变化(图4A),p-Akt(Ser473)表达增强,提示ILK活性增加(图4B)。见表1、表2。

A:采用Western印迹方法检测各细胞的总ILK(T)、α-Parvin(T)及胞质ILK(C)、α-Parvin(C)水平;B:采用Western印迹方法检测各细胞的p-Akt(Ser473)、AKT水平图4 Tβ4过表达的细胞中ILK表达及活性上升

指标SWBKTb3Tb4ILK(T)1.00±0.041.23±0.072.44±0.111)2)3.10±0.171)2)ILK(C)1.03±0.031.25±0.072.53±0.091)2)3.32±0.211)2)α-Parvin(T)1.01±0.040.56±0.050.84±0.071.05±0.04α-Parvin(C)1.03±0.050.55±0.070.53±0.061.28±0.05
与SW比较:1)P<0.05;与BK比较:2)P<0.05;表2同

表2 各细胞体外激活酶试验结果
2.3Tβ4过表达促进结肠癌细胞侵袭、转移 伤痕愈合和transwell方法结果显示,Tβ4过表达细胞转移能力显著增强(图5A),侵袭能力也显著升高(图5B)。
2.4干扰Tβ4表达可下降细胞中ILK表达,抑制细胞侵袭、转移 在Ad-Tβ4 AS感染24 h与48 h之后,Tβ4的表达显著下降,而且,受Ad-Tβ4 AS感染的Tb3和Tb4细胞中,ILK也明显下降,伤痕愈合、Transwell方法检测抑制Tβ4后,细胞的转移、侵袭能力均显著下降,见表3,图6。
2.5在人结肠癌组织中Tβ4的表达水平与E-cadherin表达及ILK活性的相关性 本研究对29例结肠癌标本采用免疫组化法检测组织标本中Tβ4,E-cadherin和ILK的表达水平,结果见图7,见表4。

Tβ4 mRNA相对量(%)0 h12 h24 h48 hILK相对表达量(%)48 h96 hTb3100.0±0.1103.1±11.249.2±5.61)48.3±2.01)0.50±0.020.48±0.01Tb4100.0±0.197.3±1.561.6±3.21)56.1±7.11)0.71±0.080.50±0.02
与0 h比较:1)P<0.05
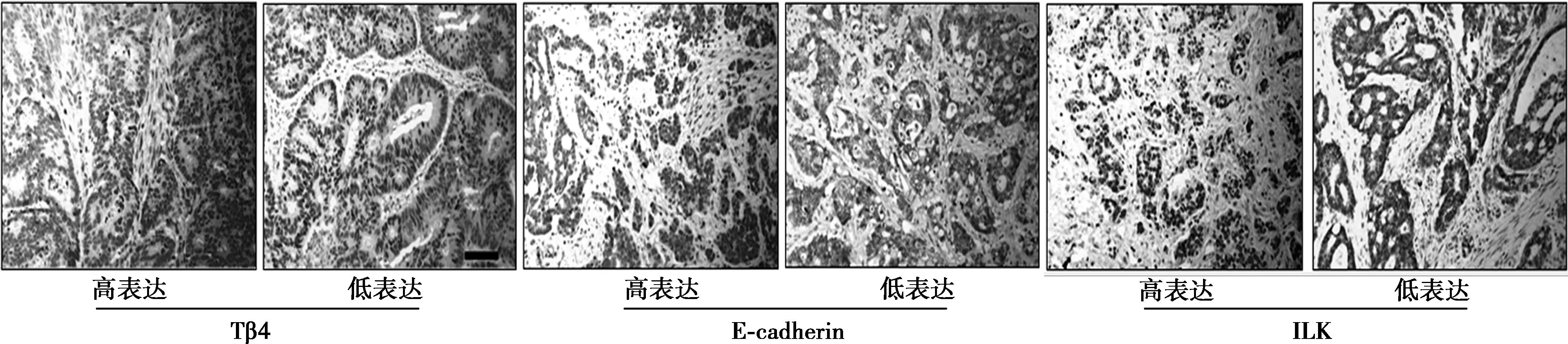
图7 采用免疫组化方法检测组织标本中Tβ4,E-cadherin和ILK的表达水平(DAB,×400)

Tβ4(+)(-)患者人数209ILK(+)16(80.0)0(0.0)ILK(-)4(20.0)9(100)E-cadherin(+)2(10.0)6(66.7)E-cadherin(-)18(90.0)3(33.3)
Tβ4的过表达与ILK的表达呈正相关(P=0.035),而与E-cadherin的表达呈负相关(P=0.043)
3 讨 论
EMT是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,上皮细胞失去了细胞极性、失去与基底膜的连接,从而获得了较高的迁移与侵袭、降解细胞外基质的能力,在肿瘤转移过程中发挥关键作用。发生EMT的细胞其形态学上会发生显著变化,主要表现为细胞极性丧失、出现纺锤形的成纤维样的细胞形态,出现丝状伪足。E-cadherin的表达降低或丢失是EMT的最重要的标志性变化〔5〕。已有研究〔6~8〕证实,由E-cadherin表达降低引起的EMT,将减弱E-cadherin依赖性的胞间黏附作用,同时增加细胞的运动性,从而促进肿瘤细胞的侵袭,加快肿瘤的恶性变化。
目前已证实,ILK的激活能够下调E-cadherin的表达水平,促进EMT,从而引发肿瘤细胞的迁移与肿瘤的恶化〔9~11〕。同时,多项研究〔9,12~14〕表明,ILK激活的癌症患者预后生存、生活质量显著降低。Tβ4是一种促淋巴细胞生成因子,广泛存在于大多数组织和细胞中,参与了免疫调节、创伤愈合、组织再生等需要细胞迁移运动的生物过程〔15~17〕。本研究中,从统一的结肠癌细胞系中几种稳定的Tβ4过表达克隆系(Tb3和Tb4)的形态呈纤维状、分散状,提示这些细胞中已经发生了EMT。经检测,在这些新细胞中,E-cadherin的含量显著降低,与之前类似研究〔4〕的结果一致,对于Tb3和Tb4细胞来说,无论是细胞整体还是胞质的溶解产物中,检测到N-catenin的含量显著上升。由于N-catenin mRNA含量并没有上升,这里的上升极有可能是由于其稳定性提高。因为在Tβ4过表达的SW480细胞中,ILK蛋白的表达和ILK酶的活性升高,而相反的,作为ILK激活蛋白之一的α-parvin却并没有发生变化。这提示此处的ILK激活与其-parvin复合物无关。本研究随后用携带Ad-Tβ4 AS的腺病毒感染了Tβ4过表达的细胞以抑制Tβ4,这些受感染的细胞中ILK活性明显下降。更重要的是,免疫组化试验结果证实,在人体结肠癌细胞中,Tβ4的表达水平与ILK呈正相关,与E-cadherin呈负相关。
综上所述,在人结肠癌细胞中,Tβ4相关的EMT与ILK的激活密不可分。这种作用不仅仅表现在破坏胞间连接,还表现为下调E-cadherin的表达。因此Tβ4的过表达会促进肿瘤细胞的侵袭和转移。
4 参考文献
1Torre LA,Bray F,Siegel RL,etal.Global cancer statistics,2012〔J〕.CA Cancer J Clin,2015;65(2):87-108.
2Gao L,Liu J,Zhang B,etal.Functional MUC4 suppress epithelial-mesenchymal transition in lung adenocarcinoma metastasis〔J〕.Tumour Biol,2014;35(2):1335-41.
3陈潇雅,余长云.上皮间质转化与肿瘤转移的研究进展〔J〕.中国耳鼻咽喉颅底外科杂志,2015;21(4):346-50.
4Sribenja S,Wongkham S,Wongkham C,etal.Roles and mechanisms of β-thymosins in cell migration and cancer metastasis:an update〔J〕.Cancer Invest,2013;31(2):103-10.
5Pieters T,van Roy F.Role of cell-cell adhesion complexes in embryonic stem cell biology〔J〕.J Cell Sci,2014;127(Pt 12):2603-13.
6Talchai C,Xuan S,Lin HV,etal.Pancreatic β cell dedifferentiation as a mechanism of diabetic β cell failure〔J〕.Cell,2012;150(6):1223-34.
7Yang YL,Chen MW,Xian L.Prognostic and clinicopathological significance of downregulated E-cadherin expression in patients with non-small cell lung cancer(NSCLC):a meta-analysis〔J〕.PLoS One,2014;9(6):e99763.
8Onder S,Taskin OC,Sen F,etal.High expression of SALL4 and fascin,and loss of E-cadherin expression in undifferentiated/dedifferentiated carcinomas of the endometrium:an immunohistochemical and clinicopathologic study〔J〕.Medicine(Baltimore),2017;96(10):e6248.
9Yen CF,Kim SH,Liao SK,etal.Increased expression of integrin-linked kinase during decidualization regulates the morphological transformation of endometrial stromal cells〔J〕.Fertil Steril,2017;107(3):803-12.
10Berardi DE,Flumian C,Campodónico PB,etal.Myoepithelial and luminal breast cancer cells exhibit different responses to all-transretinoic acid〔J〕.Cell Oncol(Dordr),2015;38(4):289-305.
11Zheng YP,Zhang SB,Wang F,etal.Effects of lentiviral RNA interference-mediated downregulation of integrin-linked kinase on biological behaviors of human lens epithelial cells〔J〕.Int J Ophthalmol,2016;9(1):21-8.
12张书俊.整合素连接激酶、醌氧化还原酶-1和增殖细胞核抗原在肝细胞癌中的表达及意义〔J〕.中国老年学杂志,2015;35(6):1511-3.
13Lamouille S,Xu J,Derynck R.Molecular mechanisms of epithelial-mesenchymal transition〔J〕.Nat Rev Mol Cell Biol,2014;15(3):178-96.
14Li J,Zhang H,Wu J,etal.Prognostic significance of integrin-linked kinase1 overexpression in astrocytoma〔J〕.Int J Cancer,2010;126(6):1436-44.
15Hong KO,Lee JI,Hong SP,etal.Thymosinβ4 induces proliferation,invasion,and epithelial-to-mesenchymal transition of oral squamous cell carcinoma〔J〕.Amino Acids,2016;48(1):117-27.
16Ryu YK,Lee JW,Moon EY.Thymosin beta-4,actin-sequestering protein regulates vascular endothelial growth factor expression via hypoxia-inducible nitric oxide production in hela cervical cancer cells〔J〕.Biomol Ther(Seoul),2015;23(1):19-25.
17Piao Z,Hong CS,Jung MR,etal.Thymosinβ4 induces invasion and migration of human colorectal cancer cells through the ILK/AKT/β-catenin signaling pathway〔J〕.Biochem Biophys Res Commun,2014;452(3):858-64.

