六味地黄丸对糖尿病大鼠血管功能的影响及抗氧化应激机制
于 洋 赵 宁 张 娜
(锦州医科大学生理学教研室,辽宁 锦州 121001)
血管内皮细胞功能不全(ECD)已经成为2型糖尿病(T2DM)及其血管并发症发生发展的始动关键因素及病理基础,并贯穿于整个病程的始终〔1〕。研究表明内皮源型一氧化氮(NO)可引起内皮依赖性舒张功能,介导血管舒张〔2〕。T2DM造成的氧化应激(OS)损伤不但是糖尿病(DM)及血管并发症的重要机制,也加速了ECD的发生发展〔3〕。六味地黄丸(LWDHP)是著名中成药,广泛用于临床,尤其在高血脂、脂肪肝、T2DM和肥胖等代谢性疾病的防治中突显优势〔4〕。本实验通过观察LWDHP对DM大鼠血管内皮舒张功能、NO含量、丙二醛(MDA)浓度及相关基因蛋白质精氨酸甲基转移酶(PRMT)1表达的影响,探讨LWDHP 在DM血管病变中的保护机制。
1 材料与方法
1.1动物 30只雄性SPF级SD大鼠,体质量160~190 g,购自辽宁长生生物技术有限公司〔许可证号:SCXK(辽)2010-0001〕。
1.2主要试剂 LWDHP(浓缩丸),北京同仁堂(国药准字Z19993068);PRMT1一抗,鼠抗人GAPDH一抗,美国Proteintech Group公司;辣根过氧化物酶(HRP)标记的羊抗兔、羊抗鼠IgG二抗,Cell Signaling Technology公司;RT-PCR试剂盒,TaKaRa公司;链脲佐菌素(STZ),Sigma公司;总NO检测试剂盒,MDA检测试剂盒,碧云天生物技术研究所。
1.3T2DM大鼠模型建立及药物干预 健康雄性SD大鼠,适应性喂食1 w后,随机分为正常对照组(10只)和造模组(20只)。正常对照组喂食普通饲料,造模组喂食高脂饲料(100 g/L猪油+100 g/L蛋黄粉+1.0 g/L 胆盐+10 g/L 维生素+789 g/L基础饲料)。5 w后大鼠禁食不禁水14~16 h,造模组腹腔注射STZ 30 mg/kg(用柠檬酸-柠檬酸钠缓冲液配成浓度为10 g/L的STZ溶液),正常对照组注射等体积的柠檬酸-柠檬酸钠缓冲液,1次/d,连续2 d。1 w后鼠尾静脉取血监测血糖水平,以两次随机血糖≥16.7 mmol/L作为T2DM模型成功的标志,继续喂养高脂饲料4 w以稳定模型。T2DM模型大鼠随机分为DM模型组和LWDHP治疗组,每组10只。LWDHP治疗组给予3 ml/kg的药物混悬液进行灌胃(用生理盐水配制,剂量为1.2 g/kg),正常对照组和DM模型组以等体积生理盐水灌胃,1次/d,连续灌胃8 w。给药期间DM模型组与LWDHP治疗组大鼠继续喂食高脂饲料。8 w后,3组大鼠禁食12 h,断头处死。取血管组织,观察内皮依赖性血管舒张功能,检测NO浓度、MDA含量及PRMT1的表达。
1.4离体胸主动脉内皮依赖性血管舒张功能测定 大鼠断头处死,迅速打开胸腹腔,取出胸主动脉置于0℃ 的Kreb液(NaCl 119 mmol/L,KCl 4.7 mmol/L,CaCl2·2H2O 2.5 mmol/L,KH2PO41.2 mmol/L,MgSO4·7H2O 1.2 mmol/L,NaHCO325 mmol/L,葡萄糖11.1 mmol/L,pH7.4)中。去除血管周围的结缔组织和脂肪组织,清除血管内的血液,将血管剪切成约3 mm的血管环。将血管环悬挂于含8 ml Kreb液(37℃)的浴槽中,持续通入95% O2+5% CO2的混合气体。血管环的一端连接张力换能器,记录血管环张力的变化。血管环的初始张力为2 g,平衡60 min后,加入KCl(使浴槽中终浓度为50 mmol/L)溶液预刺激2次。血管环张力平衡后,向浴槽内加入1×10-6mol/L的苯肾上腺素收缩血管,判断血管活性,然后用Kreb液冲洗至基线,血管环稳定后开始实验,期间每15 min换Krebs液1次,药物和液体均为直接加入浴液中。用1×10-6mol/L的苯肾上腺素诱发血管收缩达100%,依次加入终浓度分别为1×10-9、1×10-8、1×10-7、1×10-6、1×10-5、1×10-4mol/L的乙酰胆碱(ACh)诱导血管舒张,计算舒张百分比(%)= 药物引起舒张的幅度张力/苯肾上腺素最大收缩张力×100%。冲洗血管,重新平衡到初始张力,改用浓度为10-8~10-4mol/L的内皮非依赖性血管舒张剂——亚硝酸钠(NaNO2)舒张血管,以证明血管内皮功能失调。
1.5离体胸主动脉NO含量和MDA浓度的测定 取整条主动脉约5 cm于液氮中冻存备测NO含量和MDA浓度,测定时取适量主动脉,加入1∶10冷生理盐水,匀浆后离心,取上清液,按NO和MDA检测试剂盒的说明进行操作,测定光密度值,检测各组血管组织中NO含量和MDA浓度。
1.6RT-PCR测定血管组织中PRMT1 mRNA的表达 提取血管总RNA,用RT-PCR 试剂盒进行逆转录及聚合酶链反应。β-actin上游引物序列:5′-ACACGAAAGCAATGCTATCACCTC-3′,下游引物序列:5′-TGACAGCAGTCGGTTGGAGCGA-3′,扩增片段长度153 bp。反应条件为94℃ 2 min,94℃ 30 s,60℃ 30 s,72℃ 1 min,72℃ 5 min,40个循环。PRMT1上游引物序列:5′-GAGGCCGCGAACTGCATCAT-3′,下游引物序列:5′-TGGCTTTGACGATCTTCACC-3′,扩增片段长度350 bp。反应条件:退火60℃,30个循环。通过凝胶成像系统以PRMT1条带光密度值和对应的β-actin条带光密度值的比值表示PRMT1 mRNA的表达量。
1.7Western印迹测定血管组织中PRMT1蛋白表达 提取血管总蛋白,调整各组的蛋白质上样量(40 μg),进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,转膜,5%脱脂奶粉37℃水浴震荡封闭1 h,加入PRMT1一抗(1∶500稀释),4℃过夜。TBST清洗3次,5 min/次,HRP标记IgG二抗(1∶2 000稀释),TBST清洗4次,5 min/次,37℃水浴震荡2 h,DAB显色,扫描条带,以GAPDH作为内参,PRMT1和GAPDH蛋白表达强度的灰度比值显示PRMT1相对表达量。
1.8统计学方法 使用SPSS20.0统计分析软件进行单因素方差分析后进行组间LSD分析。
2 结 果
2.1LWDHP对DM大鼠血管舒张功能的影响 正常对照组,ACh可浓度依赖性舒张苯肾上腺素收缩的血管环,最大舒张效应为(94.50±2.15)%。DM模型组ACh最大舒张反应为(61.82±2.34)%,与正常对照组比较差异有统计学意义(P<0.01),说明动脉的舒张功能出现明显障碍。LWDHP治疗组ACh最大舒张效应为(78.66±3.46)%,与DM模型组比较差异有统计学意义(P<0.01),说明主动脉对ACh的舒张反应较DM模型组明显增强。各组动脉对内皮非依赖性舒张剂NaNO2的最大舒张效应差异无统计学意义(P>0.05),表明DM模型大鼠血管舒张功能障碍是由于血管内皮功能异常导致的。见图1。
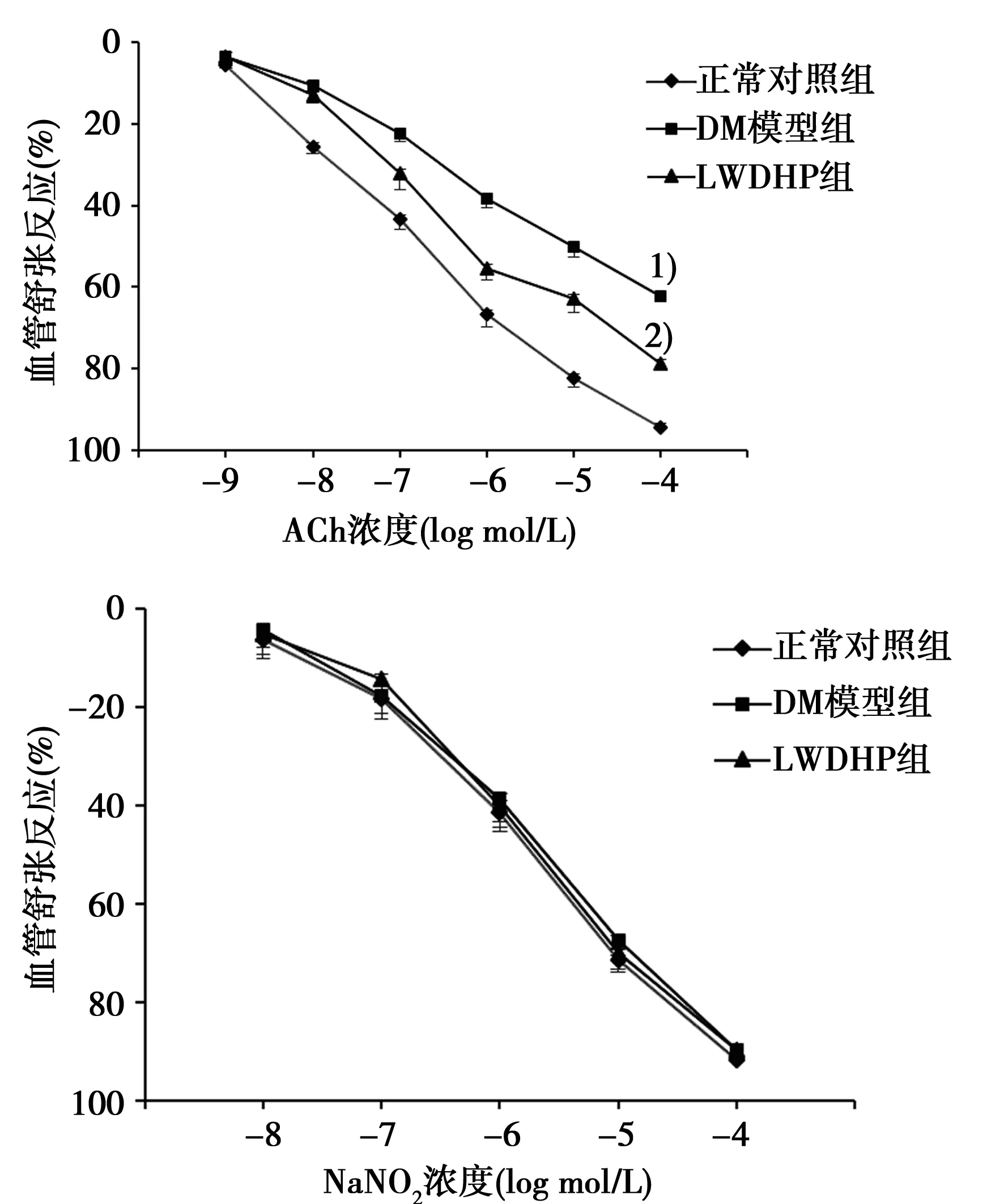
与正常对照组比较:1)P<0.01;与DM模型组比较:2)P<0.01图1 各组大鼠主动脉对ACh和NaNO2介导的 血管舒张功能的比较
2.2各组动脉组织中NO含量和MDA浓度的测定 DM模型组NO含量明显降低,MDA浓度明显增加,与正常对照组比较差异有统计学意义(P<0.01)。LWDHP治疗组的NO含量升高,MDA浓度下降,与模型组比较显著有统计学意义(P<0.01)。见表1。
表1 LWDHP对血管组织中NO含量和MDA浓度的影响
与正常对照组比较:1)P<0.01;与DM模型组比较:2)P<0.01
2.3LWDHP对血管组织中PRMT1 mRNA表达的影响 与正常对照组(0.33±0.000 9)比较,DM模型组血管组织内PRMT1 mRNA的表达量(0.70±0.000 1)显著升高(P<0.01)。与DM模型组比较,LWDHP治疗组PRMT1 mRNA表达量(0.50±0.000 7)明显下降(P<0.01),说明LWDHP预处理可以抑制PRMT1 mRNA的表达量。见图2。

图2 各组血管组织PRMT1 mRNA表达的比较
2.4LWDHP对血管组织中PRMT1 蛋白表达的影响 与正常对照组(0.45±0.000 5)比较,DM模型组血管组织内PRMT1 蛋白的表达量(0.62±0.000 9)同样显著升高(P<0.01)。与DM模型组比较,LWDHP治疗组PRMT1蛋白表达量(0.36±0.000 7)同样下降(P<0.01),意味着LWDHP同样也可以抑制PRMT1蛋白的表达。见图3。
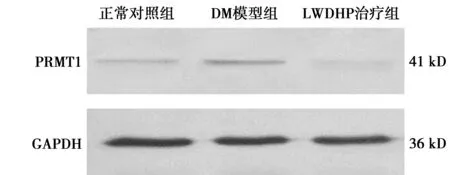
图3 各组血管组织PRMT1蛋白表达的比较
3 讨 论
血管内皮细胞(EC)是覆盖在血管腔内表面的高度分化的单层细胞,是血管壁和血液之间的分界细胞。正常的EC可保证血管的反应性和血管壁的完整性,是防御DM不良反应的第一道防线,而DM患者血管内皮损伤是疾病发生发展的首发因素〔5〕。本实验观察到,T2DM大鼠的胸主动脉对ACh的血管舒张反应较正常对照组明显降低,提示DM大鼠的内皮依赖性血管舒张功能存在障碍。采用LWDHP灌胃治疗的大鼠胸主动脉对ACh的血管舒张反应增加,表明内皮依赖性血管舒张功能得以改善。三组大鼠对内皮非依赖性舒张剂NaNO2的血管舒张反应无明显差异,说明LWDHP治疗组和DM模型大鼠胸主动脉对外源性NaNO2扩血管的反应是相同的,即DM并没有降低血管平滑肌细胞对NO的敏感性,另一方面也证实了LWDHP并不是通过增加血管平滑肌细胞对NO的敏感性来发挥其改善血管舒张功能的。这一结果提示LWDHP 可保护DM大鼠的血管EC,改善DM所致的内皮依赖性血管舒张功能障碍。
NO是一种内皮源性信号分子,能引起内皮依赖性舒张功能,介导血管舒张。实验发现〔6〕,输注胰岛素后实验动物下肢血流量较基础值增加了2倍,但加用抑制剂后血管舒张作用消失,提示胰岛素的血管舒张作用是NO依赖性,而且胰岛素是通过增加内皮源性NO的释放来实现血管舒张功能的。培养的EC实验也证明胰岛素抵抗的细胞裂解液中NO含量释放减少〔7〕。本实验结果显示,DM模型组血管组织中NO含量明显降低,而LWDHP能增加NO含量,进一步证实LWDHP对DM内皮损伤的改善作用,提示LWDHP对血管内皮的保护作用与其能够促进血管内皮NO的生成有着密切关系。
高糖环境下体内的OS反应增强,使体内的活性氧大量积聚,从而促进DM及其他血管并发症的发生和发展。同时,在氧自由基的攻击下膜脂质发生过氧化反应,最重要的终产物之一MDA也增加〔8〕。因此, MDA含量的变化可间接反映氧自由基的生成量,从而了解氧自由基对细胞损伤的程度。另外,DM发生发展过程中的OS反应导致的大量活性氧可以催化一种关键酶——PRMT1酶的活化,它可以催化一种新的心血管疾病的危险因子——非对称二甲基精氨酸(ADMA)的生成〔9〕。ADMA是内皮源型一氧化氮合酶(eNOS)的竞争抑制剂,可以降低其活性,降低NO的合成。当eNOS的底物L-精氨酸的活性缺乏时,此时的L-精氨酸在eNOS的作用下能产生更多的活性氧自由基,加重OS反应〔10〕。本实验中,DM模型组血管组织中MDA浓度明显增加,PRMT1 mRNA和蛋白的表达量显著升高,证明了活性氧可使PRMT1进一步增多,最终使NO合成减少,进一步恶化ECD,这样就可能形成一个加重OS反应的恶性循环。同时也检测到LWDHP治疗后MDA浓度下降,PRMT1 mRNA和蛋白的表达量显著降低,揭示了LWDHP可以抑制PRMT1表达、降低OS损伤,改善受损的EC状态,增加胰岛素敏感性,从而延缓DM及其血管并发症的发生和发展。
既然PRMT1酶作用的底物是ADMA,ADMA又是eNOS的竞争抑制剂,而且eNOS是NO合成的关键酶,那么在DM及血管并发症发生发展的EC氧化损伤的这条通路中,LWDHP对DM大鼠血管组织中ADMA的生成和eNOS的表达是否有影响,还需进一步研究。
4 参考文献
1Al-Jiffri OH,Al-Sharif FM,Al-Jiffri EH,etal.Intrinsic disorder in biomarkers of insulin resistance,hypoadiponectinemia,and endothelial dysfunction among the type 2 diabetic patients〔J〕.Intrinsically Disord Proteins,2016;4(1):e1171278.
2Yu FTH,Chen X,Straub AC,etal.The role of nitric oxide during sonoreperfusion of microvascular obstruction〔J〕.Theranostics,2017;7(14):3527-38.
3Klisic A,Isakovic A,Kocic G,etal.Relationship between oxidative stress,inflammation and dyslipidemia with fatty liver index in patients with type 2 diabetes mellitus〔J〕.Exp Clin Endocrinol Diabetes,2017;〔Epub ahead of print〕.
4房 玲,樊永平,王 蕾.六味地黄丸(汤)的临床应用研究〔J〕.中华中医药杂志,2013;28(7):2181-5.
5Kang H,Ma X,Liu J,etal.High glucose-induced endothelial progenitor cell dysfunction〔J〕.Diab Vasc Dis Res,2017;14(5):381-94.
6Bradley EA,Willson KJ,Choi-Lundberg D,etal.Effects of central administration of insulin or l-NMMA on rat skeletal muscle microvascular perfusion〔J〕.Diabetes Obes Metab,2010;12(10):900-8.
7于 洋,赵丹玉,王艳杰,等.软脂酸对EA.hy926细胞一氧化氮合成的影响及六味地黄丸的干预效应〔J〕.中国老年学杂志,2014;34(6):1583-5.
8Kim CH.Expression of extracellular superoxide dismutase protein in diabetes〔J〕.Arch Plast Surg,2013;40(5):517-21.
9Servillo L,Giovane A,Cautela D,etal.The methylarginines NMMA,ADMA,and SDMA are ubiquitous constituents of the main vegetables of human nutrition〔J〕.Nitric Oxide,2013;30:43-8.
10Goette A,Hammwohner M,Bukowska A,etal.The impact of rapid atrial pacing on ADMA and endothelial NOS〔J〕.Int J Cardiol,2012;154(2):141-6.

