精子与肿瘤细胞融合模型的生物学特性研究
陈强 , 靳广毅 , 林桂淼,刘好,许改霞,王晓梅,*
(1.深圳大学医学院生理学教研室,广东深圳518060;2.深圳大学光电子器件与系统教育部重点实验室,广东深圳518060)
早在上世纪70年代,一些科学家报道了精子与体细胞体外融合的生物现象[1-3]。然而,由于当时技术能力限制,这些实验都没有对精子与体细胞融合所形成的嵌合细胞的生物学性状进行深入研究。直到本世纪初一些研究开始关注精子与体细胞融合所形成的嵌合细胞的生物学特征。目前可以证实的是精子染色体在嵌合细胞中能够经去致密过程而活化,并能够表达其所携带的遗传信息[1,4]。2004年Khosrotehrani等[5]报道:在同一妇女的多个不同组织和器官可同时存在含有Y染色体的嵌合细胞,说明了这些细胞的同源性,同时也证实了嵌合细胞的干细胞样特征和较高的迁移能力。随后的一些研究显示,造血细胞较其他类型外周血细胞具有更高的嵌合细胞比例[6-7],而新生的肝组织中嵌合细胞的比例也显著高于非新生肝组织[8],这些研究均提示嵌合细胞与正常体细胞在生物学性状方面的差异和干细胞样特征。
我们已采用体外共培养的方法[9],建立了稳定的精子与肿瘤细胞融合模型,并采用自主合成的精子与肿瘤细胞共培养基(sperm-tumor co-culture medium,STCM),对融合模型进行了优化。本项研究在体外以精子与宫颈癌HeLa细胞融合模型为主要研究对象,对精子与肿瘤细胞融合的时效性、细胞接种密度依赖性及细胞类型特异性进行了分析。在体内则以临床收集的宫颈癌标本为主要研究对象,分析嵌合型细胞在宫颈癌组织中是否存在以及Y染色体特异编码基因在嵌合型细胞的表达。本研究的目的在于探讨精子与肿瘤细胞融合过程的生物学特征,为嵌合型肿瘤细胞生物学特征的研究奠定前期实验基础。
1 材料与方法
1.1 主要试剂、仪器和实验动物24孔板(Corning Costar)、35mm培养皿(Corning Costar)、滤孔直径40 μm的过滤皿(Thermo Scientific)、嵌套式的培养皿/板(Corning Costar)、96孔板 (Corning Costar)、 石蜡 组 织DNA提取试剂盒(Thermo Scientific)。
8~10周龄雄性C57BL/6小鼠(购自广东省医学实验动物中心,实验动物检疫编号44007200016312),饲养于SPF级动物房,半昼半夜,自由取食、取水。经1周左右适应期后的动物用于精子获取。
1.2 肿瘤细胞培养
实验中所用细胞系(表1)均为深圳大学医学院纳米磁实验室保存,细胞维持及冻存、复苏均按照美国模式培养物集存库(American TYPE Culture Collection,ATCC)推荐的方法进行。
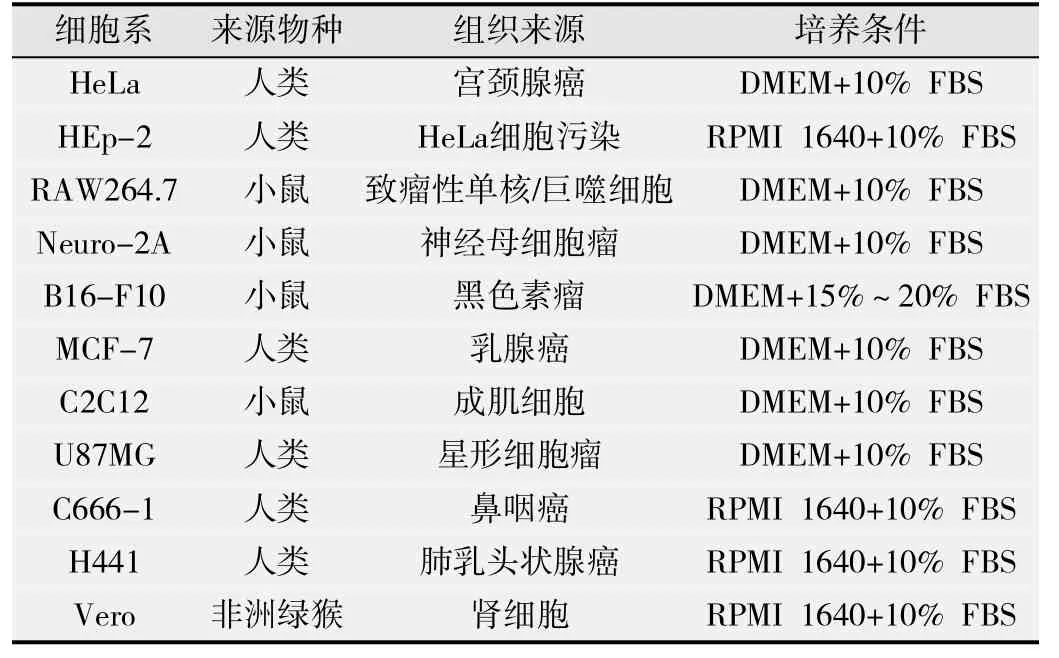
表1 实验中涉及的细胞系及其培养条件
1.3 细胞融合的时效性研究
小鼠精子获取、精子与肿瘤细胞共培养以及精子与肿瘤细胞融合率估算方法均按照我们先前提供方法[9]进行。
将HeLa细胞接种于24孔板,待每个集落的细胞数为4~8个时进行共培养实验。每30min设置1个取样点,持续5h,共计10个取样点。实验同时设一个空白对照(不添加精子)和一个阴性对照(嵌套式培养体系)。实验重复4次,结束后以四甲基噻唑蓝(methylthiazolyldiphenyl tetrazolium bromide,MTT)法估算各个取样点残存于孔板底部肿瘤细胞数量百分比(共培养组吸光度值/阴性对照吸光度值)。
1.4 细胞融合时细胞接种密度的研究
HeLa、HEp-2、H441和MCF-7细胞系(均为人类来源的腺癌细胞系)被用于细胞接种密度依赖性研究。每种细胞分别以30~40/mm2的密度接种于24孔板。待每个细胞集落的细胞数分别为1~2个、3~5个及8~12个时分别进行共培养实验,持续4h。实验结束后以MTT法估算各实验组精子与肿瘤细胞的融合率。
1.5 细胞融合的细胞类型特异性研究
我们选取了HeLa、HEp-2、H441等十余种肿瘤细胞系进行与精子融合的细胞类型特异性研究。每种细胞均以30~40/mm2的密度接种于24孔板,每种细胞接种4孔,接种24h后进行精子的共培养实验,持续4h。实验结束后以MTT法估算各实验组的精子与肿瘤细胞的融合率。为排除小鼠个体差异对融合率的影响,每次实验均包含HeLa细胞,并根据不同实验HeLa细胞与精子的融合率进行标准化。
1.6 嵌合型肿瘤细胞单克隆株的获得及鉴定
利用自制吸卵针于超净工作台内倒置相差显微镜(IX71,Olympus)下吸取共培养2h后漂浮于培养基上层的单个肿瘤细胞,并迅速将细胞转移至96孔板内进行培养。12h后对96孔板内各孔进行细胞计数,选取单个细胞孔为假定的嵌合型肿瘤细胞单克隆株。待假定的嵌合型肿瘤细胞单克隆株细胞达到 1×107个后,部分细胞进行冻存,取 1 ×106个细胞进行DNA的提取。DNA的提取使用Thermo Scientific公司试剂盒按操作说明书进行。提取的DNA先在紫外分光光度计下进行常规定量,然后以PCR进行小鼠Y染色体特异编码的性别决定基因(sex-determinating region on theY chromosome, S RY)的扩增进行验证。相关引物按照GenBank提供的基因序列自行设计,正向引物:5´-cat cggagggctaaagtgtca-3´;反向引物:5´-ctactccagtcttgcctgt atgtg-3´。小鼠 G APDH基因的PCR扩增反应作为本研究的内参照,相关引物按照GenBank提供的基因序列自行设计,正向引物:5´-tcaacggcacagtcaaggc-3´;反向引物:5´-tccacgacatactcagcacc-3´。PCR扩增反应按如下步骤进行:95℃、5min;95℃、5s,56℃、20 s,72℃、20s,35个循环; 72℃、 5min。
1.7 临床宫颈癌组织中嵌合型肿瘤细胞的筛检
20例宫颈癌石蜡切片标本由深圳市第一人民医院病理科提供。石蜡组织DNA提取按照试剂盒(Thermo Scientific)使用说明进行。首先以PCR的方法进行βactin基因的扩增以鉴定提取的DNA质量。然后进行TSPY基因片段的扩增。扩增所需引物均根据GenBank提供的序列自行设计: β-actin正向5´-agcgcaagtactccgt gtg-3´,反向5´-a a gcaatgctatcacctccc-3´;TSPY正向5´-gggagggtaagggaaataa-3´, 反 向5´-t a ctgggcatcaaacagct-3´。PCR扩增反应步骤如上述PCR实验方法进行。 TSPY基因的PCR扩增产物委托华大基因公司进行测序,测序结果由Blast(http://blast.ncbi.nlm.nih.gov/ Blast.cgi)在线软件进行比对分析。
1.8 统计方法
精子与肿瘤细胞的融合率以x±s的形式表示,以方差分析(ANOVA)进行融合率的比较。所有数据分析均以SPSS16.0软件进行,以 α=0.05为检验水准。
2 结果
2.1 精子与肿瘤细胞融合的时效特征
共培养的前1.5h残存的肿瘤细胞数量迅速降低(图1),此后虽然可见共培养体系中运动活跃的精子,但残存的贴壁细胞数量并未发生显著改变。
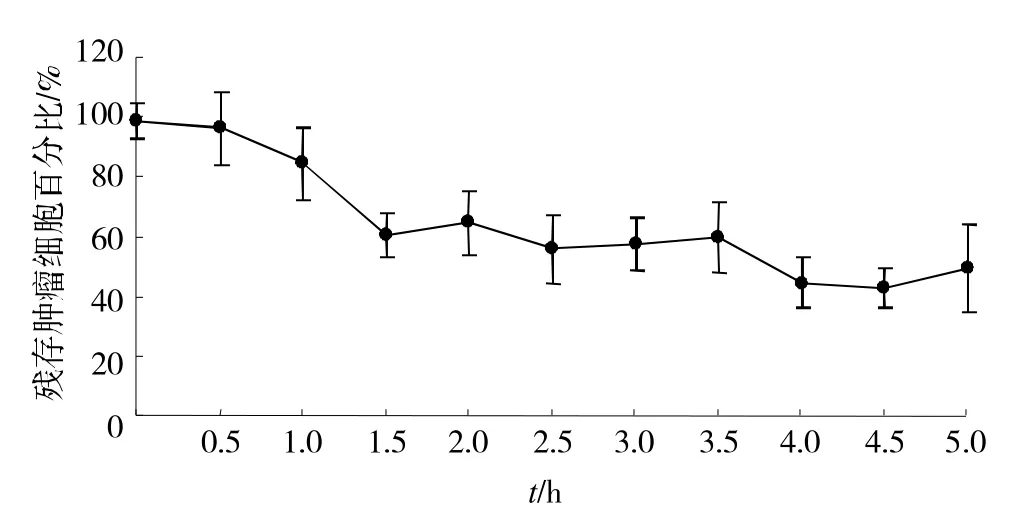
图1 精子与肿瘤细胞融合的时效特征
2.2 精子与肿瘤细胞融合的细胞密度依赖性
当接种的细胞密度较高(8~12个)时,我们发现不足10%的HeLa细胞能够与精子融合,而当细胞接种密度较低(1~2个)时,超过50%的HeLa细胞能够与精子融合(图2)。而且我们在4种不同类型的细胞均发现随细胞接种密度的升高,精子与肿瘤细胞的融合率呈明显的下降趋势(图2)。
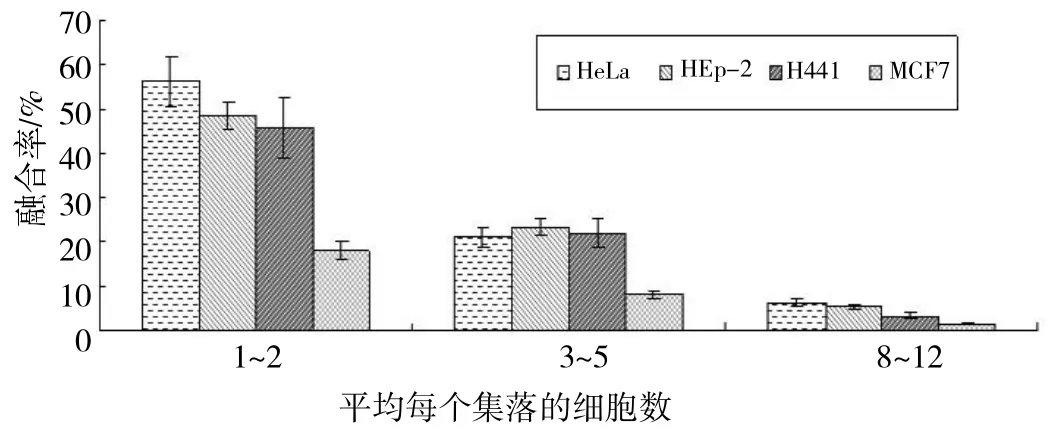
图2 精子与肿瘤细胞融合的细胞密度依赖性
2.3 精子与肿瘤细胞融合的细胞类型特异性
我们的实验结果(图 3)显示腺癌来源的肿瘤细胞系与精子的融合率显著高于其他肿瘤细胞系和正常细胞系(P<0.01);而除腺癌外的其他肿瘤细胞系与精子的融合率显著低于正常细胞系(P<0.01)。
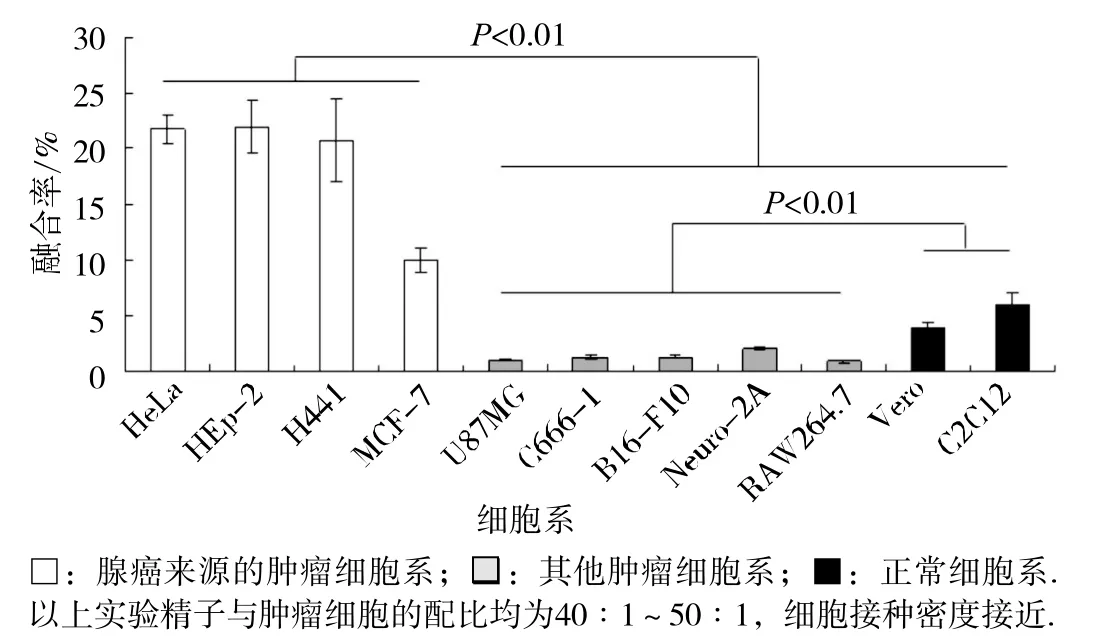
图3 精子与肿瘤细胞融合的细胞类型特异性特征
2.4 精子与HeLa细胞融合形成的嵌合细胞的分离和鉴定
利用显微注射系统抓取和单克隆培养的方法,我们目前共获得4个精子与HeLa细胞融合单克隆株。经小鼠Y染色体特异编码的性别决定基因(S RY ) 和GAPDH的PCR扩增实验证实其中的2个单克隆株为含有小鼠X染色体的嵌合细胞(GAPDH扩增阳性而SRY扩增阴性,称为X型单克隆,图4A),2个单克隆株为含有小鼠Y染色体的嵌合细胞(GAPDH和SRY双阳性,称为Y型单克隆,图4B)。
2.5 临床宫颈癌组织中嵌合型肿瘤细胞的筛检和鉴定
通过对20例临床宫颈癌病理组织切片的PCR分析,我们在其中一例(5%,1/20)发现 TSPY基因扩增阳性(图5A)。此外,我们在 TSPY基因的扩增片段中发现1处有义突变[天门冬氨酸(GAC)突变为组氨酸(CAC),图5B]。

图4 精子与HeLa嵌合细胞的鉴定
3 讨论
精子与除卵细胞外的其他细胞的融合是一种奇特的生物学现象。我们推测相对于体细胞,精子可能更容易与肿瘤细胞发生融合,因为:①一些临床研究发现:相对于周边的正常组织,女性肺腺癌[10]和甲状腺癌[11]组织中存在更高比例的嵌合细胞;②肿瘤细胞与正常细胞的膜结构有很大差别,这主要表现为细胞膜糖蛋白、糖脂、黏蛋白及胆固醇水平变化、结构异常及特殊修饰(如糖基化)程度的改变,最终导致肿瘤细胞膜荷电量显著升高,细胞间接触抑制消失;细胞膜流动性及通透性升高以及细胞表面蛋白水解酶浓度升高等[12-15];③整合素(integrin)和受精素的相互识别和作用是精卵细胞膜相互融合的必要条件,而多数肿瘤细胞表面高表达整合素,整合素能够激发跨膜转运信号,从而改变细胞膜局部细胞骨架结构及跨膜信号转导分子的活性,介导外源物质进入细胞内[16]。

图5 宫颈癌组织中 TSPY基因的扩增和测序
我们前期的研究结果建立了稳定的精子与肿瘤细胞体外融合模型,并证实了精子在体外可以与肿瘤细胞相互融合[9]。在本项研究中我们发现:精子与肿瘤细胞共培养的前1.5h, 残存的贴壁肿瘤细胞数急剧下降,此后残存的贴壁肿瘤细胞数未见显著变化(图1)。鉴于嵌合型肿瘤细胞离壁漂浮生长的特性,故可以认为精子与肿瘤细胞的融合事件大多发生于共培养的1.5 h内。而且精子与肿瘤细胞的融合率在很大程度上取决于肿瘤细胞的接种密度,随着细胞接种密度的升高,精子与肿瘤细胞的融合率呈现明显降低的趋势。我们认为这可能是因为较低的细胞密度增大了精子与肿瘤细胞膜的接触面积,使更多的精子有可能与肿瘤细胞膜相接触,从而增大了精子与肿瘤细胞融合的可能性[17]。更为重要的是我们的研究发现:精子与腺癌来源的肿瘤细胞的融合率显著高于其他类型肿瘤细胞和正常细胞(图3),这一研究结果与先前所报道的女性腺癌组织[9-10]相对于周边正常组织 有 较高的嵌合细胞比例相一致,而体外发现这一现象在国际上尚属首次。
利用显微操作及单克隆培养的方法我们获得了4个精子与HeLa细胞融合所形成的嵌合型单克隆细胞株,并进行了生物学鉴定(图4)。虽然以目前的研究方法我们尚不能确定嵌合型HeLa是由单个或者多个精子嵌合而成,但我们较为关注的是Y染色体编码的基因,尤其是具有原癌或者抑癌基因性质的基因在肿瘤细胞内的表达情况,从这点来说,我们获得的单克隆株足以胜任嵌合型肿瘤细胞生物学性质的相关研究。
虽然我们体外实验证实了精子与肿瘤细胞融合的可能性,但体内的实际情况往往更加复杂,那么在体内精子是否也可以和肿瘤细胞发生融合呢?我们的研究结果给出了肯定的答案。我们以20例宫颈癌蜡块标本为研究对象,体外扩增Y染色体特异编码的 TSPY基因,结果在1例标本中得到了阳性扩增产物,提示宫颈癌组织中嵌合型肿瘤细胞的存在。考虑到嵌合型肿瘤细胞只是肿瘤组织的一小部分,而我们的标本只是取自于一个蜡块标本,而且我们检测的只是含有Y染色体的嵌合细胞,含有X染色体的嵌合细胞的情况以目前的实验手段尚不能检出,因此,实际宫颈癌组织中嵌合细胞的比例应该远高于本次实验所得到的数据。此外我们发现检测到的宫颈癌组织中的 TSPY基因存在1处有义突变,该突变的发生是否会导致 TSPY这一具有原癌基因性质的基因表达蛋白量或者结构的变化,并进而导致肿瘤的恶化尚需进一步的实验验证。
结合我们前期 的 研究结果,我们以多种方式证实了精子与肿瘤细胞融合的可能性。而且我们证实:精子与肿瘤细胞的体外融合通常发生于共培养的1.5h内,较低的接种密度更有利于精子与肿瘤细胞的融合,而且腺癌来源的肿瘤细胞更容易与精子发生融合。
我们的体内研究提示精子有与宫颈癌细胞融合而形成嵌合型肿瘤细胞的可能,那么,这种新形成的肿瘤细胞将具有怎样特殊的、不同于融合前肿瘤细胞的性质?根据嵌合型体细胞所表现出的干细胞样特征和较高的迁移能力,我们推测嵌合型肿瘤细胞应该具有除恶性表型外的干细胞样特征和较高的迁移能力,即肿瘤干细胞样特征和更高的转移能力。如果这样,无回避措施的性生活将成为宫颈癌患者病情进展的危险因素。因此,嵌合型肿瘤细胞单克隆株生物学特性的研究将为宫颈癌患者能否进行无回避措施的性生活提供实验依据。
[1]SAWICKI W,KOPROWSKI H.Fusion of rabbit spermatozoa with somatic cells cultivated in vitro[J].Exp Cell Res,1971,66(1):145-151.
[2]BENDICH A, BORENFREUND E, STERNBERG S S.Penetration of somatic mammalian cells by sperm[J].Science,1974,183(4127):857-859.
[3]HIGGINS PJ,BORENFREUND E,BENDICH A.Appearance of foetal antigens in somatic cells after interaction with heterologous sperm[J].Nature,1975,257(5526):488-489.
[4]VANMEEL F C,PEARSON P L.Do human spermatozoa reactivate in the cytoplasm of somatic cells?[J].J Cell Sci,1979,35:105-122.
[5]KHOSROTEHRANI K,JOHNSON K L,CHA D H,et al.Transfer of fetal cells with multilineage potential to maternal tissue[J].JAMA,2004,292(1):75-80.
[6]MIKHAILM A,M'HAMDI H,WELSHJ,et al.High frequency of fetal cells within a primitive stem cell population in maternal blood[J].Hum Reprod,2008,23(4):928-933.
[7]KHOSROTEHRANI K,BIANCHI D W.Multi-lineage potential of fetal cells in maternal tissue:a legacy in reverse[J].J Cell Sci,2005,118(Sup8):1559-1563.
[8]KHOSROTEHRANI K,REYES R R,JOHNSON K L,et al.Fetal cells participate over time in theresponse to specific types of murine maternal hepatic injury[J].Hum Reprod,2007,22(3):654-661.
[9]陈强,靳广毅,林桂森,等.精子与肿瘤细胞融合模型的建立[J].癌变·畸变·突变,2018,29(3):144-149.
[10]O'DONOGHUE K,SULTAN H A,AL-ALLAF F A,et al.Microchimeric fetal cells cluster at sites of tissue injury in lung decades after pregnancy[J].Reprod Biomed Online,2008,16(3):382-390.
[11] CIRELLO V,RECALCATIM P,MUZZAM,et al.Fetal cell microchimerism in papillary thyroid cancer:a possiblerole in tumor damage and tissuerepair[J].Cancer Res, 2008,68(20):8482-8488.
[12] DOBRZYŃSKAI,SZACHOWICZ-PETELSKA B ,SULKOWSKI S,et al.Changes in electric charge and phospholipids composition in human colorectal cancer cells[J].Mol Cell Biochem,2005,276(1/2):113-119.
[13]SZACHOWICZ-PETELSKA B,DOBRZYŃSKA I,FIGASZEWSKI Z,et al.Changes in physicochemical properties of human large intestine tumor cells membrane[J].Mol Cell Biochem,2002,238(1/2):41-47.
[14]HOLLINGSWORTHM A,SWANSON BJ.Mucins in cancer:protection and control of the cell surface[J].Nat Rev Cancer,2004,4(1):45-60.
[15]DOBRZYŃSKA I,SZACHOWICZ-PETELSKA B,DAREWICZ B,et al.Characterization of human bladder cell membrane during cancer t ransformation[J].JMembr B iol,2015,248(2):301-307.
[16]CABODI S,DEL PILAR CAMACHO-LEALM,DI STEFANO P,et al.Integrin signaling adaptors:not only figurants in the cancer story[J].Nat Rev Cancer,2010,10(12):858-870.
[17]MATTIOLIM,GLORIA A,MAURO A,et al.Fusion as theresult of sperm-somatic cell interaction[J].Reproduction,2009,138(4):679-687.

