QHF复方对人肝癌Huh7细胞生长、侵袭及肿瘤干细胞表面标志物表达的影响
刘丹,焦良波,张文,王心怡,陈涛,胡卫,*
(1.三峡大学医学院国家中医药管理局中药药理/肿瘤科研三级实验室,湖北宜昌443002;2.三峡大学附属第二人民医院,湖北宜昌443002;3.宜昌市第二人民医院,湖北宜昌443002)
原发性肝癌(primary hepatic carcinoma,PHC)是我国最常见的恶性肿瘤之一,虽然近年来各种疗法层出不穷,但由于肝癌的高转移和复发率,其5年生存率极低[1]。肿瘤干细胞(cancer stem cells,CSCs)学说认为 , CSCs是导致肿瘤复发、转移及耐药性的关键所在[2-3]。因此,针对肿瘤干细胞的治疗有望成为根除肝癌的有效治疗方法之一。近年来中医药以其独特的辨证论治理论和“治未病”的防治特点,在控制肿瘤转移方面已凸显其优势[4]。本课题组前期研究发现中药QHF复方能抑制肝癌细胞的增殖,并能明显抑制肝癌的转移和复发[5],但对于QHF复方抑制肝癌细胞生长的机制尚不清楚,故本实验将在细胞水平上探讨QHF复方对Huh7细胞生长、凋亡、侵袭及肝癌干细胞表面标记物的影响,以期为探讨QHF复方防治肝癌提供新的思路与方法。
1 材料与方法
1.1 主要材料
人肝癌Huh7细胞株购自中国科学院上海生命科学研究院。华蟾素注射液购自安徽金蟾生化股份有限公司;人参皂苷Rg3标准品和胰蛋白酶均购自上海源叶生物科技有限公司;香菇多糖购自南京泽朗植提技术有限公司;注射用血塞通(冻干)购自昆明制药集团股份有限公司;DMEM培养基购自美国Gibco公司;胎牛血清购自美国Sigma公司。
1.2 实验方法
1.2.1 QHF复方配制参考文献[5],将华蟾素、人参皂苷Rg3、三七总皂苷、香菇多糖按一定的比例进行配制。
1.2.2 细胞增殖实验分为溶剂对照组(细胞培养孔内加入不含血清的DMEM高糖培养基)、阳性对照组[加入2.5μg/mL顺铂(DDP,用不含血清的DMEM培养基配制)]和QHF复方处理的实验组,实验组每孔分别加入不同浓度(20、40、80、160、320μg/mL,用不含血清的DMEM培养基配制)的QHF复方悬液100μL,培养24、48、72h,药物作用终止前4h,于每孔中各加入5 mg/mLMTT20μL,继续培养4h后,吸弃孔内培养基,每孔加入150μL DMSO,摇床上振荡10min,使紫色结晶充分溶解。于酶标仪上检测各孔 光 密度D(570)值。按下式计算药物对肿瘤细胞的增殖抑制率。
细胞增殖抑制率=[溶剂对照组 D (570)值-实验组 D (570)值]/[溶剂对照组 D(570)值-空白组 D(570)值]×100%
1.2.3 细胞侵袭实验溶剂对照组与阳性对照组给药方法同前,实验组选用QHF 复方的80μg/mL用于后续实验。取饥饿4h的对数生长期细胞,用含0.2%胎牛血清蛋白(BSA)的无血清DMEM 培养基重悬细胞,取100 μL(7×104/mL)细胞悬液加入Transwell小室的上室中,各组加药100μL。下室中加入600μL含10%B S A的DMEM高糖培养基,24h后,吸弃小室内的培养基,用棉签轻轻擦去膜内表面的细胞,4%多聚甲醛固定1h,结晶紫染色30min,清水冲洗,揭下滤膜,放在载玻片上于200倍光镜下观察滤膜外的细胞,随机选择5个视野进行细胞计数,计算平均值。
1.2.4 细胞周期检测实验分组及给药剂量同1.2.3。取生长相近并处于对数生长期的细胞,各组细胞给药培养48h后,胰酶消化制成单细胞悬液,离心弃上清,PBS洗涤并用冰乙醇固定后用预冷的PBS漂洗离心,使用10μL RNA酶(10g/L)处理后,加入荧光染料溴化丙锭溶液490μL,避光染色30min,300目尼龙膜过滤后采用流式细胞仪检测细胞周期。
1.2.5 细胞凋亡检测细胞分组及前期处理同1.2.4,各组细胞给药培养48h后,用不含EDTA的胰酶消化制成单细胞悬液,离心弃上清,加入100μL结合缓冲液和FITC标记的Annexin-V(20μg/mL)10μL,室温避光30 min,再加入PI(50μg/mL)5μL,避光反应5min后,加入400μL结合缓冲液,采用流式细胞仪检测细胞凋亡。
1.2.6 细胞表面标志物CD133和CD44的检测细胞分组及前期处理同1.2.4,各组细胞给药培养48h后,胰酶消化制成单细胞悬液,离心后弃上清,80μL PBS悬浮,加入藻红蛋白(PE)标记的抗体10μL,室温暗处孵育30min。加FcR阻断剂20μL,缓冲液80μL,充分混合后避光,4℃放置10min,PBS洗涤,重悬,离心去上清,加500μL PBS重悬细胞,上机分析细胞表面标记物CD133和CD44的表达情况。
1.3 统计学方法
实验重复3次, 采用SPSS19.0统计软件进行分析。计量资料以x±s表示,多组间比较采用单因素方差分析。以α =0.05为检验水准。
2 结果
2.1 QHF复方对Huh7细胞增殖的影响
与DDP组比较,不同浓度(20、40、80、160和320 μg/mL)QHF复方在各时间点均能抑制Huh7细胞增殖,且抑制作用随药物浓度的增加而增强,但抑制作用均低于DDP组(P均<0.05)。见表1。根据QHF复方对肝癌Huh7细胞抑制作用具有时间和剂量依赖性,且在QHF为 8 0μg/mL时,作用效率更强,故选用QHF复方的80 μg/mL用于后续实验。

表1 QHF 复 方对人肝癌细胞系Huh7细胞增殖抑制率的影响(%,-x±s)
2.2 QHF复方对Huh7细胞侵袭的影响
80μg/mL QHF组和DDP组(阳性对照组)穿透滤膜进入下室的Huh7细胞数目均低于溶剂对照组,且QHF组细胞数目低于DDP组,差异均具有统计学意义(P均<0.05)。见图1。
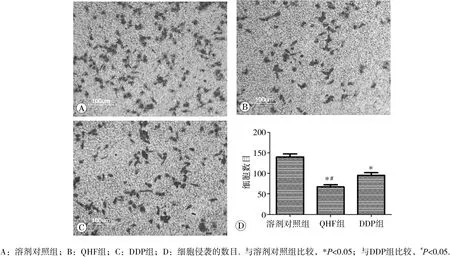
图1 QHF 复 方对人肝癌 H uh7细胞侵袭能力的影响
2.3 QHF复方对Huh7细胞周期的影响
与溶剂对照组比较,阳性对照DDP组和80μg/mL QHF组G0/G1期的细胞比例均减少,S期的比例均增加,DDP组G2/M期的细胞比例明显增多而QHF组G2/M期的比例减少,差异均有统计学意义(P均<0.05)。见 图 2 和表2。

图2 QHF复方对人肝癌细胞系Huh7细胞周期的影响
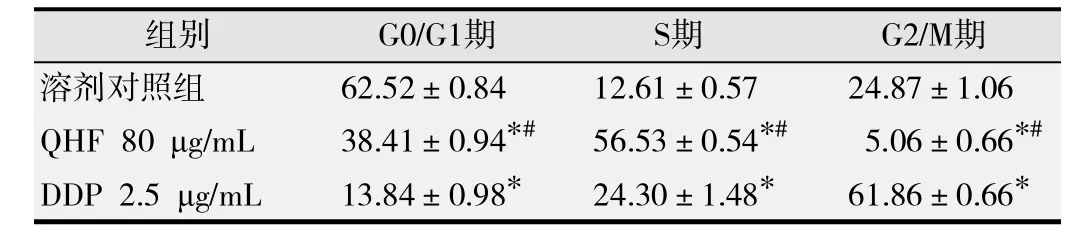
表2 QHF复方对人肝癌细胞系 H uh7细胞周期的影响(%,-x±s)
2.4 QHF复方对Huh7细胞凋亡的影响
与溶剂对照组比较,QHF组和DDP组凋亡细胞比例明显增高,且QHF组细胞凋亡比例明显高于DDP组,差异均具有统计学意义(P均<0.05)。见图3和表3。
2.5 QHF复方对Huh7细胞表面标志物CD133和CD44表达的影响
流式细胞术检测结果见表 3,QHF组表达CD133+和CD44+细胞比例较溶剂对照组明显降低,差异均具有统计学意义(P<0.05);阳性对照DDP组表达CD133+和CD44+细胞比例与溶剂对照组相比,差异无统计学意义(P>0.05)。
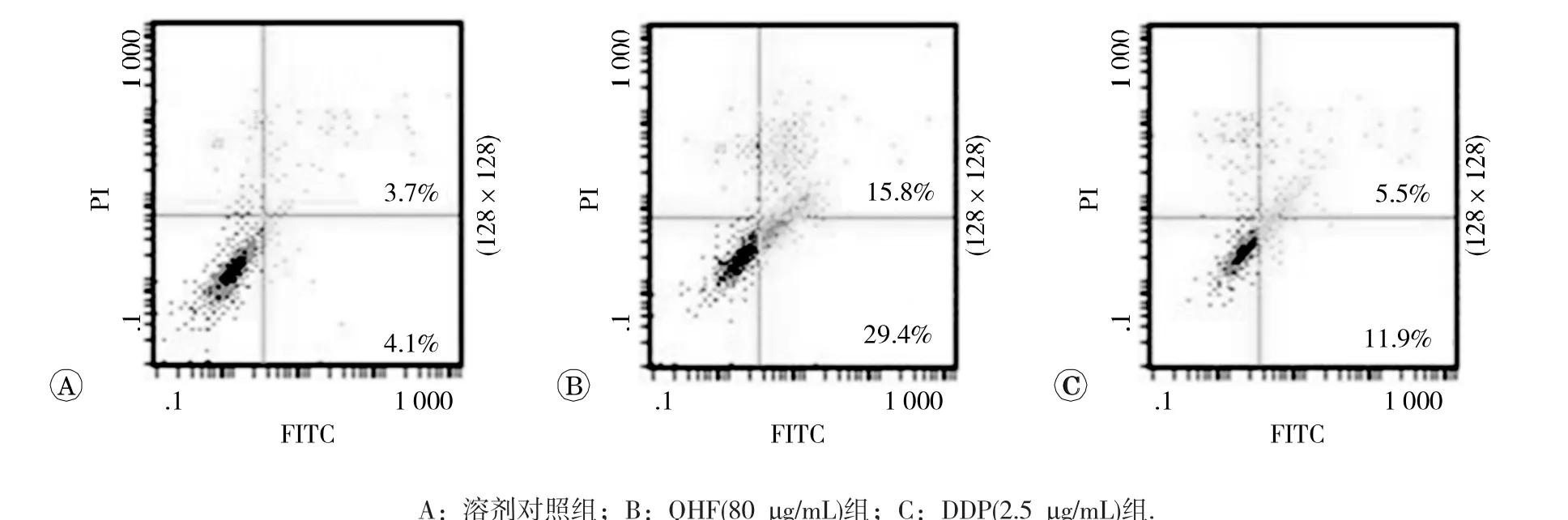
图3 QHF复方对人肝癌细胞系Huh7细胞凋亡的影响
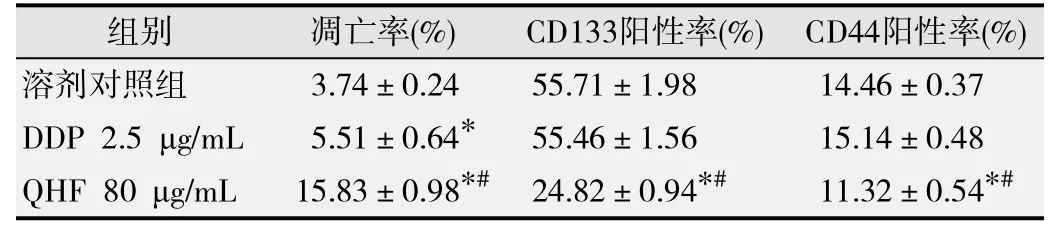
表3 QH-F 复 方对人肝癌细胞系 H uh7 细 胞凋亡率和 C D133、 C D44表达的影响(x± s)
3 讨论
CSCs在肿瘤的发生、发展和放化疗抗性中发挥着十分重要的作用。Reya等[6]提出的“肿瘤干细胞学说”认为:在肿瘤组织中存在一种数量较少的干细胞样癌细胞亚群,具有癌细胞和干细胞的特性,是肿瘤形成的起始细胞,在肿瘤形成、生长和转移中起决定作用,这种细胞称为肿瘤干细胞。随后的研究表明肝癌中也存在肝癌干细胞(liver cancer stem cells,LCSCs),而且肝癌的高复发和高转移性与LCSCs有关[7-8]。目前发现CSCs表面标记物有CD133、CD24、CD44、CD166和EpCAM等,其中CD133、CD44是最常见的标记物[9-10]。CD133是一种跨膜糖蛋白,是经典的CSCs标志分子,表达CD133+的肝细胞具有肿瘤干细胞的特征:即高克隆性、成瘤性及对放化疗的抗性[11]。另有研究显示,肝癌术后复发、预后不良与CD133+细胞表达密切相关[12]。Song等[13]实验研究也证实CD133在肝癌治疗中发挥核心作用。CD44是一种细胞表面蛋白,最先被认为是淋巴细胞受体[14],也是透明质酸的主要表面受体[15],不少研究结果显示CD44能调节或加强抗凋亡蛋白作用而在CSCs中具有重要意义[16]。
课题组前期实验发现QHF复方能显著提高肝癌H22荷瘤小鼠的生存期[17],可抑制肝癌HepG2细胞迁移、侵袭能力及血管内皮生长因子(VEGF)、基质金属蛋白酶-2(MMP-2)的表达[18],但对于该复方是否是通过下调肝癌干细胞表面标记物的表达来发挥抗肝癌作用的尚不清楚。因此本实验选用高表达CD133的人肝癌Huh7细胞[13,19]为研究对象,初步探讨QHF复方对肝癌干细胞的影响。结果显示,QHF复方能抑制人肝癌Huh7细胞的增殖、侵袭,使细胞周期阻滞在S期,并促进Huh7细胞的凋亡,显著下调肝癌干细胞表面标记物CD133和CD44的表达,使CD133+和CD44+细胞比例明显降低。这些结果提示QHF复方能够影响人肝癌Huh7细胞周期、促进细胞凋亡,从而抑制细胞的生长、侵袭,这种抑制作用可能是由于QHF复方对肿瘤干细胞具有抑制作用,但是也不排除肿瘤干细胞分化成了其他细胞,或者只是抑制了CD133和CD44的表达。因此,下一步拟分离出CD133+和CD44+肝癌干细胞,进一步研究该复方对干细胞活性(如增殖、耐药、体内成瘤等方面)的影响,探究QHF复方可能的抗肝癌干细胞的作用机制。
[1]FORNER A,LLOVENTJM,BRUIXJ.Hepatocellular carcinoma[J].Csh PerspectMed,2012,366(1):92-93.
[2]SHEKHANIM T,JAYANTHY A S,MADDODI N,et al.Cancer stem cells and tumor transdifferentiation:implications for novel therapeutic strategies[J].AmJStem Cells,2013,2(1):52-61.
[3]YAMASHITA T,WANG X W.Cancer stem cells in the development of liver cancer[J].J Clin Invest,2013,123(5):1911-1918.
[4]贺珊,廖长秀.中药治疗肝癌机制的研究进展[J].中成药,2017(1):155-160.
[5]CHEN T,LI D,FUY L,et al.Screening of QHF formula for effective ingredients from Chinese herbs and its anti-hepatic cell cancer effect in combination with chemotherapy[J].ChinMedJ,2008,121(4):363-368.
[6]REYA T,MORRISON SJ,CLARKEM F,et al.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105-111.
[7]TSUCHIYA A, KAMIMURA H, TAMURAY, et al.Hepatocellular carcinoma with progenitor cell features distinguishable by the hepatic stem/progenitor cell marker NCAM[J].Cancer Lett,2011,309(1):95-103.
[8]AOKI R,CHIBA T,MIYAGI S,et al.The polycomb group gene product Ezh2regulates proliferation and differentiation of murine hepatic stem/progenitor cells[J].J Hepatol, 2010,52(52):854-863.
[9]SLOMIANYM G,DAI L,TOLLIVER L B,et al.Inhibition of functional hyaluronan-CD44interactions in CD133-positive primary human ovarian carcinoma cells by small hyaluronan oligosaccharides[J].Clin Cancer Res,2009,15(24):7593-7602.
[10]ZHAOY,FENG F,ZHOUY N,et al.Stem cells in gastric cancer[J].WorldJGastroenterol,2015,21(1):112-118.
[11]PIAO L S,HUR W,KIM TK,et al.CD133+liver cancer stem cells modulateradioresistance in human hepatocellular carcinoma[J].Cancer Lett,2012,315(2):129-137.
[12]GIAMPIERI R,SCARTOZZIM,LORETELLI C,et al.Cancer stem cell gene profile as predictor of relapse in high risk stage II anDStage III,radically resected colon cancer patients[J].PLoSOne,2013,8(9):16-17.
[13]SONGY,JANGJ,SHIN TH,et al.Sulfasalazine attenuates evading anticancer response of CD133-positive hepatocellular carcinoma cells[J].J Eep Clin Canc Res,2017,36(1):38-45.
[14]GALLATIN WM,WEISSMANIL,BUTCHER EC.A cellsurface molecule involved in organ-specific homing of lymphocytes[J].Nature,1983,304(5921):30-36.
[15]ARUFFO A,STAMENKOVIC I,MELNICKM,et al.CD44 is the principal cell surfacereceptor for hyaluronate[J].Cell,1990,61(7):1303-1313.
[16]ISHIMOTO T,NAGANO O,YAE T,et al.CD44variant regulates redox status in cancer cells by stabilizing the xCTsubunit of system xC and thereby promotes tumor growth[J].Cancer Cell,2011,19(3):387-399.
[17]CHEN T,LI D,LING F,et al.In vivo and in vitro effects of QHF combined with chemotherapy on hepatocellular carcinoma[J].JBR,2010,24(2):161-168.
[18]王泉,陈涛,王晶,等.中药复方QHF抑制人肝癌HepG2细胞转移的实验研究[C].第九次全国中西医结合基础理论研究学术研讨会,2013.
[19]MA K.Identification and characterization of tumorigenic liver cancer stem/progenitor cells[J].Gastroenterology,2007,132(7):2542-2556.

