白藜芦醇对肺癌紫杉醇耐药细胞的增殖抑制作用及其机制
吴异兰,王晗
(1. 福建中医药大学护理学院,福建福州350122;2. 福建医科大学附属协和医院肿瘤科,福建福州350001)
在中国,肺癌的发病率和死亡率均居恶性肿瘤的首位[1],其中80%以上为非小细胞肺癌(non-small cell lung cancer,NSCLC),70%左右的NSCLC患者在就诊时已失去了手术治疗的机会,化疗是治疗晚期NSCLC的主要手段。紫杉醇是治疗NSCLC的有效药物之一[2],但其疗效受到耐药问题的影响[3]。白藜芦醇(resveratrol,Res)不但能对人类的鼻咽癌、肺癌、食管癌、胃癌、肝细胞癌、乳腺癌、前列腺癌、甲状腺癌、表皮癌及白血病等多种肿瘤细胞产生抑制作用[4-7],还可通过诱导凋亡增强耐药细胞对化疗药物的敏感性[8]。但白藜芦醇对肺癌紫杉醇耐药性的作用国内外鲜有报道,本研究通过建立人肺腺癌紫杉醇耐药细胞A549/Taxol-R,观察白藜芦醇作用后A549/Taxol-R细胞对紫杉醇敏感性的改变,并检测凋亡相关蛋白的表达,探讨白藜芦醇影响A549/Taxol-R细胞紫杉醇敏感性的分子机制。
1 材料与方法
1.1 主要材料和试剂
人肺腺癌细胞A549,购于中国科学院上海细胞生物研究所;白藜芦醇(98%,HPLC)购于西安赛德公司,紫杉醇购于美国百时美施贵宝公司,Ham’s F12培养基、胎牛血清购于美国HyClone公司,DMSO、MTT购于美国Sigma公司,Annexin V-FITC/PI凋亡试剂盒购于凯基生物公司,细胞培养瓶、培养板购于美国Corning公司,兔抗人 β-actin单抗、兔抗人Caspase-3 单抗、兔抗人Bcl-2单抗、兔抗人Bax单抗购于美国Cell Signaling Technology公司,羊抗兔二抗购于上海碧云天生物技术有限公司。
1.2 方法
1.2.1 人肺腺癌紫杉醇耐药细胞A549/Taxol-R的构建在含有10%胎牛血清的 H am’s F12培养基中培养人肺腺癌细胞A549,并置于37℃、CO2体积分数为5%的培养箱中备用。参考Sun等[9]的方法,用含有低浓度紫杉醇(初始浓度为10ng/mL)的培养液干预细胞,在浓度递增的作用下,连续培养10个月,直到细胞能于含紫杉醇的培养液中长期稳定生长后将细胞冻存,2个月后复苏,细胞仍维持在含紫杉醇培养液中稳定生长的能力,初步构建A549/Taxol-R细胞。
1.2.2 人肺腺癌紫杉醇耐药株A549/Taxol-R的鉴定绘制A549/Taxol-R细胞和人肺腺癌细胞A549的生长增殖曲线,并按Patterson公式计算二者不同的细胞群体倍增时间(doubling time, tD) , tD= tC× lg2/(lgNt - lgNo),其中 No指初始细胞数, Nt指终末细胞数, tC指培养的时间(h)。另用MTT药敏实验计算A549/Taxol-R的耐药指数(R I值)。 R I=I C50(A549/Taxol-R)/I C50(A549)。通过以上方法鉴定是否成功构建A549/Taxol-R细胞。
1.2.3 MTT法将A549/Taxol-R细胞悬液按5×104/mL分别等量接种于96孔板,将培养板置于37℃、CO2体积分数为5%的培养箱中培养。24h后更换含不同浓度(5、10、20、50、100、200μmol/L)白藜芦醇的培养基,每个浓度再分为3组,每组设8个复孔。测定时间点分别为继续培养24、48、72h后,同时以DMSO为对照组。在各组测定时间点每孔加入5mg/mL的MTT20 μL,继续孵育4h,吸弃培养液加入DMSO,在酶标仪上测定其在490nm处的吸光度 D (490)值,取其平均值计算细胞抑制率,观察白藜芦醇对A549/Taxol-R细胞的影响。细胞存活率=[D( 4 90)实验组/ D(490)对照组]×100%;细胞抑制率=[1-D( 4 90)实验组/ D(490)对照组]×100%。用上述方法备板及MTT方法观察不同浓度(5、10、20、50、100μmol/L)白藜芦醇处理A549/Taxol-R 细胞24h后,紫杉醇对各处理组细胞的 IC50,判断白藜芦醇对A549/Taxol-R细胞紫杉醇敏感性的影响。
1.2.4 流式细胞术检测细胞凋亡实验分为4组,分别为空白对照组、20μmol/L白藜芦醇组、2.5μg/mL紫杉醇组、2.5μg/mL紫杉醇+20μmol/L白藜芦醇联合组。分别处理A549/Taxol-R细胞24h后用0.25%胰酶消化细胞,800r/min离心5min,弃上清液后用预冷的4℃ PBS洗涤细胞2次,充分去除胰酶和EDTA的干扰,重悬细胞,调节细胞浓度至约1×106/mL,按照说明用无染色细胞为存活细胞,Annexin V-FITC/PI试剂盒进行染色。室温下避光孵育15min,加入Bingding Buffer,上机检测。实验结果判读:无染色细胞为存活细胞,Annexin V单染细胞为早期凋亡细胞,Annexin V、PI双染细胞为晚期凋亡或坏死细胞,PI单染细胞为机械性损伤细胞(实验操作过程误差)。
1.2.5 Western blot检测凋亡相关蛋白Bax、Bcl-2和Caspase-3的表达实验分组同1.2.4,分别处理A549/Taxol-R细胞24h后,收集细胞,提取总蛋白,BCA试剂盒定量。上样同样质量总蛋白后电泳、转膜、封闭,一抗4℃振摇孵育过夜,二抗室温孵育2h后用ECL显色系统显影,凝胶成像系统扫描曝光后的胶片,用ImageJ软件分析图片中条带灰度值。实验重复3次。
1.3 统计学处理
使用SPSS 19.0统计学软件进行分析。计量资料以表示,多组之间均数比较使用单因素方差分析,MTT试验中 IC50值(95%可信区间)使用Probit回归分析。检验水准 α=0.05。
2 结果
2.1 成功构建人肺腺癌紫杉醇耐药株A549/Taxol-R
体外细胞生长增殖曲线显示,A549/Taxol-R细胞较其亲本细胞增殖速度有所减慢,细胞群体倍增时间有所延长,由(31.66±0.57)h增加到(36.46±1.09)h,但仍符合肿瘤细胞增殖特征。经MTT实验测得紫杉醇对A549的 IC50为(1.58±0.45)μg/mL,紫杉醇对A549/Taxol-R的 IC50为(18.00±4.71)μg/mL, R I值为11.4,属于中度耐药[10],符合实验要求。
2.2 白藜芦醇不同浓度和干预时间对A549/Taxol-R细胞抑制率的影响
MTT试验检测结果见图1,可见随着浓度的提高和作用时间的延长,白藜芦醇对A549/Taxol-R细胞的抑制率上升,白藜芦醇对A549/Taxol-R细胞的抑制率具有浓度效应和时间效应(P均<0.05)。白藜芦醇3个不同干预时间(24、48和72h)对A549/Taxol-R细胞的 IC50值分别为55.7、39.2、29.5μmol/L。

图1 不同时间和浓度的白藜芦醇对 A 549/Taxol-R细胞的影响
2.3 白藜芦醇提高A549/Taxol-R细胞对紫杉醇的敏感性
MTT检测结果(图2)显示,随着白藜芦醇浓度的提高 (5、 10、 20、 50、 100μmol/L), 紫 杉 醇 对 A549/Taxol-R细胞的IC50值下降,分别为(17.50±1.24)、(13.40±1.12)、(9.39±0.97)、(6.36±0.80)和(4.18±0.62)μg/mL,即A549/Taxol-R细胞对紫杉醇敏感性上升。

图2 紫杉醇对不同浓度白藜芦醇处理组 A 549/Taxol-R细胞的IC50
2.4 白藜芦醇和紫杉醇联合干预对A549/Taxol-R细胞凋亡的影响
根据2.3实验结果,选择2.5μg/mL的紫杉醇和20 μmol/L的白藜芦醇用于后续细胞凋亡研究。流式细胞仪检测结果见表1,由仪器自动计数细胞得出各亚群细胞比例,依照试剂盒说明书进行实验结果判读。白藜芦醇和紫杉醇联合干预组的A549/Taxol-R早期凋亡率、晚期凋亡率+坏死率均高于紫杉醇单独干预组,白藜芦醇和紫杉醇联合干预组的细胞存活率低于紫杉醇单独干预组(P 均<0.05)。

表1 白藜芦醇-和紫杉醇联合干预对 A 549/Taxol-R细胞凋亡率和坏死率的影响(%,x±s)
2.5 白藜芦醇和紫杉醇联合干预对凋亡相关蛋白Bax、Bcl-2和Caspase-3的表达的影响
Western blot结果显示,白藜芦醇和紫杉醇联合处理组与单独使用紫杉醇组相比,Bax、Caspase-3的表达明显上调,而Bcl-2的表达明显下调。见图3和表2。
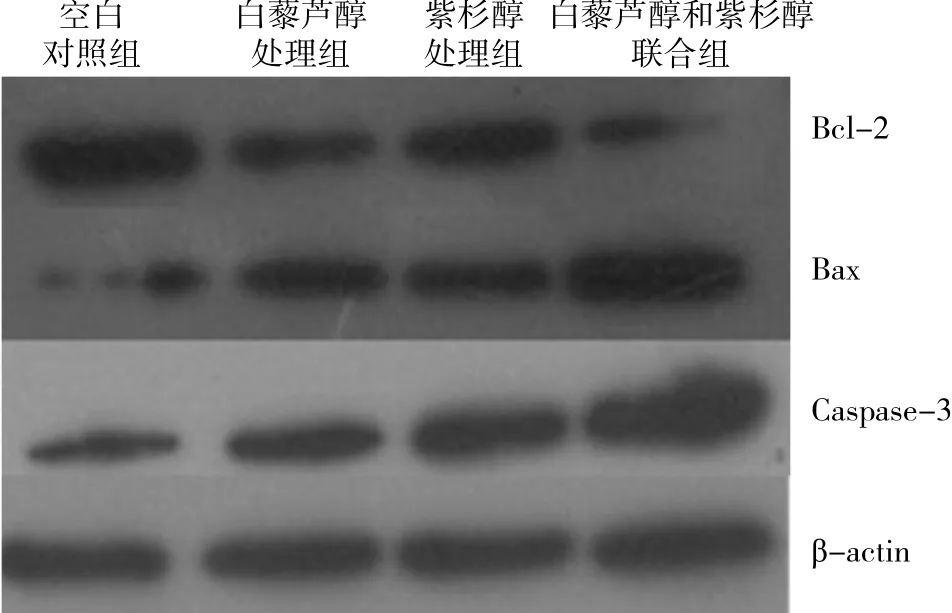
图3 凋亡相关蛋白 B ax、 B cl-2 和C aspase-3的表达
3 讨论
目前有大量研究表明白藜芦醇可诱导多种肿瘤细胞凋亡[11],并通过抑制细胞色素P450酶、诱导解毒酶、抑制环氧酶2、干扰细胞周期、抑制血管合成、抗核转录因子NF-κB和促进肿瘤细胞凋亡和分化等途径对肿瘤的起始、促进和进展3个阶段起到抑制作用[12]。 因此可推测,白藜芦醇可通过诱导A549/Taxol-R细胞凋亡逆转其对紫杉醇的耐药性,本研究进一步证实了这一观点。
Bcl-2家族、Caspase家族在细胞凋亡过程中起到重要的作用。 B cl-2基因可以通过抑制细胞凋亡,延长细胞寿命来促进肿瘤的发生[13]。Bcl-2的过表达可通过抑制细胞色素C等从线粒体的释放来抑制Caspase-3 的活化,而Caspase-3同时又是Bcl-2的生理性蛋白酶[14]。Bax也属于 B cl-2基因家族,是重要的促凋亡蛋白,未激活时存在于胞浆中,诱导凋亡时活化的Bax 移位至线粒体建立膜通道,促使线粒体释放细胞色素C和其他的促凋亡因子,激活Caspase家族蛋白使细胞凋亡,Bcl-2基因则参与调控这一过程[15-16]。 B cl-2 基因与Bax基因表达产物的比例对于细胞最终是否进入细胞凋亡程序极为重要,而Caspase-3则是细胞凋亡终末途径的效应蛋白,其活性受到两者调控[17-18]。
课题组前期的体外研究也证明了白藜芦醇不但能够抑制胃癌细胞株的增殖[19],而且能诱导其发生凋亡[20];体内研究证实了白藜芦醇能够诱导裸鼠胃癌移植瘤细胞的凋亡作用,并且与上调Bax和下调Bcl-2表达有关[21]。白藜芦醇诱导细胞凋亡的效应也被证实受Caspase-3活性决定,同时还受到Bax、Bcl-2调控[21]。
本研究中观察到 , 白藜芦醇和紫杉醇联合干预组相较于单独使用紫杉醇组,细胞的早期凋亡率、晚期凋亡率或坏死率均升高,其Bax、Caspase-3的表达明显上调,而Bcl-2的表达明显下调。说明白藜芦醇可能通过促进细胞的凋亡及坏死来提高A549/Taxol-R细胞对紫杉醇的敏感性,其机制可能通过促进Bax、Caspase-3的表达, 下调Bcl-2的表达而实现。
由于白藜芦醇在植物中分布十分广泛而且含量较高,故白藜芦醇对非小细胞肺癌耐药的影响作用研究,不但可望降低NSCLC的耐药性,提高化疗药物的治疗效果,节约医疗资源,提高人群的健康水平,同时也可促进含白藜芦醇的天然植物资源的开发利用,其应用和发展前景十分广阔,具有良好的社会效益和经济效益。
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China2015[J].CA CancerJClin,2016,66(2):115-132.
[2]BOCCI G,DI PAOLO A,DANESI R.The pharmacological bases of the antiangiogenic activity of paclitaxel[J].Angiogenesis,2013, 16 :4 8 1- 4 92.
[3]MILANE L,DUAN Z,AMIJIM.Development of EGFR-targeted polymer blend nanocarriers for combination paclitaxel/lonidamine delivery to treat multi-drug resistance in human breast and ovarian tumor cells[J].Mol Pharm,2011,8(1):185-203.
[4]GUERRERO R F,GARCIA-PARRILLAM C,PUERTAS B,et al.Wine,resveratrol and health:a review[J].Nat Prod Commun,2009,4(5):635-658.
[5]BOSCOLO P,DEL SIGNORE A,SABBIONI E,et al.Effects of resveratrol on lymphocyte proliferation and cytokinerelease[J].Ann Clin Lab Sci,2003,33(2):226-231.
[6]ATHARM,BACKJH,KOPELOVICH L,et al.Multipe molecular targets of resveratrol:Anti-carcinogenic mechanisms[J].Arch Biochem Biophys,2009,486(2):95-102.
[7]KUNDUJK,SURHYJ.Cancer chemopreventive and therapeutic potential of resveratrol:mechanistic perspectives[J].Cancer Lett,2008,269(2):243-261.
[8]AL-ABD AM,MAHMOUD AM,EL-SHERBINY G A,et al.Resveratrol enhances the cytotoxic profile of docetaxel and doxorubicin in solid tumour cell lines in vitro[J].Cell Prolif,2011,44:591-601.
[9]SUN Q L,SHA H F,YANG X H,et al.Comparative proteomic analysis of paclitaxel sensitive A549lung adenocarcinoma cell line and its resistant counterpart A549-Taxol[J].J Cancer Res Clin Oncol,2011,137(3):521-532.
[10]SNOW K,JUDD W.Characterisation of adriamycin-and amsacrine-resistant human leukaemic Tcell lines[J].BrJCancer,1991,63(1):17-28.
[11]FULDA S,DEBATIN KM.Resveratrol-mediateDSensitization to trail-induced apoptosis depends on death receptor and mitochondrial signaling[J].EurJCancer,2005,41(5):786-789.
[12]JANGM,CAI L,UDEANI G O,et al.Cancer chemopreventive activity of resveratrol,a natural product derived from grapes[J].Science,1997,275(5297):218-220.
[13]SCHINDLER C K, SHINODA S, SIMON R P, et al.Subceller distribution ofBcl-2family protein and14-3-3within the hippocampus during seizure-induced neuronal death in therat[J].Neurosci Lett,2004,356(3):163-166.
[14]WANG H,WANG H,LIANGJ,et al.Cell-penetrating apoptotic peptide /p53DNA nanocomplexas adjuvant therapy for drug-resistant breast cancer[J].Mol Pharm,2014,11:3352-3360.
[15]REEDJC.Proapoptotic multidomain Bcl-2/Bax family proteins: mechanisms, physiological roles, and therapeutic opportunities[J].Cell Death and Differ,2006,13:1378-1386.[16]CHENJH,CAOJL,CHUY L,et al.T-2toxin-induced apoptosis involvingFas, p53, Bcl-2, Bax and caspase-3 signaling pathways in humanchondrocytes[J].Zhejiang Univ Sci B,2008,9:455-463.
[17]SONJK,VARADARAJAN S,BRATTON S B.TRAIL-activateDStress kinases suppress apoptosis through transcriptional upregulation ofMCL-1[J].Cell Death Differ,2010,17(8):1288-1301.
[18]RUDNERJ,JENDROSSEK V,LAUBER K,et al.TypeIand type II reactions in TRAIL-induced apoptosis—results from dose-response studies[J].Oncogene,2005,24(1):130-140.
[19]郑国华,李会庆.大蒜油和白藜芦醇联合应用对胃癌细胞抑制作用及其机制[J].福建中医学院学报,2006,16(6):34-36.
[20]郑国华,李颢,李会庆.大蒜油和白藜芦醇联合应用诱导胃癌细胞凋亡[J].中国公共卫生,2005,21(10):1205-1207.
[21]郑国华,吴异兰,谌海英.白藜芦醇对裸鼠移植瘤bcl-2与bax基因表达影响[J].中国公共卫生,2011,27(8):996-998.

