肉苁蓉苯乙醇总苷抗肝癌作用的实验研究
胡琼,由淑萍,刘涛, *,汪波,刘昕,蒋远东
(1.新疆医科大学公共卫生学院,新疆乌鲁木齐830011;2.新疆医科大学护理学院,新疆乌鲁木齐830011)
肉苁蓉(cistanche)主产于新疆、内蒙古阿拉善盟,素有“沙漠人参”之美誉,具有极高的药用价值,是中国传统的名贵中药材[1]。始载于《神农本草经》,被列为上品,其味甘、咸,性温,具有补肾阳、益精血、润肠通便的作用,常用于治疗男子阳痿、女子不孕、腰膝冷痛、血枯便秘等症[2]。国内学者对肉苁蓉的化学成分进行了大量的研究,包括苯乙醇总苷(phenylethanol glycosides from cistanche,CPhGs)、环烯醚萜类、木脂素类、多糖、生物碱等,其中最主要的成分为CPhGs[3-4],现代药理研究表明CPhGs具有抗菌、抗炎、抗病毒、抗肿瘤、抗氧化、免疫调节、增强记忆、助阳等多种药理活性,同时课题组成员前期对CPhGs进行的大量研究表明CPhGs具有抗肝纤维化的作用[5-7]。本实验用肉苁蓉药材中分离得到的CPhGs,研究其对肝癌H22荷瘤小鼠的抗肝癌作用,旨在为CPhGs的抗肝癌作用机制及相关健康产品及药品的开发提供依据。
1 材料与方法
1.1 受试物及实验动物
肉苁蓉苯乙醇总苷(CPhGs)由新疆药物研究所赵军研究员提取分离并鉴定,纯度为70%[8],试验时用0.5%羧甲基纤维素钠(0.5%CMC-Na)溶解,配制成不同浓度,4℃保存,1周内使用。
SPF级昆明种小鼠,雄性,60只,体质量18~22 g,购自新疆医科大学实验动物研究中心,合格证号为SCXK(新)2016-0002,使用许可证号 为 SYXK(新)2016-0003。
1.2 细胞株
小鼠H22肝癌细胞株,由武汉普诺赛生命科技有限公司提供,货号CL-0341。
1.3 仪器及主要试剂
低速离心机(70L-5-A型,上海安亭);CO2培养箱(Heal Force,HF240);电热恒温水槽(DK-8D,上海一恒科技有限公司);酶标仪(Bio-rad);游标卡尺(上海将来实验设备有限公司);电子天平(常州万泰天平仪器有限公司)。
肝复乐为康普药业股份有限公司产品(国药准字Z20060389);RPMI-1640培养基和1%双抗(以色列BI公司);胎牛血清(Gibco,美国);0.4%台盼蓝和4%多聚甲醛(北京索莱宝);小鼠肿瘤坏死因子 α( TNF- α)、白介素2(IL-2)、甲胎蛋白(AFP)ELISA试剂盒(武汉华美)。
1.4 试验方法
1.4.1 肝癌H22荷瘤小鼠模型的建立于37℃复苏H22细胞,离心弃上清,加入新鲜RPMI-1640完全培养基重悬细胞快速复苏,体外培养活细胞达95%以上,至细胞密度达1×106/mL时接种于小鼠腹腔,每只0.2mL。约8~l0d传代一次。无菌抽取培养至8d左右的小鼠腹腔H22瘤液,生理盐水稀释调整瘤细胞数为l×107/mL,充分混匀,备用。除空白对照组在同部位注射等量生理盐水外,其余各组小鼠经消毒后,于其前肢右侧腋下接种H22瘤细胞悬液,每只0.2 mL[9-10],造模24h后每天观察瘤体生长情况。
1.4.2 分组及给药随机将上述造模的H22荷瘤小鼠分为5组,分别为模型组,阳性治疗组(肝复乐1351.5 mg/kg)[11],CPhGs高(500mg/kg)、中(250mg/kg)、低(125 mg/kg)剂量组,每组10只。于造模24h后开始灌胃给药,除空白对照组和模型组给予同体积的0.5%CMCNa溶液外,其余各组分别按照给定剂量灌胃给予阳性药物或CPhGs,连续10d[12-13]。期间每天观察荷瘤小鼠精神活动状态、右腋膨隆大小及出现时间、毛色及食欲等情况。末次给药24h后,称质量,摘眼球取血,分离血清备用;颈椎脱臼法处死小鼠,分离脾脏、肝脏,称质量,计算肝脾系数;完整剥取瘤体,滤纸拭干净后称质量,计算各组小鼠的肿瘤抑制率;瘤体组织行病理组织学检测。
1.4.3 检测指标①脾脏和肝脏系数测定:各组小鼠处死后分别剪取脾脏和肝脏并称质量,计算脏器系数,脏器系数=脏器质量/小鼠体质量×100%。②瘤质量及抑瘤率测定:末次给药24h后,颈椎脱臼法处死小鼠并称体质量,完整剥取瘤体,用滤纸擦拭干净后置电子天平上称瘤质量,根据瘤质量计算各给药组小鼠的肿瘤抑制率,抑癌率=(模型组瘤质量-实验组瘤质量)/模型组瘤质量×100%。③摘眼球取血后,分离血清-80℃保存待检。按ELISA试剂盒说明书检测血清中IL-2、TNF-α和AFP含量。④肿瘤组织病理学检查:各组瘤体用4%多聚甲醛固定24h后,石蜡包埋切片,常规HE染色,在光镜下观察肿瘤组织病理学改变,以肿瘤细胞坏死的面积大小初步判定CPhGs药物的治疗效果。
1.5 统计学方法
应用SPSS17.0软件进行统计分析,各组数据结果以表示,以单因素方差分析进行多组 间 数据比较,检验水准 α=0.05。
2 结果
2.1 小鼠的一般情况观察
给药前,各组间小鼠体质量差异均无统计学意义(P>0.05)。模型组在试验过程中由于灌胃操作有2只小鼠死亡。给药后,与空白对照组比较,模型组小鼠体质量随肿瘤的生长而增加,但差异无统计学意义(P>0.05);与模型组比较,阳性治疗组和CPhGs各剂量组小鼠体质量均有一定的下降,但差异无统计学意义(P>0.05)。试验第4d开始,小鼠腋下开始出现膨隆,动物精神活动状态变差,对外界刺激反应迟钝,食欲减退,毛色变暗淡。模型组最先出现肿瘤块,且生长速度最快,以上反应最明显,CPhGs低、中剂量组次之,高剂量组和阳性治疗组肿瘤生长较慢,生存质量较好,未见明显的不良反应(见表1)。
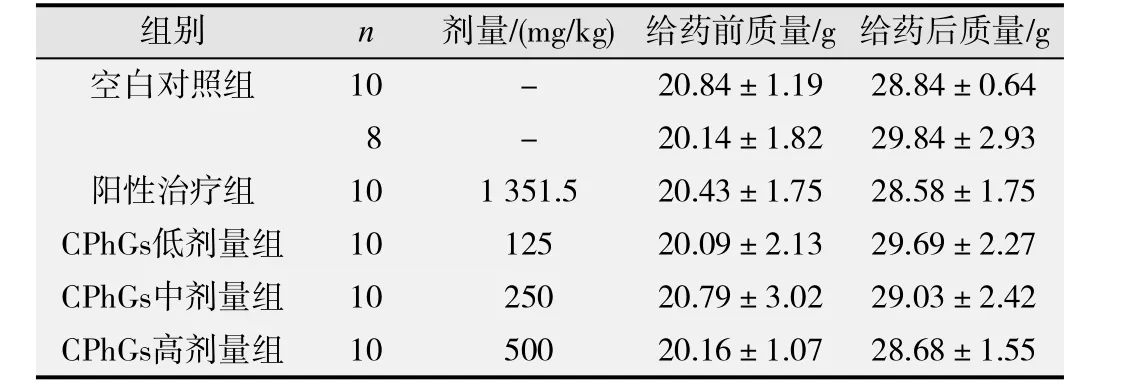
表1 肉苁蓉CPhGs对H22荷瘤小鼠体质量的影响(-x±s)
2.2 肉苁蓉CPhGs对H22荷瘤小鼠脾脏和肝脏系数的影响
表2结果显示,与空白对照组相比,模型组脾脏系数明显减少、肝脏系数明显增大(P均<0.01);与模型组比较,阳性治疗组、CPhGs各剂量组脾脏系数明显增大、肝脏系数明显降低(P均<0.01),表明CPhGs可在一定程度上提高荷瘤小鼠的免疫功能,抑制肝脏受损。
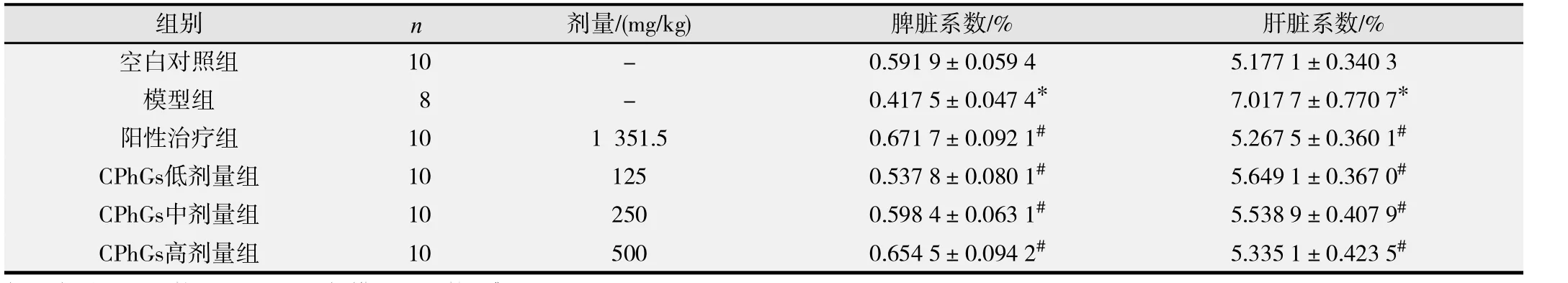
表2 肉苁蓉 C PhGs对 H 22荷瘤小鼠脏器系数的影响(-x± s)
2.3 肉苁蓉CPhGs对H22荷瘤小鼠瘤体生长的影响
表3结果显示,与模型组比较,阳性治疗组与CPhGs中、高剂量组H22荷瘤小鼠瘤质量明显下降,差异具有统计学意义(P均<0.01),阳性治疗组及CPhGs中、高剂量组肿瘤抑制率分别为56.91%、52.97%和35.80%。
2.4 肉苁蓉CPhGs对H22荷瘤小鼠血清IL-2、TNF-α和AFP含量的影响
由表4可见,与空白对照组比较,模型组TNF-α和AFP含量显著增加,差异均具有统计学意义(P均<0.05);与模型组比较,阳性治疗组与CPhGs中、高剂量组IL-2含量均明显增加(P均<0.05);阳性治疗组和CPhGs各剂量组TNF-α含量均明显减少(P<0.05);阳性治疗组与CPhGs中、高剂量组AFP含量均明显下降(P<0.05);CPhGs高剂量组IL-2含量、TNF-α含量及AFP含量与阳性治疗组更接近,但差异无统计学意义(P>0.05)。提示肉苁蓉CPhGs可促进IL-2的表达,抑制TNF-α与AFP的表达,且高剂量组效果更好。

表3 肉苁蓉CPhGs对H22荷瘤小鼠瘤体生长的影响(-x±s)
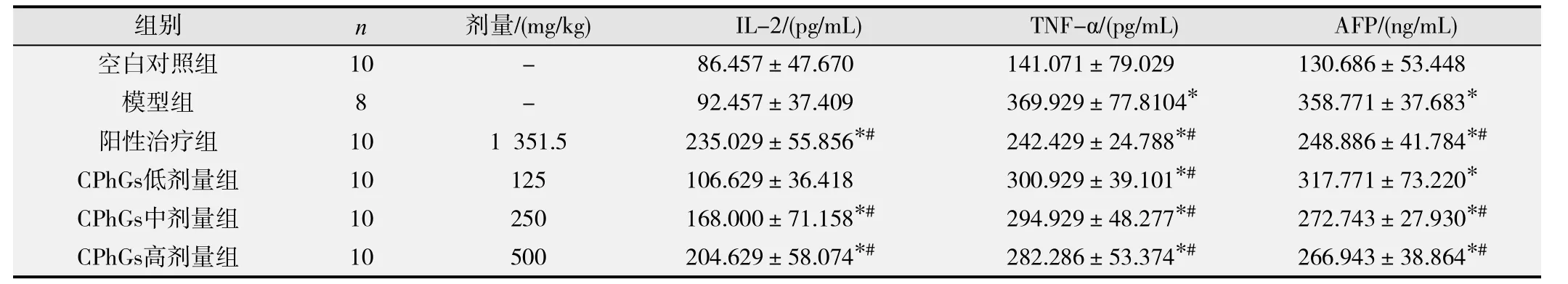
表4 肉苁蓉CPhGs对H22荷瘤小鼠血清IL-2、TNF-α和AFP含量的影响(-x±s)
2.5 肿瘤组织病理学观察
大体可见:模型组瘤体较大,表面颜色淡红,质地较软,与周围组织分界较清楚,剖面渗血较多。CPhGs各剂量组肿瘤组织边缘区毛细血管明显减少,肿瘤瘤体较小,表面灰白,质地较韧,剖面灰白,中央区可见坏死,切面渗血较少。
光镜HE染色(图1)可见:模型组荷瘤小鼠的癌组织中,有大量的肿瘤细胞,细胞排列紧密,细胞核着色均匀,形态清晰,细胞间质较少。与模型组相比较,给药组肿瘤组织中细胞数明显减少,形态不规则,异质性降低,细胞核破碎,并伴有大量细胞坏死,坏死周边有大量的炎细胞浸润(包括中性粒细胞、淋巴细胞和浆细胞,如图中箭头所示),且高剂量组CPhGs肿瘤细胞坏死区域出现肉芽组织的修复,其中CPhGs不同剂量组随着给药剂量的增加,肿瘤细胞的坏死面积也在增大,而CPhGs高剂量组与阳性治疗组有相当量的肿瘤细胞坏死,因此,可以初步判断CPhGs对H22肝癌荷瘤小鼠具有良好的治疗效果。

图1 CPhGs对肝癌荷H22 瘤 小鼠的治疗效果(H E染 色,× 2 00)
3 讨论
原发性肝癌是一种临床上常见的恶性肿瘤,占我国肿瘤发病率的第4位,死亡率的第2位[14],其防治仍是我国目前研究的热点问题。传统中药在控制患者病情发展、改善症状体征及提高生存质量等方面的优势日渐显现,为从我国中药中寻找低毒、高效的抗肝癌作用的药物,本课题采用H22肝癌细胞制备H22荷瘤小鼠肿瘤模型,将不同剂量的CPhGs处理组与模型对照组和肝复乐阳性治疗组进行比较,探索CPhGs对H22荷瘤小鼠体内抗肿瘤的作用及其机制。
结果显示,模型组最先出现腋下肿瘤膨隆且生长最快,小鼠精神状态变差、食欲下降、毛色开始暗淡等反应,CPhGs低、中剂量组次之,高剂量组和肝复乐阳性治疗组较慢,且CPhGs各剂量组小鼠体质量和肝复乐阳性治疗组均无明显的下降,提示CPhGs药物可以相对改善H22荷瘤小鼠的生存质量、降低肿瘤对机体的毒性。CPhGs各剂量组、肝复乐阳性治疗组瘤质量均明显低于模型对照组,且高剂量组肿瘤抑制率与肝复乐阳性治疗组相当,提示CPhGs对H22荷瘤小鼠体内肿瘤具有一定的抑制作用,另外,本研究结果显示,肝复乐阳性治疗组和CPhGs各剂量组的脾脏系数均高于模型组,而肝脏系数均低于模型对照组,提示CPhGs在发挥抑制肿瘤作用的同时在一定程度上提高了荷瘤小鼠的免疫功能且对肝脏也有保护作用,但对脾脏及肝脏的作用与肝复乐无明显差异。
IL-2是免疫系统中的一类细胞生长因子,参与细胞免疫,在机体复杂免疫网络中起中心调节作用,能够通过促进T细胞增殖和分化等作用提高机体的免疫机能,并能产生具有抗肿瘤活性的免疫细胞。研究发现IL-2可促进淋巴因子激活的杀伤细胞的存活、扩增及活化,这种细胞是淋巴细胞与IL-2接触后产生的一种具有高效抗肿瘤细胞的杀伤细胞,且这种杀伤细胞只识别肿瘤抗原,对宿主正常细胞无影响[15-16]。本实验结果显示,CPhGs高、中剂量组可显著提高小鼠IL-2的含量,表明CPhGs可增强H22荷瘤小鼠的免疫能力,有利于机体杀伤肿瘤细胞。
TNF-α是迄今为止所发现的直接抗肿瘤作用最强的生物活性因子之一[17-18]。TNF通过与受体结合诱导肿瘤细胞凋亡、增强宿主免疫功能、作用肿瘤血管内皮细胞,导致血管功能紊乱,继而引起肿瘤出血坏死等途径来发挥抗肿瘤作用[19],但TNF-α在肿瘤中表现出两重性,既可致肿瘤坏死,也可促肿瘤的生长[20-21]。在正常机体内TNF-α的浓度较低,具有抑制肿瘤细胞增殖、促进肿瘤细胞血管形成血栓而发生出血坏死、增强机体抗肿瘤免疫功能等作用;同时TNF作为一个内源性的肿瘤促进因素,由肿瘤细胞本身产生的TNF-α可以刺激肿瘤细胞生长,并抑制免疫效应细胞对肿瘤细胞的毒性作用;因此,TNF-α的生物学作用与其体内的水平高低密切相关。本实验中发现,与正常组比较,模型组TNF-α明显升高,这与肿瘤的TNF-α升高一致,CPhGs各剂量组小鼠TNF-α水平显著下降,表明CPhGs具有抑制H22荷瘤小鼠血清中TNF-α异常升高的作用,抑制肿瘤的发生。
正常情况下,AFP主要来自胚胎的肝细胞,胎儿出生后约两周AFP从血液中消失,因此正常成年人血清中AFP的含量尚不到20μg/mL[22]。在成人,AFP可以在大约80%肝癌患者血清中升高[23]。当人肝细胞发生癌变时,其恢复产生AFP这种蛋白的功能,而且随着病情恶化它在血清中的含量也会急剧增加。AFP作为诊断原发性肝癌的一个特异型临床指标,血清AFP浓度通常与肝癌大小呈正相关[24]。本实验结果显示CPhGs高、中剂量组可显著降低小鼠AFP的含量,表明CPhGs能够抑制H22荷瘤小鼠血清中AFP的表达,抑制肿瘤的生长。
HE染色可见,与模型组比较,CPhGs能明显促进肿瘤细胞凋亡,使肿瘤细胞生长受抑制,瘤细胞异质性降低,并伴有大量细胞坏死,其中CPhGs不同剂量组随着给药剂量的增加,肿瘤细胞的坏死面积也在增大,而CPhGs高剂量组与肝复乐阳性治疗组有相当量的肿瘤细胞坏死,提示CPhGs对H22肝癌荷瘤小鼠具有良好的抑瘤效果。
综上,CPhGs具有良好的抗肝癌作用,可能与CPhGs降低荷瘤小鼠血清中AFP含量及提高荷瘤小鼠免疫能力有关。本研究为利用肉苁蓉中CPhGs成分开发新的抗肝癌药物提供了基础数据。
[1]彭芳,徐荣,王夏,等.肉苁蓉属药材加工炮制研究进展[J].中国现代中药,2015,17(4):406-412.
[2]钟耀欣.解读《神农本草经》32[J].开卷有益(求医问药),2015,35(8):40-41.
[3]刘雄,李成明,高建德,等.肉苁蓉的研究进展[J].中国中医药科技,2013,20(5):575-576.
[4]耿惠杰,于光恩.肉苁蓉属植物的开发与利用[J].天津科技,2012,21 (4):66-68.
[5]由淑萍,赵军,马龙,等.肉苁蓉乙醇提取物抗大鼠免疫性肝纤维化的作用及其机制[J].中国药理学与毒理学杂志,2016,30(5):504-510.
[6]木克热木· 土地买提,由淑萍,赵军,等.肉苁蓉苯乙醇苷类成分对BSA致大鼠肝纤维化影响的实验研究[J].新疆医科大学学报,2015,38(5):567-570.
[7]由淑萍,赵军,木克热木·土地买提,等.肉苁蓉苯乙醇苷类成分对BSA诱导的肝纤维化大鼠转化生长因子β1表达的影响[J].癌变·畸变· 突变,2015,27 (6):409-414.
[8]由淑萍,赵军,马龙,等.肉苁蓉苯乙醇总苷对大鼠肝星状细胞TGF-β1/Smad信号通路表达的影响[J].癌变· 畸变· 突变,2016,28 (5):372-376.
[9]张建武,蒲其松,陈斗佳,等.阿司匹林-烟酰胺-锌络合物荷H22肝癌小鼠作用的研究[J].四川生理科学杂志,2012,34(4):148-149.
[10]沈蓓蓓.葵灵化积煎对小鼠H22肝癌细胞的抑瘤作用及对C-myc、nm23-H1表达的影响[D].大连:大连医科大学,2013:8-9.
[11]郝明志,陈武进,林海澜,等.肝动脉栓塞化疗联合肝复乐胶囊治疗晚期肝癌临床疗效观察[J].中南药学,2013,11(2):147-150.
[12]郭圣奇,黄挺章,李远辉,等.薏苡茎水提取物对H22荷瘤小鼠的抗肿瘤作用研究[J].中国临床药理学杂志,2015,31(10):855-857.
[13]张文娟,蒋伟哲,蓝献丽,等.五谷虫提取物对H22肝癌细胞荷瘤小鼠的抗肿瘤机制研究[J].广西医学,2017,39(2):215-219.
[14]叶胜龙.2013年肝癌领域新进展[J].中华肝脏病杂志,2014,22(1):2-4.
[15]刘晓蕊,王健.细胞因子诱导的杀伤细胞抗肿瘤的临床应用进展[J].广东医学,2016,37(18):2840-2843.
[16]宋浩杰.低剂量化疗联合基因修饰的树突状细胞疫苗治疗肝癌的实验研究[D].广州:南方医科大学,2012.
[17]左绍远,钱金 栿 ,方淑环,等.红花蜂花粉多糖抗肿瘤活性研究[J].医药前沿,2014,4(1):42-43.
[18]倪洋.紫草多糖对S180荷瘤小鼠免疫器官及细胞因子TNF-α和IFN-γ的影响[J].黑龙江医药,2014,27(3):512-514.
[19]古翠萍,张沂平.TNF-α抗肿瘤作用机制新进展[J].中国肿瘤,2007,16(2):102-105.
[20]朱波,张伟,陈艳华,等.肿瘤特异性生长因子及肿瘤坏死因子在肝癌诊断和预后中的应用[J].现代肿瘤医学,2008,16(5):765-766.
[21]林玉.蜘蛛香环烯醚萜类抗肝癌作用及其机制初步研究[D].成都:西南交通大学,2015.
[22]王仕模,胡永浩,李强,等.AFP水平与原发性肝细胞癌手术患者预后的相关分析[J].中华肝胆外科杂志,2017,23(2):134-136.
[23]宋巍.联合检测血清AFP、AFU、GP73及IL-8在原发性肝癌诊断中的临床意义[J].中华临床医师杂志(电子版),2016,10(9):1266-1270.
[24]甘雨,于新发,周成宇,等.甲胎蛋白在原发性肝癌的诊断和预后判断中的临床价值[J].海南医学,2016,27(6):891-894.

