肥胖小鼠胰腺组织肿瘤相关基因突变频率的分析
王萍,刘冰峰,杨云风,蔡羽薇,谭娜,姚丽娟,罗燃燃,张果*
(华中科技大学同济医学院公共卫生学院毒理学系,湖北武汉430030)
在我国,随着癌症发病率和死亡率的逐年增加,癌症所造成的疾病负担正逐渐加重[1]。其中胰腺癌发病率也逐年升高。2015年我国胰腺癌发病率已经跃居至癌症发病率第9位,死亡率位列第6位[2]。同时,肥胖率在我国也呈增加的趋势。至2014年,中国的肥胖人数已位居全球首位[3]。
流行病学研究表明,肥胖是胰腺癌发生的潜在危险因素。研究发现随着腰围和腰臀比的增加,胰腺癌的相对危险度也增加[4]。与体质量正常的对照组相比,超重和肥胖者胰腺癌的发病年龄均显著提前,诊断胰腺癌后的生存期也显著缩短[5]。对于肥胖在胰腺癌发生发展中的作用,研究大多从肥胖导致的慢性炎症、胰岛素抵抗和高胰岛素血症等方面入手[6],而目前在基因组稳定性方面的研究尚少。在人类胰腺癌中经常可观察到癌基因 K ras,抑癌基因 Tp53、Smad4 等基因的突变[7-8]。在小鼠中,Kras突变与 Trp53或Smad4的缺失表现出胰腺导管腺癌的加速发展[9]。本研究利用小鼠模型探讨高脂食物诱导的肥胖与胰腺组织肿瘤相关基因突变之间的关系,从基因组稳定性这一层面探索肥胖与胰腺癌之间的关系,从而为研究肥胖与胰腺癌之间的关系提供新的线索,并且为胰腺癌的预防提供理论依据。
1 材料与方法
1.1 实验动物和饲料
C57BL/6雄鼠及普通饲料均购自北京华阜康生物科技股份有限公司。本研究经华中科技大学实验动物伦理委员会的批准。高脂饲料购自江苏美迪森生物医药有限公司,宏量营养素供能百分比为:碳水化合物20%,蛋白质20%,脂肪60%。脂肪的来源为90.7%猪油和9.3%大豆油。能量密度为5.24kcal/g。普通饲料宏量营养素供能百分比为:碳水化合物75.9%,蛋白质14.7%,脂肪9.4%。能量密度为3.85kcal/g。
1.2 主要仪器和试剂
体成分分析仪购自德国Bruker公司;甘油三酯、总胆固醇、低密度脂蛋白胆固醇测定试剂盒购自中生北控生物科技股份有限公司;高保真DNA聚合酶购自美国MCLab公司;兔抗Ki67购自英国Abcam公司;Trizol、 SYBR Green I试 剂 购 自 美 国 Thermo Fisher公司;逆转录试剂购自美国Progema公司;DNA测序由武汉擎科创新生物科技有限公司完成。
1.3 肥胖模型的建立和组织的收集
8周龄小鼠分为普通食物组50只和高脂食物组50只,分别用普通饲料和高脂饲料饲养,每组随机选取8只 , 每天称量进食量,最后计算每只小鼠24周的总进食量。饲养24周后利用体成分分析仪测量活体小鼠的脂肪和瘦组织质量,然后收集组织,称量肝脏和附睾脂肪的质量。组织保存于-80℃冰箱备用。
1.4 血浆甘油三酯、总胆固醇和低密度脂蛋白胆固醇的测定
小鼠禁食12h后,用抗凝毛细管在尾尖采血,500 g离心30min,取上层血浆,按照试剂盒说明书步骤在96孔板中设置标准曲线,每孔加入标准样品和待测样品各2µL,均设置2个重复。每孔加入工作液200µL,37℃反应10min。经酶标仪测得各样品在波长505 nm处的吸光度值。根据标准曲线计算出各样品的甘油三酯、总胆固醇和低密度脂蛋白胆固醇的浓度。
1.5 胰腺组织基因组DNA的提取
取25mg左右胰腺组织置于1.5mL离心管中。将组织剪碎后加入300µL裂解液[配方:6.7mmol/L Tris、1.66mmol/L (NH4)2SO4、0.67mmol/LMgCl2、0.5%Triton X-100、1%β-巯基乙醇],在95℃反应10min。冷却后加入30µmol/L的蛋白酶K(10mg/mL)于55℃反应3h,然后95℃温浴10min灭活蛋白酶K。冷却后,1200g离心10min取上清。
1.6 PCR扩增及测序
用Primer5软件针对小鼠 K ras基因第2外显子,Trp53基因第8外显子, S mad4第9外显子设计引物,用高保真DNA聚合酶扩增出高脂食物组小鼠胰腺的上述基因片段。扩增片段经切胶回收后由公司测序。测序结果用Vector NTI软件将测序得到的序列与NCBI中标准序列进行比对。为了避免序列两端测序的不稳定性,引物所扩增出来的片段都长于上述外显子片段,且对所有样本测序两次。同时,比对测序结果时,用Chromas软件检查测序峰图是否存在干扰峰。
1.7 免疫组化
Ki67是一种细胞增殖标志物,通过Ki67免疫组化检测胰腺细胞增殖活性。取小鼠胰腺组织,经Bouin’s固定液固定24h,然后用石蜡包埋并切片。切片经二甲苯脱蜡,100%、95%、75%酒精梯度复水,1×PBS洗涤后,在柠檬酸钠缓冲液中煮沸进行抗原修复。然后进行Ki67免疫组化:①1×PBS洗涤3次,每次5 min,滴加5%羊血清/0.3%Triton X-100室温封闭30 min。②去掉封闭液,滴加1∶100稀释的兔抗Ki67,4℃孵育过夜。③1×PBS洗涤3次,每次5min,然后滴加HRP标记的羊抗兔IgG,37℃孵育1h。④1×PBS洗涤3次,每次5min。滴加DAB显色液,室温反应5 min后蒸馏水冲洗终止反应,最后用苏木素染色液复染细胞核。⑤将玻片依次置于75%、95%、100%的酒精和二甲苯中各5min进行梯度脱水和透明。⑥中性树胶封片后用显微镜采集图像。
1.8 实时荧光定量PCR
取25mg左右胰腺组织置于1.5mL离心管,加入1 mL的Trizol提取总RNA。用逆转录试剂将RNA逆转录为cDNA,再用SYBR Green I试剂盒对胰腺组织Ki67的mRNA水平进行相对定量,用 G APDH作内参。引物序列见表1。
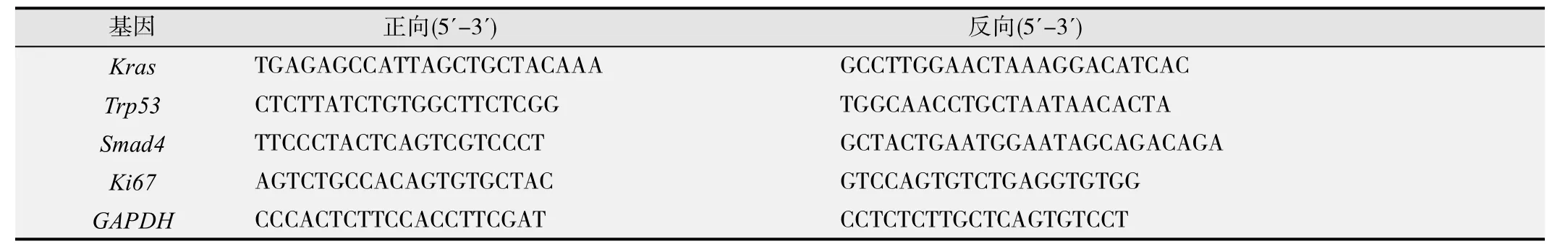
表1 引物序列
1.9 统计学方法
数据用SPSS19.0软件进行统计学分析。结果用-x±s表示。普通食物组和高脂食物组间体质量、体成分、血脂水平和胰腺组织Ki67mRNA水平的比较采用独立样本t检验进行分析。以 α=0.05为检验水准。
2 结果
2.1 高脂食物饲养引起小鼠肥胖和血脂异常
体质量、体成分和血脂水平的结果见图1。经24周高脂食物饲养的小鼠,其平均体质量显著高于普通食物组,且高脂食物组小鼠摄入单位质量饲料所增加的体质量远高于普通食物组(P<0.05),说明高脂饲料能显著诱导小鼠产生肥胖。体成分分析仪可根据氢原子的核磁共振信号强度和弛豫时间的差异,测量活体小鼠的脂肪和瘦组织质量。瘦组织主要包括肌肉和水分。结果显示,高脂食物组体脂质量、肝体比、附睾脂肪脂体比远大于普通食物组(P<0.05)。瘦组织质量在两组间无统计学差异。说明肥胖主要是由于体内脂肪的增加引起。此外,高脂食物组小鼠血浆甘油三酯、总胆固醇和低密度脂蛋白胆固醇的水平均显著高于普通食物组(P均<0.05)。

图1 普通食物组和高脂食物组小鼠的体质量、体成分和血脂水平
2.2 Kras基因在肥胖小鼠胰腺中存在突变
人和小鼠 K ras、 Trp53和Smad4的基因结构见图2A,本研究中扩增的小鼠胰腺 K ras、Tr p53 和 Smad4这3个基因序列所编码的多肽序列与人类该序列编码的多肽序列高度同源,氨基酸序列同源性分别达到100%、82%和98%。COSMIC数据库显示[10],人类这3个基因中, K ras基因第2外显子、 Tp53基因第8外显子和 S mad4基因第9外显子存在多个突变频率高的位点,因此本研究也选择性扩增相应序列。3个基因片段PCR产物的琼脂糖凝胶电泳结果见图2B,Kras、Trp53 和 Smad4基因的PCR产物长度分别为537、543和526bp。两次测序结果均显示,高脂食物组50个胰腺扩增样本中, K ras基因均有1个样本存在突变。突变位置为 K ras基因CDS序列的第96位碱基,由T突变为C(c.96T>C),为第32位密码子的同义突变(p.Tyr32Tyr),结果见表2。DNA测序峰图见图3,未检测到突变的样本,测序峰为单峰,检测到点突变的峰图由T峰和C峰共同构成,说明此DNA样本中存在以C为模板的序列。经小鼠基因组多态性检查,该位点不存在单核苷酸多态性。我们同时对50个普通食物组胰腺Kras样本进行了测序,但未发现任何突变。另外,高脂食物组胰腺中未检测出 Trp53和Smad4基因的突变。
2.3 高脂食物组小鼠胰腺细胞增殖活性升高
胰腺癌的主要病理类型为胰腺导管腺癌,多数学者认为其起源是胰腺内的导管细胞。细胞增殖标志基因 K i67免疫组化结果见图4A和4B,高脂食物组小鼠胰腺导管内可见多个阳性细胞(图4B,棕色,红色箭头示),远多于普通食物组。说明高脂食物组小鼠胰腺导管细胞增殖活性升高。为了进一步证实上述结果,利用qPCR对Ki67mRNA进行分析。结果见图4C,高脂食物组小鼠胰腺细胞Ki67mRNA表达水平较普通食物组明显升高(P<0.05)。
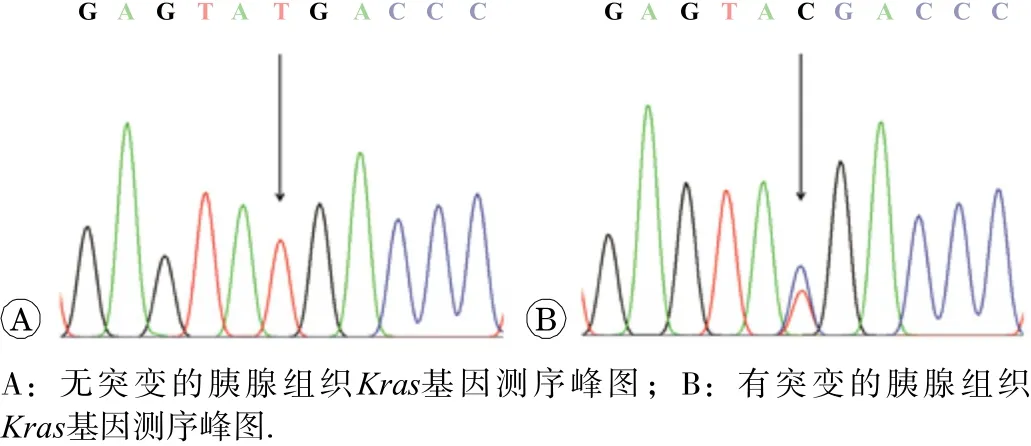
图3 小鼠 K ras基因测序峰图

图4 胰腺细胞增殖活性比较
3 讨论
胰腺癌恶性程度高,早期起病隐匿,缺乏有效的诊断依据。疾病进展快,许多患者就诊时已到晚期,预后极差。因此阐明胰腺癌的病因,对胰腺癌进行早期预防具有重要意义。
流行病学证据和实验性研究均提示肥胖可能与胰腺癌的发生发展相关[4-5,11-14],但其具体机制还未完全阐明。目前关于肥胖和胰腺癌的机制研究大部分侧重于代谢和激素方面。肥胖者体内常伴随多种激素和细胞因子的紊乱,可能促进肿瘤的发生。比如,肥胖者体内的高胰岛素可使胰岛素样生长因子1受体(IGF-1R)信号转导系统过度激活,进而激活其下游的磷脂酰肌醇激酶-蛋白激酶B(PI3K-AKT)和有丝分裂原活化蛋白激酶级联信号通路(Ras-Raf-MAPK)从而促进肿瘤的发生[15-18]。此外,肥胖人群体内的慢性炎症[6]、高瘦素[19]、高血糖[20]、低脂联素[21-22]和过氧化物酶体激活物受体增加[23]也可能促进肿瘤的发生。
肥胖促进胰腺癌的可能机制除了代谢和激素因素外,对基因组稳定性的影响也值得关注。有证据表明,肥胖者的基因组损伤增加并且其增加幅度与体质量指数成正相关[24]。肥胖导致的DNA损伤很可能与氧自由基相关。活性氧(reactive oxygen species,ROS)在各种疾病中的作用研究较多。氧化应激被认为是多种非传染性疾病如心血管疾病、神经退行性疾病和癌症等的诱发因素。肥胖者慢性、低水平炎症和ROS产生之间存在一定的关系,导致ROS相关的病理改变[25]。ROS可对核酸产生破坏作用。研究表明,热量限制减少细胞内ROS的形成[26]。长期的热量限制可降低癌症的发病率,延长不同动物模型的寿命[27]。总之,肥胖者很可能由于体内ROS的增加,而对其基因组稳定性产生影响。
本研究采用24周高脂食物饲养诱导小鼠发生肥胖,较长时间高脂饲养使小鼠体成分以及血脂都发生了显著的改变,符合肥胖者的生理状态。Ki67是一种与细胞有丝分裂相关的核抗原,只存在于分裂期细胞中。本研究中,高脂食物组小鼠Ki67mRNA水平明显高于普通食物组,说明其胰腺细胞增殖活性增加,而细胞的增殖失控正是癌细胞的基本特征之一。此外,Ki67免疫组化的结果显示,高脂食物组小鼠胰腺导管内可见多个阳性细胞,而目前多数学者认为胰腺导管细胞是胰腺导管腺癌的起源。
碱基突变是基因组损伤的一种常见形式。Kras,Tp53 与 Smad4是人胰腺癌中突变率最高的3个基因[10]。本研究中 K ras基因检测的序列是第2外显子,而该基因第12和13位密码子正是位于该检测序列中。大量研究显示胰腺癌中存在第12或13位密码子的突变[28-30]。本研究发现肥胖小鼠胰腺未见第12和13位密码子突变,而第32位密码子由TAT突变为TAC,突变频率为2%,其编码的氨基酸虽仍为酪氨酸,但提示肥胖可能对小鼠 K ras基因的稳定性产生了一定影响。COSMIC数据库显示[10], Tp53 和 Smad4这两个基因分别在第8和第9外显子有较高的突变频率,因此本研究中分别扩增了高脂食物组小鼠胰腺 Trp53 和 Smad4的第8和第9外显子,测序结果并未发现有突变位点。近期有研究显示在分离的胰腺上皮内瘤变样本中,仅仅检测到很少的Tp53 和 Smad4基因的改变,提示 Trp53 和 Smad4的失活可能是晚期遗传改变[31]。
综上所述,本研究结果表明,长时间高脂饲养使小鼠出现肥胖,其胰腺细胞增殖活性增加。肥胖小鼠胰腺组织存在 K ras的点突变,突变频率为2%。肥胖可能会增加胰腺组织中 K ras基因的不稳定性,从而起到促进胰腺癌发生、发展的作用。
[1]YANG G,WANGY,ZENGY,et al.Rapid health transition in China,1990-2010:findings from the Global Burden of Disease Study2010[J].Lancet,2013,381(9882):1987-2015.
[2]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in china,2015[J].CA CancerJClin,2016,66(2):115-132.
[3]COLLABORATION N C.Trends in adult body-mass index in 200countries from1975to2014:a pooled analysis of1698 population-based measurement studies with19.2million participants[J].Lancet,2016,387(10026):1377-1396.
[4]AUNE D,GREENWOOD D C,CHAN DS,et al.Body mass index, abdominal fatness and pancreatic cancer risk: a systematic review and non-linear dose-response meta-analysis of prospective studies[J].Ann Oncol,2012,23(4):843-852.
[5]LI D,MORRISJS,LIUJ,et al.Body mass index and risk,age of onset,anDSurvival in patients with pancreatic cancer[J].JAMA,2009,301(24):2553-2562.
[6]FONT-BURGADAJ, SUN B, KARINM.Obesity and cancer:the oil that feeds the flame[J].CellMetab,2016,23(1):48-62.
[7]IACOBUZIO-DONAHUE C A, VELCULESCU V E,WOLFGANG C L,et al.Genetic basis of pancreas cancer development and progression:insights from whole-exome and whole-genome sequencing[J].Clin Cancer Res, 2012,18(16):4257-4265.
[8]IACOBUZIO-DONAHUE C A.Genetic evolution of pancreatic cancer:lessons learnt from the pancreatic cancer genome sequencing project[J].Gut,2012,61(7):1085-1094.
[9]PEREZ-MANCERA P A,GUERRA C,BARBACIDM,et al.What we have learned about pancreatic cancer from mouse models[J].Gastroenterology,2012,142(5):1079-1092.
[10]FORBES S A,BEARE D,BOUTSELAKIS H.Catalogue of somatic mutations in cancer: Cosmic v83[DB/OL].2017,http://cancer.sanger.ac.uk/cosmic.
[11]KYRGIOUM,KALLIALA I,MARKOZANNES G,et al.Adiposity and cancer at major anatomical sites:umbrella review of the literature[J].BMJ,2017,356:j477.
[12]INCIOJ,TAMJ,RAHBARI N N,et al.PlGF/VEGFR-1 signaling promotes macrophage polarization and accelerated tumor progression in obesity[J].Clin Cancer Res, 2016,22(12):2993-3004.
[13]INCIOJ, LIU H, SUBOJ P, et al.Obesity-induced inflammation and desmoplasia promote pancreatic cancer progression and resistance to chemotherapy[J].Cancer Discov,2016,6(8):852-869.
[14]GALLAGHER EJ,LEROITH D.The proliferating role of insulin and insulin-like growth factors in cancer[J].Trends EndocrinolMetab,2010,21(10):610-618.
[15]SPENTZOS D,CANNISTRA S A,GRALL F,et al.IGF axis gene expression patterns are prognostic of survival in epithelial ovarian cancer[J].Endocr Relat Cancer,2007,14(3):781-790.
[16]HAILEYJ,MAXWELL E, KOUKOURAS K, et al.Neutralizing anti-insulin-like growth factor receptor1 antibodies inhibit receptor function and inducereceptor degradation in tumor cells[J].Mol Cancer Ther,2002,1(14):1349-1353.
[17]SACHDEV D,LI S L,HARTELLJS,et al.A chimeric humanizeDSingle-chain antibody against the typeIinsulin-like growth factor(IGF)receptor renders breast cancer cells refractory to the mitogenic effects of IGF-I[J].Cancer Res,2003,63(3):627-635.
[18]GOETSCH L, GONZALEZ A, LEGER O, et al.A recombinant humanized anti-insulin-like growth factor receptor typeIantibody(h7C10)enhances the antitumor activity of vinorelbine and anti-epidermal growth factor receptor therapy against human cancer xenografts[J].IntJCancer, 2005,113(2):316-328.
[19]RAY A,NKHATA KJ,CLEARYM P.Effects of leptin on human breast cancer cell lines in relationship to estrogen receptor and HER2status[J].IntJOncol,2007,30(6):1499-1509.
[20]LIU H,MA Q,LIJ.High glucose promotes cell proliferation and enhances GDNF and RETexpression in pancreatic cancer cells[J].Mol Cell Biochem,2011,347(1/2):95-101.
[21]WANGY,LAMJB,LAM K S,et al.Adiponectin modulates the glycogen synthase kinase-3beta/beta-catenin signaling pathway and attenuates mammary tumorigenesis ofMDA-MB-231cells in nude mice[J].Cancer Res,2006,66(23):11462-11470.
[22]TANG C H,LUM E.Adiponectin increases motility of human prostate cancer cells via adipoR,p38,AMPK,and NF-kappaB pathways[J].Prostate,2009,69(16):1781-1789.
[23]JACKSON L,WAHLI W,MICHALIK L,et al.Potential role for peroxisome proliferator activated receptor(PPAR)in preventing colon cancer[J].Gut,2003,52(9):1317-1322.
[24]DONMEZ-ALTUNTAS H,SAHIN F,BAYRAM F,et al.Evaluation of chromosomal damage,cytostasis,cytotoxicity,oxidative DNA damage and their association with body-mass index in obese subjects[J].Mutat Res Genet Toxicol EnvironMutagen,2014,771:30-36.
[25]FERNANDEZ-SANCHEZ A,MADRIGAL-SANTILLAN E,BAUTISTAM,et al.Inflammation,oxidative stress,and obesity[J].IntJMol Sci,2011,12(5):3117-3132.
[26]HEYDARI A R,UNNIKRISHNAN A,LUCENTE L V,et al.Caloric restriction and genomic stability[J].Nucleic Acids Res,2007,35(22):7485-7496.
[27]SPINDLER S R.Rapid and reversible induction of the longevity,anticancer and genomic effects of caloric restriction[J].Mech Ageing Dev,2005,126(9):960-966.
[28]BIANKIN A V,WADDELL N,KASSAHN K S,et al.Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes[J].Nature,2012,491(7424):399-405.
[29]KANDAM,MATTHAEI H,WUJ,et al.Presence of somatic mutations in most early-stage pancreatic intraepithelial neoplasia[J].Gastroenterology,2012,142(4):730-733.
[30]JONES S,ZHANG X,PARSONS D W,et al.Core signaling pathways in human pancreatic cancers revealed by global genomic analyses[J].Science,2008,321(5897):1801-1806.
[31]HOSODA W,CHIANCHIANO P,GRIFFINJF,et al.Genetic analyses of isolated high-grade pancreatic intraepithelial neoplasia(HG-PanIN)reveal paucity of alterations in TP53anDSMAD4[J].J Pathol,2017,242(1):16-23.

