SOX30基因调控桥粒基因DSC3抑制肺腺癌的增殖与迁移
马帮靖,郝翔麟,韩飞,陈洪强,刘晋祎,曹佳, *,张爱华,*
(1.贵州医科大学公共卫生学院毒理教研室,贵州贵阳550004;2.陆军军医大学军事预防医学系毒理学研究所,重庆400038)
肺癌是严重威胁人类健康和生命的恶性肿瘤,高居全球男性、发达国家女性癌症死亡率之首[1]。近年来,我国肺癌的发病率与死亡率已超越其他恶性肿瘤跃升至第1位[2-3]。目前,肺癌发生发展的分子机制尚不十分清楚,对其深入研究有利于改善肺癌的诊疗及预后。
SOX30基因属于SOX基因家族的H亚族,在雄性生殖系统发生发育及功能维持中起重要作用[4-5]。本课题组研究[6]发现, SOX30是肺癌中的新抑癌基因,通过转录激活p53抑制肺癌细胞增殖、诱导肺癌细胞凋亡,在肺腺癌中的高表达有利于患者预后[7]。最近发现SOX30能够抑制肺癌转移,但分子机制尚不清楚。因此,本研究利用基因表达谱数据功能富集分析、转录结合位点预测、TCGA数据库分析筛选SOX30调控的关键基因;通过差异表达细胞模型和基因敲除动物模型进一步验证相关基因的表达;采用平板克隆形成实验及划痕愈合实验分析相关基因在SOX30抑癌中的主要作用,为进一步研究 SOX30基因的作用及临床应用提供资料。
1 材料与方法
1.1 细胞株及其培养
A549细胞购自中国科学院上海生命科学研究院细胞资源中心,本实验室前期[6]已将SOX30表达载体转入A549细胞成功构建过表达SOX30的A549-SOX30稳定转染细胞系,这些细胞株均使用含10%胎牛血清的F-12K培养液,培养于37℃、CO2体积分数为5%的常规培养箱中,采用0.25%胰蛋白酶消化、传代,实验用细胞为对数生长期细胞。
1.2 SOX30基因敲除小鼠
SOX30基因敲除小鼠品系为C57BL6,委托南京大学模式动物研究所构建,于陆军军医大学实验动物中心(SPF级)饲养,由本实验室负责繁殖维护并利用PCR对新生小鼠基因型进行鉴定。
1.3 主要试剂及仪器
F-12K培养基、胰酶、胎牛血清均购自Gibco公司,总RNA提取试剂Trizol Reagent以及pcDNA6.2-GW/EmGFP-miR-DSC3miRNA干扰质粒购自Invitrogen公司, Via FectTMTransfection Reagent(E4982)转染试剂盒、GoScriptTM逆转录试剂盒(A5001)及2×Taq PCRMix购自Promega公司,杀稻瘟菌素(Blasticidin)购自Sigma公司,普通RT-PCR仪购自美国Bio-Rad 公 司,化学发光凝胶成像系统购自英国Syngene公司。
1.4 实验方法
1.4.1 SOX30蛋白调控基因功能富集分析基于我们前期获得的SOX30差异表达细胞系表达谱数据[6],使用Gene Spring Software11.0(Agilent Technologies,Santa Clara,CA,US)软件进行数据处理,采用两样本t检验筛选差异表达基因,显著差异表达基因 的 阈值设定为差异倍数≥2且 P <0.05,随后于网站http://www.geneontology.org/在线对差异基因进行基因功能富集分析(GO enrichment analysis),获得关联的主要通路及相关基因的功能。
1.4.2 DSC3启动子区SOX30蛋白结合位点预测采用JASPAR数据库(http://jaspar.binf.ku.dk/)在线预测DSC3(desmocollin3)启动子区SOX30蛋白结合位点。
1.4.3 临床标本数据来源及热图绘制肺癌组织中SOX30与 DSC3基因的表达数据于UCSC Xena(https://xenabrowser.net)下载,二者数据集ID均为TCGA.LUNG.sampleMap/HiSeqV2;通过提取并进行相应的数据匹配获得具有 SOX30、DSC3基因表达信息的肺癌及癌旁组织共1129例,其中肺腺癌及癌旁组织576例,肺鳞癌及癌旁组织553例。肺癌组织及癌旁组织中SOX30与DSC3基因的表达热图在网站https: //genome-cancer.ucsc.edu/proj/site/hgHeatmap/在线绘制。
1.4.4 DSC3miRNA干扰细胞模型的构建SOX30差异表达细胞模型来源于前期构建[6]的稳定表达pIRES2-EGFP-SOX30质粒(A549-SOX30)和对照质粒(A549-Vector)。按每孔3.0×105个细胞接种A549-SOX30于6孔板,37℃、CO2体积分数为5%条件下培养过夜;参照Via FectTMTransfection Reagent(E4982)转染试剂盒说明书配制pcDNA6.2-GW/EmGFP-miR-DSC3miRNA转染复合物,按每孔200μL分别加至6孔板中,摇匀后于37℃、CO2体积分数为5%的常规培养箱中继续培养,48 h后换用含3μg/mL杀稻瘟菌素的F-12K完全培养液筛选细胞,直至出现荧光阳性克隆;挑取荧光阳性克隆,扩大培养,获得A549-SOX30+DSC3miRNA稳定表达细胞系并用于后续分析。
1.4.5 细胞与组织的总RNA提取及cDNA合成细胞株总RNA的抽提参照Trizol(Invitrogen)试剂使用说明书进行,并采用Nano Drop分光光度计测定所提总RNA的浓度和纯度,然后参照GoScriptTM逆转录试剂盒(A5001)使用说明书合成cDNA。 SOX30基因敲除小鼠肺组织首先进行液氮研磨,之后参照上述方法提取总RNA并合成cDNA。
1.4.6 逆转录PCRSOX30引物,上游序列5´-GATG TCCCGCTCACCGTGTTGC-3´,下游序列5´-GACAGGG CTTGGGCTCTGGACT-3´;DSC3引物,上游序列5´-GACCCTCGTGATCTTCAGTCG-3´,下游序列5´-TCAC TTGACCGGATGAGGTCT-3´;内参基因 β -actin引物,上游序列5´-GAGCTACGAGCTGCCTGACGG-3´,下游序列5´-CCTAGAAGCATTTGCGGTGG-3´。逆转录PCR反应体系(20μL)包括:上、下游引物各1μL,2×Taq PCRMix10μL,cDNA模板1μL,Nuclease-free水7 μL。扩增程序为:95℃、3min;94℃、30s;58℃、30s;72℃、30s;72℃、10min;33个循环。扩增结束后,各取10μL PCR产物进行琼脂糖凝胶电泳,电泳结束后使用凝胶成像系统进行曝光分析,拍照并保存图片。实验重复3次。
1.4.7 平板克隆形成实验按每孔200个细胞接种A549-Vector、A549-SOX30、A549-SOX30+DSC3miRNA稳定转染细胞于6孔板,摇匀后于37℃、CO2体积分数为5%的常规培养箱中,用含3μg/mL杀稻瘟菌素的F-12K完全培养液培养2周,直至出现肉眼可见的克隆时,终止培养,取出细胞,PBS清洗细胞2次,4%多聚甲醛室温固定30min;结晶紫染色5min;PBS清洗细胞2次,空气中干燥;拍照保存,分析结果。
1.4.8 细胞划痕实验分别将A549-Vector、A549-SOX30、A549-SOX30+DSC3miRNA稳定转染细胞系按每孔5×105个细胞接种于6孔板中,摇匀后于37℃、CO2体积分数为5%的常规培养箱中培养;待细胞铺满皿底(融合度>90%),用10μL枪头在6孔板中划痕,PBS清洗细胞2次;然后加入无血清的F-12K培养液继续培养,于划痕后0、48h在同一位置利用倒置显微镜进行拍照;统计分析细胞迁移情况。
1.5 统计分析
采用SPSS17.0软件进行统计分析,计量资料均采用x±s 表 示,两样本均数比较采用成组t检验,肺癌中SOX30与DSC3基因表达的相关性分析采用Spearman秩相关分析。检验水准 α=0.05。
2 结果
2.1 SOX30转录调控基因全基因组表达谱数据功能富集分析
为了寻找 SOX30基因抑制肿瘤的可能下游通路,我们首先对 SOX30基因差异表达细胞系基因芯片数据进行了功能富集分析(GO分析),结果发现SOX30广泛与黏着斑(focal a dhesion)、锚定连接(anchoring junction)、黏着连接(adherens junction)、细胞连接(cell juncion)、细胞骨架(cytoskeleton)等在肿瘤侵袭和转移中具有关键调控作用的细胞连接相关基因表达显著相关,提示SOX30抑癌功能发挥可能与细胞黏附相关通路有关(见图1)。
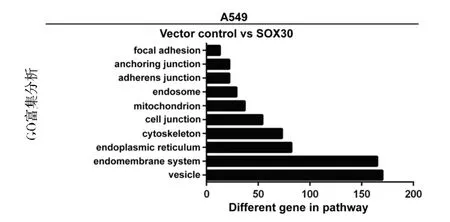
图1 基于SOX30转录调控基因表达谱经功能富集分析潜在的下游通路
2.2 生物信息学预测发现 SOX30基因可能调控DSC3基因的表达
为了进一步明确哪些细胞间连接相关基因可能受SOX30蛋白的调控,我们利用JASPAR数据库(http://jaspar.binf.ku.dk)对SOX30蛋白潜在的转录调控基因进行了在线预测,结果发现在 DSC3基因启动子区存在多个SOX30蛋白结合位点(见表1),提示SOX30很可能调控DSC3的表达。
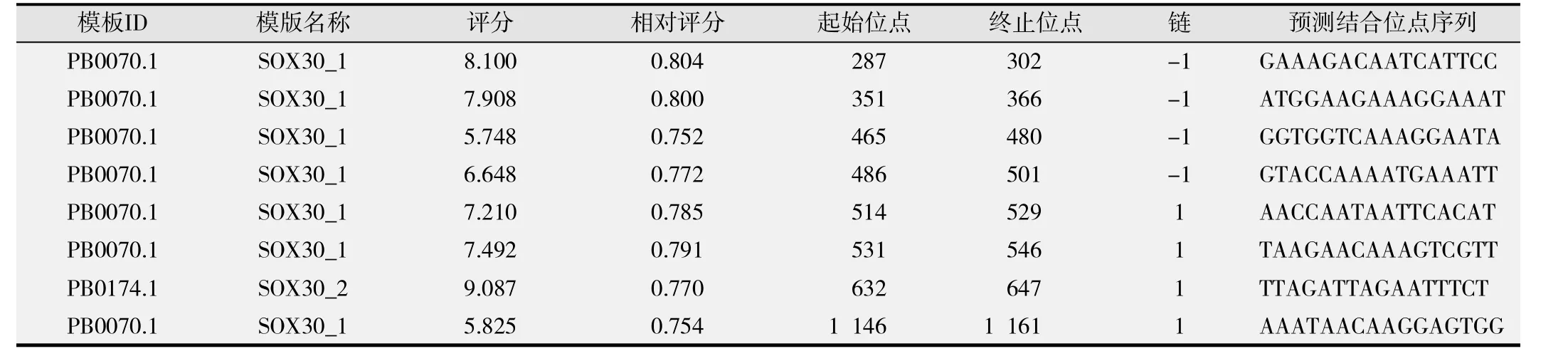
表1 DSC3启动子区 SOX30蛋白结合位点预测
2.3 TCGA数据库分析 SOX30与 DSC3基因在肺腺癌中表达的相关性
DSC3是一种钙依赖性糖蛋白,与肿瘤细胞增殖、集落形成、侵袭和迁移等调控有关。由此我们推测SOX30基因的抑癌作用可能与DSC3有关。为了进一步明确SOX30与DSC3在肺癌中的潜在调控关系,我们利用TCGA数据库分析了 SOX30基因与 DSC3基因在非小细胞肺癌中表达 的 相关性,结果发现二者在非小细胞肺癌中表达无明显相关(见图2A)。由于前期研究[7]表明SOX30主要在肺腺癌中发挥作用,为此我们进一步分析了二者在肺腺癌和肺鳞癌中的表达相关性,结果显示二者在肺腺癌中表达正相关(见图2B),在肺鳞癌中表达无明显相关(见图2C),提示二者在临床肺腺癌中存在调控关系。
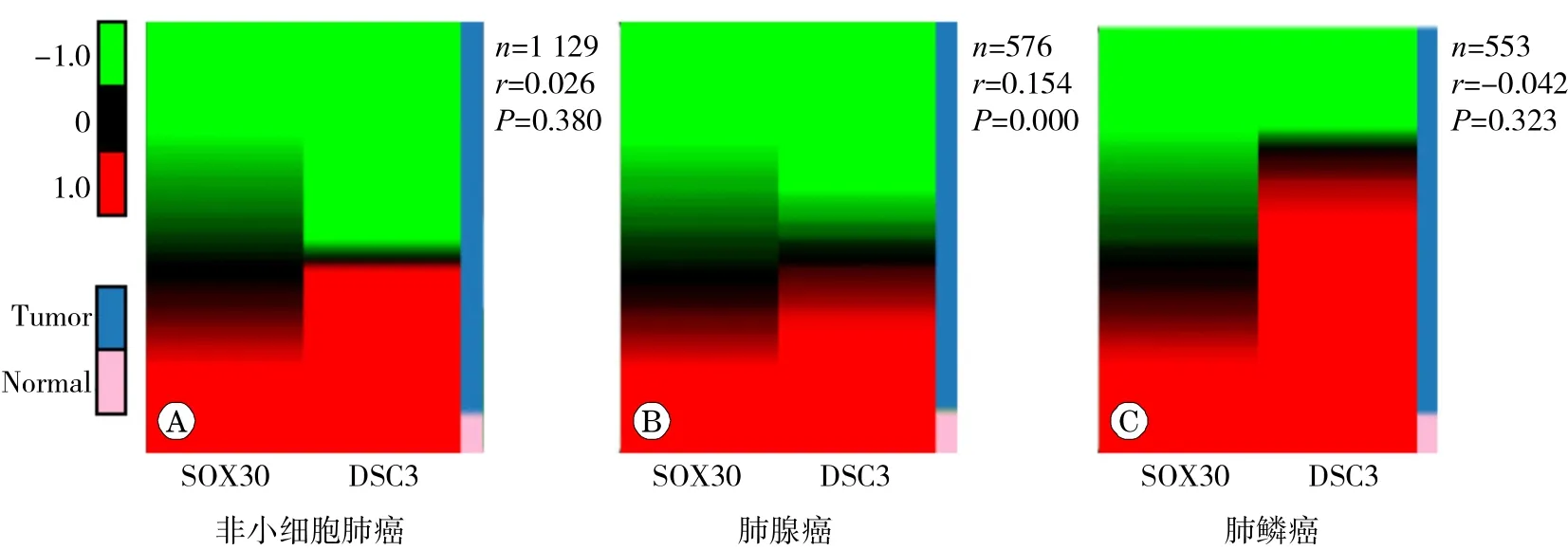
图2 SOX30 与 DSC3基因在 TCGA数据库肺癌中的表达及相关性分析
2.4 SOX30蛋白是 DSC3基因转录调控的关键分子
为进一步确证 SOX30 与 DSC3基因之间的调控关系,我们分析了SOX30差异表达细胞系中DSC3的表达, SOX30基因高表达的A549-SOX30细胞中DSC3 mRNA表达也显著上调(见图3),说明 SOX30基因能够调控 DSC3基因的表达,但是这种调控是不是必须的呢?为此,我们利用 SOX30基因敲除动物模型,使用逆转录PCR检测了野生型(SOX30+/+) 、杂合子(SOX30+/-)以及纯合子(SOX30-/-)小鼠肺组织中DSC3mRNA 的 表达情况,结果显示纯合子(SOX30-/-)小鼠肺组织中DSC3 mRNA表达水平显著低于杂合子(SOX30+/-)及野生型(SOX30+/+)小鼠(见图4),表明SOX30蛋白是调控 DSC3基因表达的关键分子。
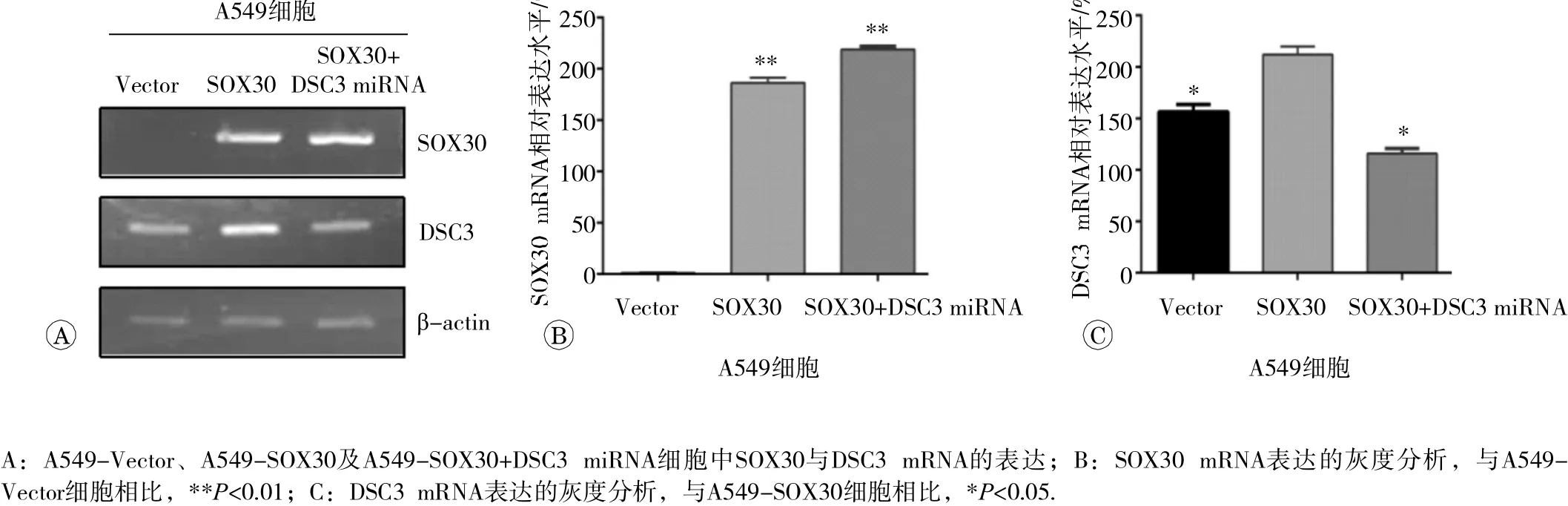
图3 各细胞中SOX30与 DSC3mRNA 的表达
2.5 SOX30蛋白对A549细胞的集落形成抑制依赖于DSC3基因的表达
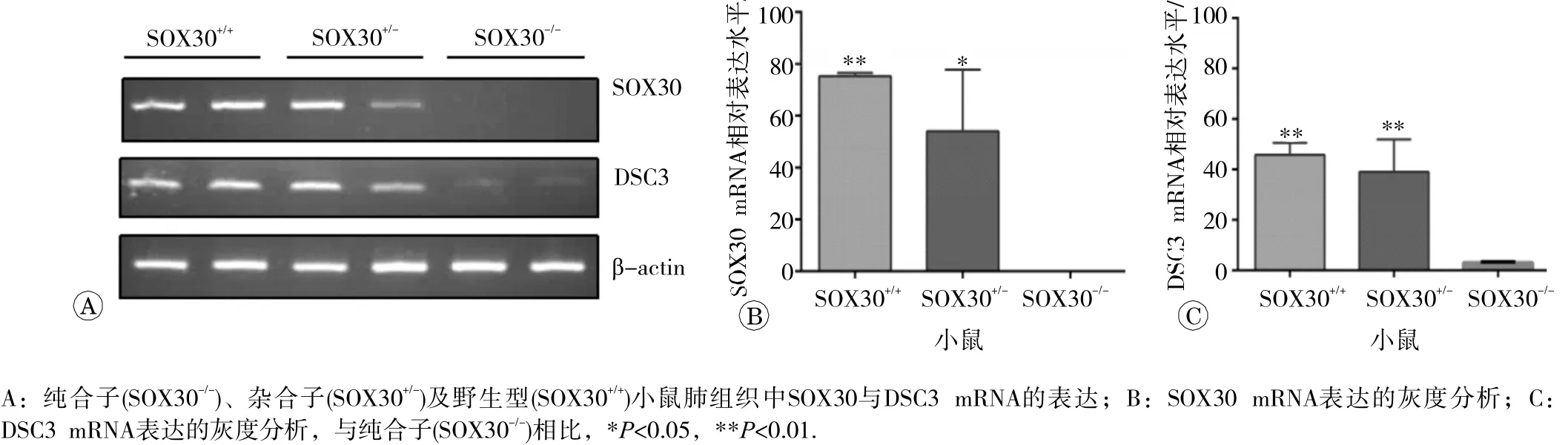
图4 SOX30基因敲除小鼠肺组织中SOX30与DSC3m RNA 的表达
为确定 DSC3基因是否参与SOX30蛋白抑制肺癌细胞增殖的过程,我们进行了克隆形成实验。结果显示,过表达SOX30的A549-SOX30细胞集落形成数较对照A549-Vector细胞显著降低,表明SOX30高表达抑制肿瘤细胞集落形成,而在A549-SOX30+DSC3miRNA细胞中, DSC3基因的表达被干扰后细胞集落形成数较A549-SOX30细胞显著增加(见图5)。这提示 SOX30基因抑制肿瘤细胞增殖的作用依赖于 DSC3基因的表达。
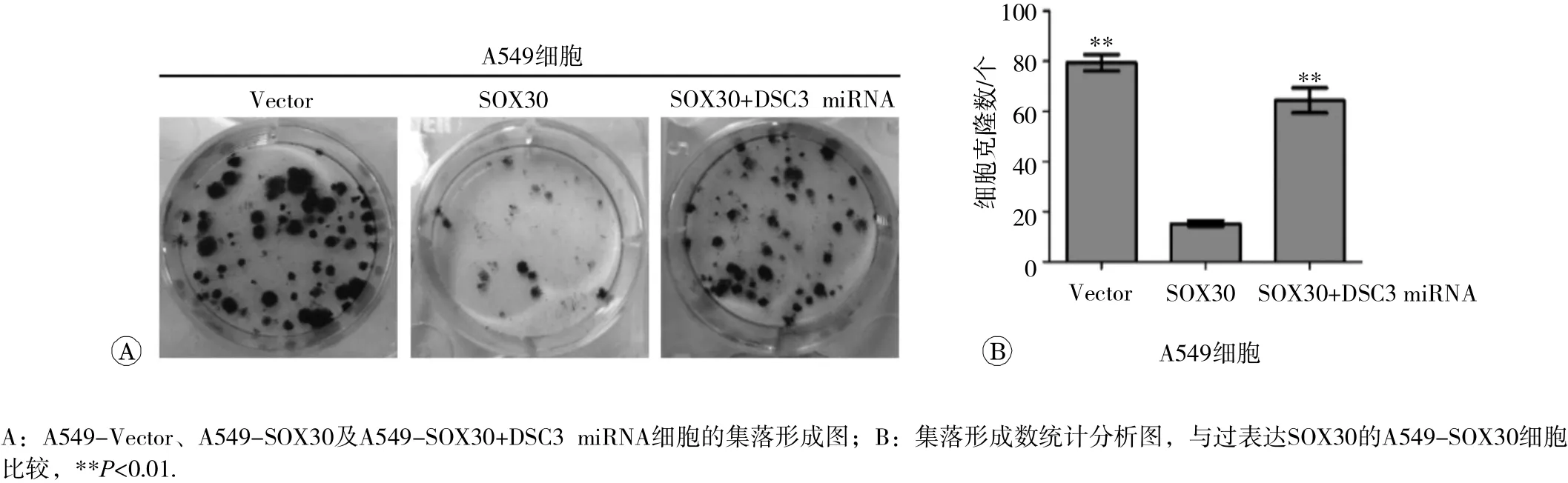
图5 干扰DSC3基因表达减弱SOX30基因对 A 549细胞集落形成的抑制
2.6 SOX30基因对A549细胞的迁移抑制依赖于DSC3基因的表达
由于DSC3是桥粒关键构成蛋白,为探索 DSC3基因是否参与了 SOX30基因对肿瘤转移的抑制,我们利用划痕愈合实验分析表明,过表达SOX30的A549-SOX30细胞相对迁移率较对照A549-Vector细胞显著降低,表明SOX30高表达抑制肿瘤细胞迁移;而在A549-SOX30+DSC3miRNA细胞中,即 DSC3基因的表达被干扰后显著减弱 SOX30基因对A549细胞迁移的抑制作用,细胞迁移率较A549-SOX30细胞显著升高(见图6)。这提示SOX30基因抑制肿瘤转移与DSC3高度相关。
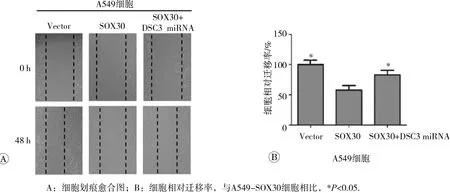
图6 干扰DSC3基因表达减弱 SOX30基因对 A 549细胞迁移的抑制
3 讨论
脊椎动物细胞间连接主要有黏着连接(adherens junction,AJ)和桥粒(半桥粒)两种类型。桥粒(desmosome)在细胞间信息交流、细胞定位、细胞形态、细胞结构和组织机械张力等调控中起着重要作用[8-9]。肿瘤细胞局部浸润必要步骤就是原发肿瘤细胞失去细胞间连接,包括黏着连接和桥粒结构的分解和调控[10]。多项研究表明,桥粒相关蛋白参与肿瘤细胞的增殖、侵袭及转移等过程,在肿瘤的发生发展中起重要作用[11]。近年研究发现,转录因子对桥粒基因的转录激活是桥粒基因表达调控的一种重要途径[12-16]。SOX30是典型的转录因子,作为一个新的抑癌基因,在肺癌的发生中起着重要作用,但是相关的机制还不清楚。本研究对SOX30差异表达基因进行了功能富集分析,发现SOX30基因的功能主要与黏着斑、锚定连接、黏着连接等细胞连接信号通路显著相关,同时通过转录结合位点分析发现桥粒关键基因 DSC3可能受SOX30蛋白的转录调控。 DSC3基因定位于人类染色体18q12.1,编码产物含896个氨基酸多肽。DSC3蛋白是一种钙依赖性糖蛋白,且是钙黏蛋白超家族的桥粒子家族的成员,可与其他家族成员相互作用而促成细胞桥粒介导的细胞黏附[17]。多项研究表明,DSC3在多种肿瘤中表达下调,包括结直肠癌[18-20]、前列腺癌[21]和乳腺癌[22]。Cui等[14]研究发现DSC3是肺癌中一个新的抑癌基因,它可以抑制肺癌的增殖、侵袭和迁移。我们推测SOX30基因可能通过转录调控DSC3而发挥抑癌功能。为此,我们进一步利用差异表达细胞模型和基因敲除动物模型验证,结果发现,过表达SOX30后显著上调A549细胞中DSC3mRNA 的 表达,敲除 SOX30基因后,小鼠肺组织中DSC3mRNA 的 表达显著下调,表明SOX30对DSC3 的表达有着关键的调控作用,提示SOX30可能是一个新的桥粒基因转录调控因子。
由于DSC3受SOX30表达调控,因此有可能在SOX30抑癌中发挥重要作用。我们前期的研究[7]也表明,SOX30在肺腺癌中是一个典型的抑癌基因,其表达与肺腺癌患者预后正相关,而在肺鳞癌中无明显的抑癌作用,因此,SOX30与DSC3的表达仅在肺腺癌中相关,与 SOX30基因的功能一致。为明确DSC3是否是SOX30基因在肺腺癌中发挥抑癌功能的可能下游分子,我们利用集落形成实验和细胞划痕愈合实验检测干扰 DSC3基因的表达后是否会影响SOX30对A549细胞的增殖和迁移抑制,结果显示干扰 DSC3基因的表达显著减弱SOX30对A549细胞的增殖和迁移抑制,表明DSC3是SOX30在肺腺癌中发挥抑癌功能的重要分子。但是,二者之间的这种调控作用,如何在肿瘤发生过程中影响桥粒的形态结构?是否二者进一步调控其他下游信号通路,都值得进一步研究。
综上所述,本研究首次发现SOX30是桥粒基因DSC3的转录调控因子,且DSC3是SOX30发挥抑癌功能的重要下游靶分子。本研究为进一步探索 SOX30基因功能以及SOX30-DSC3在肺腺癌发生发展中的作用和临床意义提供了重要依据。
[1]TORRE L A,BRAY F,SIEGEL R L,et al.Global cancer statistic,2012[J].CA CancerJClin,2015,65(2):87-108.
[2]CHEN W,ZHENG R,ZUO T,et al.National cancer incidence and mortality in China,2012[J].ChinJCancer Res,2016,28(1):1-11.
[3]CHEN W,ZHENG R,ZHANG S,et al.Cancer incidence and mortality in China in2013:an analysis based on urbanization level[J].ChinJCancer Res,2017,29(1):1-10.
[4]HAN F,DONGY,LIU W,et al.Epigenetic regulation of Sox30is associated with testis development in mice[J].PLoSOne,2014,9(5):e97203.
[5]FENG C A,SPILLER C,MERRINER DJ,et al.SOX30is required for male fertility in mice[J].Sci Rep,2017,7(1):17619.
[6]HAN F,LIU W,JIANG X,et al.SOX30,a novel epigenetic silenced tumor suppressor,promotes tumor cell apoptosis by transcriptional activating p53in lung cancer[J].Oncogene,2015,34(33):4391-4402.
[7]HAN F,LIU W,XIAO H,et al.High expression of SOX30is associated with favorable survival in human lung adenocarcinoma[J].Sci Rep,2015,5:13630.
[8] GARROD D, CHIDGEYM.Desmosome structure,composition and function[J].Biochim Biophys Acta,2008,1778(3):572-587.
[9]HUBER O,PETERSEN I.150thanniversary series:desmosomes and the hallmarks of cancer[J].Cell Commun Adhes,2015,22(1):15-28.
[10]DUSEK R L,ATTARDI L D.Desmosomes:new perpetrators in tumour suppression[J].Nat Rev Cancer,2011,11(5):317-323.
[11]ZHOU G,YANG L,GRAY A,et al.Therole of desmosomes in carcinogenesis[J].Onco Targets Ther,2017,10:4059-4063.
[12]VANDEWALLE C,COMIJNJ,DE CRAENE B,et al.SIP1/ZEB2induces EMTby repressing genes of different epithelial cell-cell junctions[J].Nucleic Acids Res,2005,33(20):6566-6578.
[13]BAZZI H,DEMEHRI S,POTTER C.Desmoglein4is regulated by transcription factors implicated in hair shaft differentiation[J].Differentiation,2009,78(5):292-300.
[14]CUI T,CHENY,YANG L,et al.The p53target gene desmocollin3acts as a novel tumor suppressor through inhibiting EGFR/ERK pathway in human lung cancer[J].Carcinogenesis,2012,33(12):2326-2333.
[15]MAOX,CHOMJT,ELLEBRECHTC T,et al.Stat3 regulates desmoglein3transcription in epithelial keratinocytes[J].JCI Insight,2017,2(9):1- 1 0.
[16]LIUY,CHIDGEYM,YANG V W,et al.Krüppel-like factor 5is essential for maintenance of barrier function in mouse colon[J].AmJPhysiol Gastrointest Liver Physiol, 2017,313(5):478-491.
[17]EZZATE S,TAHOUN N.Therole of Napsin-A and Desmocollin-3in classifying poorly differentiating non-small cell lung carcinoma[J].J Egypt Natl Canc Inst,2015,28(1):13-22.
[18]CUI T,CHENY,YANG L,et al.DSC3expression is regulated by p53,and methylation of DSC3DNA is a prognostic marker in human colorectal cancer[J].BrJCancer,2011,104(6):1013-1019.
[19]BUJKOM,KOBER P,MIKULAM,et al.Expression changes of cell-cell adhesion-related genes in colorectal tumors[J].Oncol Lett,2015,9(6):1-14.
[20]KNÖSEL T, CHENY, HOTOVY S, et al.Loss of desmocollin1-3and homeobox genes PITX1and CDX2are associated with tumor progression anDSurvival in colorectal carcinoma[J].IntJColorectal Dis,2012,27(11):1391-1399.
[21]PANJ,CHENY,MO C,et al.Association of DSC3mRNA down-regulation in prostate cancer with promoter hypermethylation and poor prognosis[J].PLoSOne,2014,9(3):e92815.
[22]OSHIROMM,KIM CJ,WOZNIAK RJ,et al.Epigenetic silencing of DSC3is a common event in human breast cancer[J].Breast Cancer Res,2005,7(5):669-680.

