CD133、CD68和PD-L1在不同病理级别脑胶质瘤组织中的表达及相关性
陈昊 莫立根 邓腾 栾方堃 于亚男 于海跃 田敏
脑胶质瘤是中枢神经系统最常见的颅内原发性恶性肿瘤,具有侵袭能力强、复发率高、预后差等特点[1-2]。成人高级别脑胶质瘤1年及5年生存率分别约为30%和13%,其中胶质母细胞瘤的中位生存期为1年左右[3]。近年研究表明脑胶质瘤具有诱导产生局部和系统性免疫抑制的能力,可逃避机体的免疫识别和攻击[4-5]。其中,作为“种子”的脑胶质瘤干细胞和作为“土壤”的肿瘤微环境在脑胶质瘤的免疫逃逸中发挥重要作用[6]。目前与免疫逃逸有关的细胞表面分子研究较多的是共刺激分子B7家族,其中负性共刺激分子PD-L1是研究的热点之一[7-9]。CD133被认为是胶质瘤干细胞(glioma stem cells,GSCs)的重要标志物[10-11],CD68在临床及科研中被广泛作为肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)标志物[12-13]。本研究探讨不同病理级别脑胶质瘤组织中CD133、CD68和PD-L1的表达及其相关性,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年5月至2017年5月在广西医科大学附属肿瘤医院神经外科手术切除并经术后病理证实的脑胶质瘤标本60例,所有标本手术切除后分为2份,1份立即放入液氮中,置于-80℃超低温冰箱中冻存备用;另1份放入10%中性甲醛溶液固定后进行常规石蜡包埋、切片备用。2007年WHO中枢神经系统肿瘤分类根据胶质瘤组织病理学特征将其分为低级别胶质瘤(Ⅰ级和Ⅱ级)和高级别胶质瘤(Ⅲ级和Ⅳ级)[14],本研究纳入低级别脑胶质瘤30例(低级别组),其中Ⅰ级5例,Ⅱ级25;高级别脑胶质瘤30例(高级别组),其中Ⅲ级10例,Ⅳ级20例。60例患者中男性36例,女性24例,年龄23~65岁(中位年龄44岁),均为初发患者,术前未接受放疗、化疗等抗肿瘤治疗,排除合并其他器官肿瘤、糖尿病和类风湿等疾病患者及临床、随访资料不完整者。本研究经医院伦理委员会审查通过,患者及其家属知情同意。两组患者的性别、年龄等比较差异无统计学意义(P>0.05)。
1.2 主要试剂
小鼠抗人CD68抗体(产品编号:ab201973)、兔抗人PD-L1抗体(产品编号:ab213524)、FITC标记的山羊抗鼠IgG抗体(产品编号:ab6785)、TRITC标记的山羊抗兔IgG抗体(产品编号:ab6718)购自英国Abcam公司;RNAiso Plus(产品编号:9108)、PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)、SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)购自日本Takara公司;DEPC水(产品编号:R0021)购自上海碧云天生物技术有限公司;抗荧光衰减封片剂、DAPI溶液(即用型)、抗体稀释液、山羊血清封闭液、PBS缓冲液、柠檬酸钠抗原修复液等购自北京索莱宝科技有限公司。
1.3 免疫荧光双染实验检测CD68和PD-1蛋白共表达情况
脑胶质瘤蜡块切取4 μm厚切片,石蜡切片经常规脱蜡、水化后在柠檬酸钠修复液(PH=6.0)中高压煮沸5 min修复组织抗原,自然冷却至室温后用PBS缓冲液漂洗3遍,每次5 min;以3%过氧化氢溶液覆盖,37℃下孵育10 min;10%山羊血清封闭液覆盖,37℃下孵育10 min,封闭非特异性结合位点;甩掉血清后滴加小鼠抗人CD68抗体(1∶100)与兔抗人PD-L1抗体(1∶100)混合液,4℃孵育过夜;切片经 PBS缓冲液漂洗后滴加FITC标记的山羊抗鼠(1∶200)和TRITC标记的山羊抗兔(1∶200)荧光二抗混合液,37℃避光孵育1 h;PBS缓冲液漂洗后滴加DAPI溶液,避光染核2 min;抗荧光衰减封片剂封片后用荧光显微镜观察并拍照分析。用PBS缓冲液代替一抗作为阴性对照。400倍镜下,用荧光显微镜观察切片并拍摄5个不同视野的荧光图像,细胞膜及细胞质呈绿色荧光的细胞判定为CD68阳性,细胞膜及细胞质呈红色荧光的细胞判定为PD-L1阳性,双重阳性细胞呈黄色荧光。
1.4 实时荧光定量PCR检测CD133、CD68和PD-L1 mRNA的表达
1.4.1 总RNA提取和cDNA合成 取100 mg冻存组织充分研磨至粉末状,加入1 mL RNAiso Plus溶液混匀后转入离心管静置;离心后吸取上清液,加入0.2 mL氯仿,混匀;离心后吸取上清液,加入等体积异丙醇;再次离心后弃上清液,用预冷的75%乙醇清洗RNA沉淀;DEPC水溶解RNA沉淀;紫外分光光度计测定RNA浓度和A260/A280值(A260/A280需在1.7~2.1之间);用琼脂糖凝胶电泳分析RNA完整性。取1 μg总RNA,按照试剂盒说明书步骤合成cDNA,-20℃保存备用。
1.4.2 检测CD133、CD68和PD-L1基因mRNA表达
以GAPDH基因作为内参,采用Primer 5.0软件设计GAPDH、CD133、CD68和PD-L1基因的引物序列(表1),由上海生工生物工程股份有限公司合成。扩增体系(20 μL):SYBR Premix Ex TaqTMⅡ 10 μL,上、下游引物各 0.8 μL,cDNA 模板 2 μL,DEPC 水6.4 μL。反应条件:95 ℃预变性30 s;95℃变性5 s,60℃退火延伸30 s,扩增45个循环;然后95℃ 15 s、60℃1 min、95℃15 s,获取融解曲线。每个样本各目的基因设置3个复孔,实验重复3次,取平均值。

表1 GAPDH、CD133、CD68和PD-L1基因的引物序列及扩增片段长度
1.4.3 结果判定 读取目的基因及内参基因的Ct值(Ct值表示基因反应产物的荧光值达到设定阈值时的反应循环数),以待测样品的相对值表示目的基因mRNA的表达量,根据以下公式计算待测样品的相对值:2-△Ct=2Ct(GAPDH)-Ct(目的基因),待测样品的相对值越大,说明其表达量越多。
1.5 统计学方法
采用SPSS 22.0软件对实验数据进行统计学分析。符合正态分布的计量数据以均数±标准差(x±s)表示,不符合正态分布的数据则采用中位数(四分位数间距)表示;两组脑胶质瘤组织中CD133、CD68和PD-L1基因的表达差异采用独立样本t检验,若数据不符合正态分布则使用两样本比较的秩和检验;CD133、CD68和PD-L1基因表达水平与病理级别之间的相关性用Spearman秩相关分析法。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 CD68和PD-L1蛋白在脑胶质瘤组织中的共表达情况
免疫荧光双染实验结果显示,高级别组和低级别组脑胶质瘤组织中均有CD68和PD-L1蛋白表达,主要位于细胞膜及细胞质;CD68阳性细胞呈绿色荧光,PD-L1阳性细胞呈红色荧光,双重阳性细胞呈黄色荧光。双重染色结果显示,大部分PD-L1表达于TAMs上,即大部分PD-L1阳性细胞为肿瘤相关巨噬细胞;高级别组CD68和PD-L1蛋白的共表达较低级别组明显增加。见图1、图2。
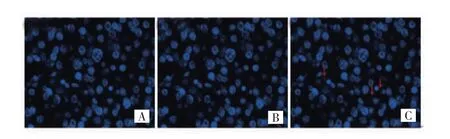
图1 CD68与PD-L1蛋白在低级别组脑胶质瘤组织中的共表达(免疫荧光双染,×400)
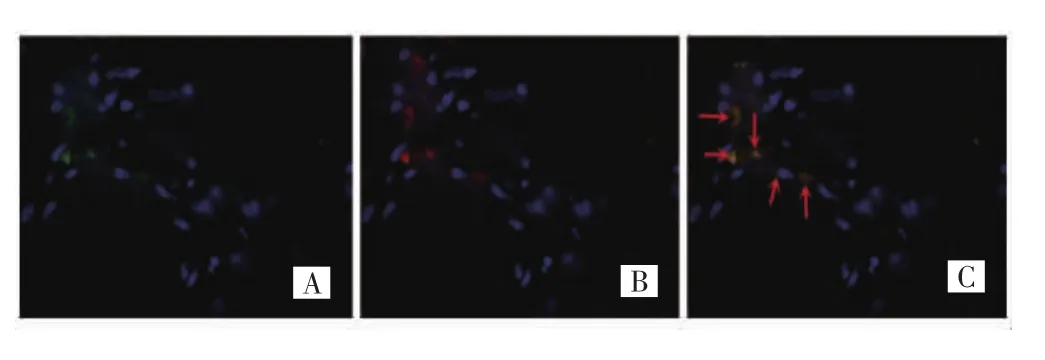
图2 CD68与PD-L1蛋白在高级别组脑胶质瘤组织中的共表达(免疫荧光双染,×400)
2.2 CD133、CD68和PD-L1 mRNA表达与脑胶质瘤组织病理学分级的相关性
CD133、CD68、PD-L1 和 GAPDH mRNA 的扩增曲线和融解曲线均显示较好的特异性,说明结果可靠。实时荧光定量PCR结果显示,随着脑胶质瘤组织病理级别升高,CD133、CD68和PD-L1 mRNA表达量逐渐增加;Spearman秩相关分析显示,在脑胶质瘤组织中,CD133、CD68和PD-L1 mRNA表达水平与病理分级呈正相关(r=0.647,P<0.001;r=0.499,P<0.001;r=0.445,P=0.001),见表2。
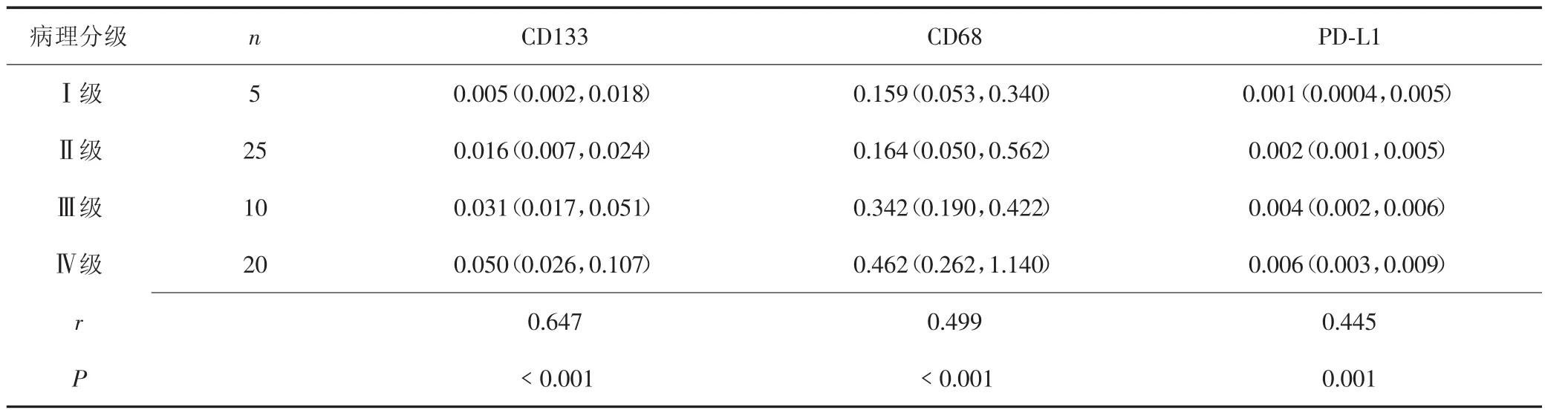
表2 CD133、CD68和PD-L1 mRNA表达与脑胶质瘤组织病理学分级的关系
2.3 CD133、CD68和PD-L1 mRNA在不同病理分级脑胶质瘤组织中的表达及其相关性
两样本比较的秩和检验结果显示,CD133、CD68和PD-L1 mRNA在高级别脑胶质瘤组织中的表达均高于低级别组(P<0.05),见表3;Spearman 秩相关分析显示,脑胶质瘤组织中CD133与CD68 mRNA 的表达呈正相关(r=0.525,P<0.001),低级别组和高级别组中CD133与 CD68 mRNA的表达亦均呈正相关(r=0.518,P=0.005;r=0.500,P=0.007);脑胶质瘤组织中CD133与PD-L1 mRNA的表达呈正相关(r=0.431,P<0.001),低级别组和高级别组中CD133与PD-L1 mRNA的表达亦均呈正相关(r=0.398,P=0.036;r=0.417,P=0.027)。

表3 CD133、CD68和PD-L1 mRNA在不同病理分级脑胶质瘤组织中的表达
3 讨论
脑胶质瘤预后极差,手术、放疗、化疗等综合治疗后,复发率仍较高。近代病理学之父Paget提出的关于肿瘤生长的“种子与土壤”学说[15]在恶性肿瘤研究史上具有里程碑意义。在脑胶质瘤中,作为“种子”的GSCs能通过诱导产生免疫抑制逃避自身免疫系统的监视和清除,具有较强的放疗、化疗抵抗性。GSCs被认为是脑胶质瘤的起源细胞,具有自我更新、无限增殖、自我修复和多向分化的潜能[16]。有研究[17-18]表明,GSCs所具有的逃避机体免疫监控能力与作为“土壤”的肿瘤微环境中的关键细胞(肿瘤相关巨噬细胞和主要负性共刺激分子PD-L)密切相关。肿瘤微环境由肿瘤细胞、免疫细胞及其分泌的各类因子等组成,其细胞成分中肿瘤相关巨噬细胞的含量最多[19],脑胶质瘤组织中浸润的TAMs主要是小胶质细胞/巨噬细胞(Microglia/Macrophages,M/Ms),约占肿瘤细胞团的40%,远超淋巴细胞数量,提示TAMs可能在脑胶质瘤免疫逃逸中扮演重要角色[20]。PD-L1为B7家族负性共刺激分子,与其受体PD-1的相互作用在肿瘤免疫逃逸中发挥重要作用[21]。因此,研究PD-L1蛋白在肿瘤组织中的表达及其调控机制具有重要意义。
在脑胶质瘤组织中,GSCs、TAMs和PD-L1同时存在,但以往报道多研究PD-L1在GSCs、TAMs各自中的表达,同时研究三者在脑胶质瘤免疫逃逸机制中的作用,国内外鲜见报道。本研究分析不同病理级别脑胶质瘤组织中CD133、CD68和PD-L1的表达及其相关性,结果显示,在脑胶质瘤组织中PD-L1和CD68共表达在肿瘤相关巨噬细胞上,即大部分PD-L1阳性细胞为肿瘤相关巨噬细胞,且随着脑胶质瘤病理级别升高,CD68和PD-L1蛋白共表达增加。CD133、CD68和PD-L1 mRNA在脑胶质瘤组织中的表达水平与病理分级呈正相关;三者在高级别组中的表达水平高于低级别组;进一步分析发现,脑胶质瘤组织中CD133与CD68 mRNA表达、CD133与PD-L1 mRNA表达均呈正相关,在低级别组和高级别组中表达亦呈正相关。提示CD133、CD68和PD-L1的表达与脑胶质瘤的恶性程度密切相关,可能共同参与了脑胶质瘤恶性进展。分析原因可能是GSCs通过某种渠道诱导TAMs高表达PD-L1,从而逃避机体免疫监视,促进脑胶质瘤生长和恶性转化。因此通过调节脑胶质瘤干细胞与其肿瘤微环境之间的双向信息交换,从而降低胶质瘤细胞侵袭和恶性转化,或可为脑胶质瘤的治疗带来新思路。
本研究结果显示,脑胶质瘤组织中PD-L1主要由肿瘤微环境中的TAMs表达;CD133、CD68和PD-L1表达与脑胶质瘤的恶性程度密切相关,为进一步探讨GSCs诱导TAMs高表达PD-L1的分子机制和寻找脑胶质瘤新的治疗靶点提供参考。
[1] Mehta S,Lo Cascio C.Developmentally regulated signaling pathways in glioma invasion[J].Cell Mol Life Sci,2018,75(3):385-402.
[2] Ostrom QT,Bauchet L,Davis FG,et al.The epidemiology of glioma in adults:a"state of the science"review[J].Neuro Oncol,2014,16(7):896-913.
[3]《中国中枢神经系统胶质瘤诊断和治疗指南》编写组.中国中枢神经系统胶质瘤诊断与治疗指南(2015)[J].中华医学杂志,2016,96(7):485-509.
[4] Nduom EK,Weller M,Heimberger AB.Immunosuppressive mechanisms in glioblastoma[J].Neuro Oncol,2015,17(Suppl 7):vii9-vii14.
[5] Kamran N,Calinescu A,Candolfi M,et al.Recent advances and future of immunotherapy for glioblastoma[J].Expert Opin Biol Ther,2016,16(10):1245-1264.
[6] Eder K,Kalman B.The dynamics of interactions among immune and glioblastoma cells[J].Neuromolecular Med,2015,17(4):335-352.
[7] Bersanelli M,Buti S.From targeting the tumor to targeting the immune system:Transversal challenges in oncology with the inhibition of the PD-1/PD-L1 axis[J].World J Clin Oncol,2017,8(1):37-53.
[8] Hamanishi J,Mandai M,Matsumura N,et al.PD-1/PD-L1 blockade in cancer treatment:perspectives and issues[J].Int J Clin Oncol,2016,21(3):462-473.
[9] 范钰,刘斌,袁会军,等.PD-1/PD-L1在实体肿瘤组织中表达的研究进展[J].中国癌症防治杂志,2017,9(6):498-501.
[10]Arun S,Ravisankar S,Vanisree AJ.Implication of connexin30 on the stemness of glioma:connexin30 reverses the malignant phenotype of gliomabymodulatingIGF-1R,CD133andcMyc[J].J Neurooncol,2017,135(3):473-485.
[11]Wang X,Chen L,Xiao Z,et al.Screening glioma stem cells in U251 cellsbased on theP1 promoter of the CD133 gene[J].Oncol Lett,2016,12(4):2457-2462.
[12]Wang H,Li P,Wang L,et al.High numbers of CD68+tumor-associated macrophages correlate with poor prognosis in extranodal NK/T-cell lymphoma,nasal type[J].Ann Hematol,2015,94(9):1535-1544.
[13]Buldakov M,Zavyalova M,Krakhmal N,et al.CD68+,but not stabilin-1+tumor associated macrophages in gaps of ductal tumor structures negatively correlate with the lymphatic metastasis in human breast cancer[J].Immunobiology,2017,222(1):31-38.
[14]Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of tumours of the central nervous system[J].Acta Neuropathol,2007,114(2):97-109.
[15] Paget S.The distribution of secondary growths in cancer of the breast.1889[J].Cancer Metastasis Rev,1989,8(2):98-101.
[16]郭阳,徐如祥.脑肿瘤干细胞的发育相关信号通路[J].中华神经创伤外科电子杂志,2015,1(5):41-45.
[17]Saha D,Martuza RL,Rabkin SD.Macrophage polarization contributes to glioblastoma eradication by combination immunovirotherapy and immune checkpoint blockade[J].Cancer Cell,2017,32(2):253-267.
[18]Lou Y,Shi J,Guo D,et al.Function of PD-L1 in antitumor immunity of glioma cells[J].Saudi J Biol Sci,2017,24(4):803-807.
[19] Petty AJ,Yang Y.Tumor-associated macrophages:implications in cancer immunotherapy[J].Immunotherapy,2017,9(3):289-302.
[20] Gieryng A,Pszczolkowska D,Walentynowicz KA,et al.Immune microenvironment of gliomas[J].Lab Invest,2017,97(5):498-518.
[21] Salmaninejad A,Khoramshahi V,Azani A,et al.PD-1 and cancer:molecular mechanisms and polymorphisms[J].Immunogenetics,2018,70(2):73-86.

