DNA修复基因RAD52 miRNA靶序列单核苷酸多态性与肝细胞癌遗传易感性研究
王坚武 于祥远 王倩倩 秦林原 贝春华 谭盛葵, 何松青 唐博 廖维甲 余红平
我国是肝细胞癌(hepatocellular carcinoma,HCC)高发国家,每年全球约50%的HCC新发和死亡病例发生在我国[1]。HCC恶性程度高,早期检出率低,患者确诊时多属中晚期,预后较差,但其病因尚未完全清楚,目前认为HCC的发生是遗传因素和环境因素相互作用的结果。乙型肝炎病毒(Hepatitis B virus,HBV)慢性感染是HCC最重要的危险因素,但只有少部分慢性HBV感染人群最终发生HCC,提示机体的遗传易感性在HCC发生中起重要作用[2-4]。
同源重组修复(homologous recombination repair,HRR)是一种重要的DNA修复机制,而RAD52是HRR通路的关键因子。研究表明,RAD52基因在胃癌、鼻咽癌等多种恶性肿瘤组织中异常表达,与肿瘤临床分期、预后等关系密切[5-6]。微小RNA(miRNA)靶基因3'-UTR区域单核苷酸多态性(single nucleotide polymorphism,SNP)可能影响miRNAs与靶基因序列结合,导致靶基因表达或功能改变。本研究应用病例-对照研究方法,以1 002确诊HCC新发病例和1 013非肿瘤患者为研究对象,探讨RAD52基因3'-UTR区域miRNA靶序列SNPs与广西地区人群HCC遗传易感性的关系。
1 资料与方法
1.1 研究对象
本研究HCC患者为2007年1月至2011年4月在广西医科大学第一附属医院和广西医科大学附属肿瘤医院确诊的新发患者,均经病理组织学确诊,调查前未行化疗和(或)放疗,共1 002例。同期收集来自上述医院非肿瘤患者为对照组,均无肿瘤病史,在性别、年龄(±5岁)等与病例组匹配,共1 013例。采用统一调查问卷收集研究对象一般人口学特征和相关环境暴露因素资料,其中吸烟史和饮酒史定义如下:一生中连续或累积吸烟≥6个月,饮酒至少1次/周,且持续≥6个月。采集研究对象外周静脉血液5 mL,提取外周全血基因组DNA,-80℃保存。本研究经医学院伦理委员会批准,所有研究对象均知情同意。
1.2 SNPs位点选择及基因分型
1.2.1 SNPs选择 联合应用NIEHS(https://www.niehs.nih.gov/)、mirSNP(http://cmbi.bjmu.edu.cn/mirsnp)和NCBI dbSNP(https://www.ncbi.nlm.nih.gov/snp)等数据库,选择RAD52基因3'-UTR区域miRNA靶序列SNPs,选择标准:⑴依据HapMap数据库中中国北京人群(HCB)最小等位基因频率(MAF)大于0.05;⑵各SNPs之间连锁不平衡系数(linkage disequilibrium,LD)r2小于 0.8。最终筛选到 rs1051669、rs1051672、rs7301931和rs7310449等 4个 SNPs。
1.2.2 基因分型 利用Sequenom MassARRAY SNP分型系统对候选SNPs进行基因型检测,PCR扩增反应:按照反应体系加入反应成分10 ng/μL DNA 1 μL、10×Buffer 0.5 μL、25 mmol/L MgCl20.4 μL、5 U/μLTaq 0.2 μL、25 mmol/L dNTP 0.1 μL、20 μmol/L 特异扩增引物混合液1 μL,去离子水补足至4 μL;反应程序:94℃预变性15 min,94℃变性20 s,56℃退火30 s,72℃ 延伸1 min,共45个循环,最后72℃终末延伸3 min。质谱检测:PCR产物经虾碱性磷酸酶(SAP)纯化、单碱基延伸反应、树脂纯化处理后,应用SequenomMassARRAY系统,制备检测用SpectroCHIP芯片,MALDI-TOF质谱仪分析,获取原始数据及基因分型图,读取结果。基因分型检测由北京博淼生物科技有限公司完成。对于SNP检测结果,随机抽取10%的样本以盲法复测,具体做法:将病例组和对照组96孔样品板分别按阿拉拍数字编号,各随机抽取其中一个数字标记的样品板,进行重复检测,与前面检测结果比对。所研究SNPs位点PCR扩增引物序列信息见表1。

表1 RAD52基因多态位点引物序列信息
1.3 统计学分析
采用SPSS 18.0统计软件进行统计分析。计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验。采用χ2拟合优度检验评估对照组各SNP基因型分布是否符合Hardy-Weinberg遗传平衡定律;采用χ2检验比较各分类变量和各SNP基因型频率在病例组和对照组中的分布差异;采用多因素logistics回归计算各位点基因型及其与环境因素的交互作用与HCC发病风险的比值比(odds ratios,OR)及其95%置信区间(confidence intervals,CI)。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 研究对象基本资料
病例组和对照组年龄、性别比例差异无统计学意义(P=0.45),但吸烟史、饮酒史及HBV感染等因素,差异均有统计学意义(P<0.001),见表2。
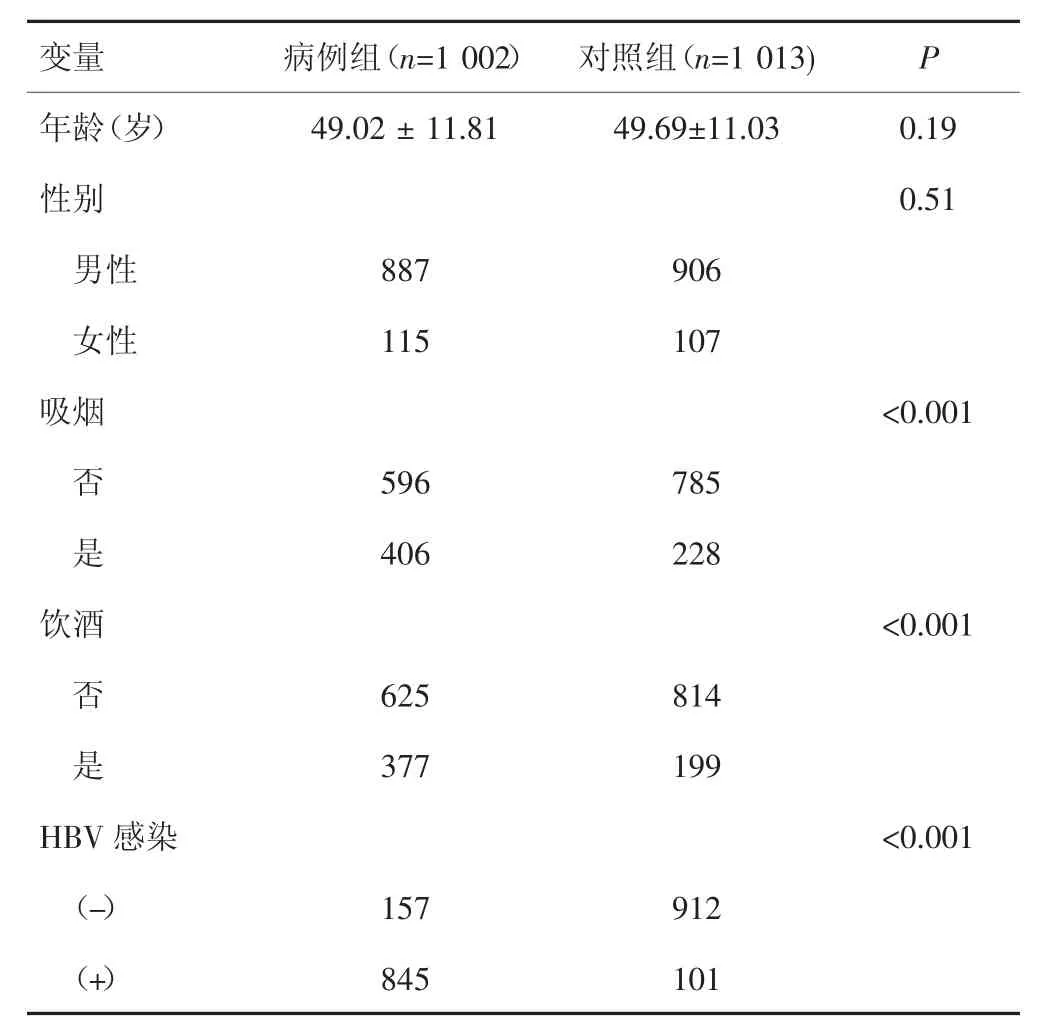
表2 病例组与对照组一般资料比较(x±s)
2.2 候选SNP基本信息
经拟合优度χ2检验,本研究候选RAD52基因各SNPs位点(rs1051669C>T、rs1051672G>A、rs7301931T>C和rs7310449 A>G)基因型在对照组中的分布,均符合Hardy-Weinberg遗传平衡定律,候选SNPs基本信息及分型结果见表3。
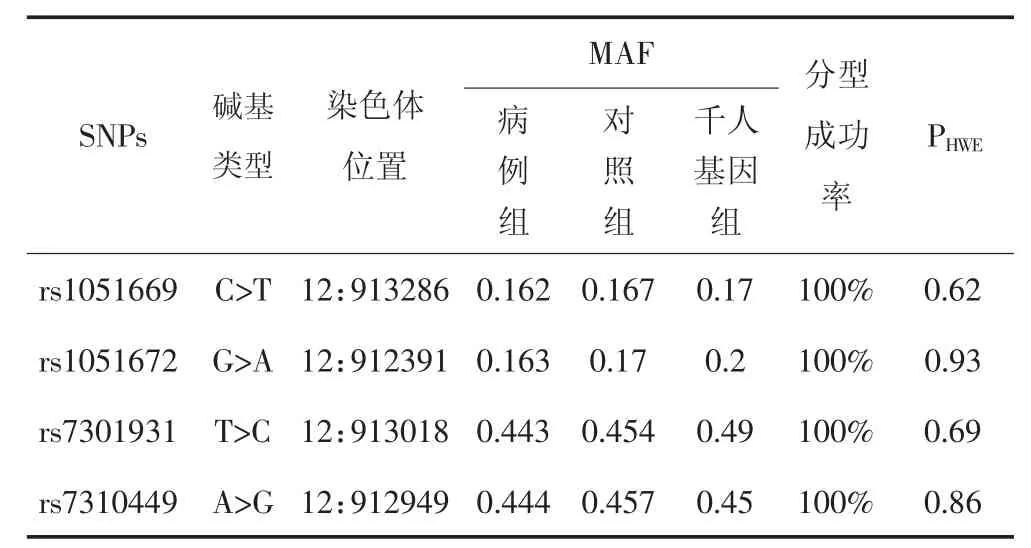
表3 候选SNPs位点信息及分型等位基因频率分布
2.3 RAD52基因SNPs基因型与HCC遗传易感性的关系
RAD52基因各SNP位点基因型在病例组和对照组中的分布频率差异均无统计学意义(P>0.05)。多因素Logistics回归分析。调整年龄、性别、吸烟、饮酒和HBV感染等因素,未发现RAD52基因各SNP位点与HCC易感性存在统计学关联(P>0.05),见表4。
2.4 RAD52基因SNPs位点与HCC发病风险的分层分析
进一步以年龄、性别、吸烟、饮酒及HBV感染等因素进行分层分析,在隐性遗传模型下,发现RAD52基因rs1051669和rs1051672位点与性别因素在HCC发病中存在交互作用(P<0.05):在女性人群中,与rs1051669位点C等位基因相比,TT基因型可显著降低个体罹患 HCC的风险 (TT vs CT/CC:OR=0.03,95%CI:0.00~0.62,P=0.03);与 rs1051672 位点G等位基因相比,AA基因型可显著降低个体罹患HCC的风险(AA vs GA/GG:OR=0.03,95%CI:0.01~0.88,P=0.04)。未发现其他SNPs位点与这些暴露因素有交互作用(P>0.05)。见表5。
3 讨论
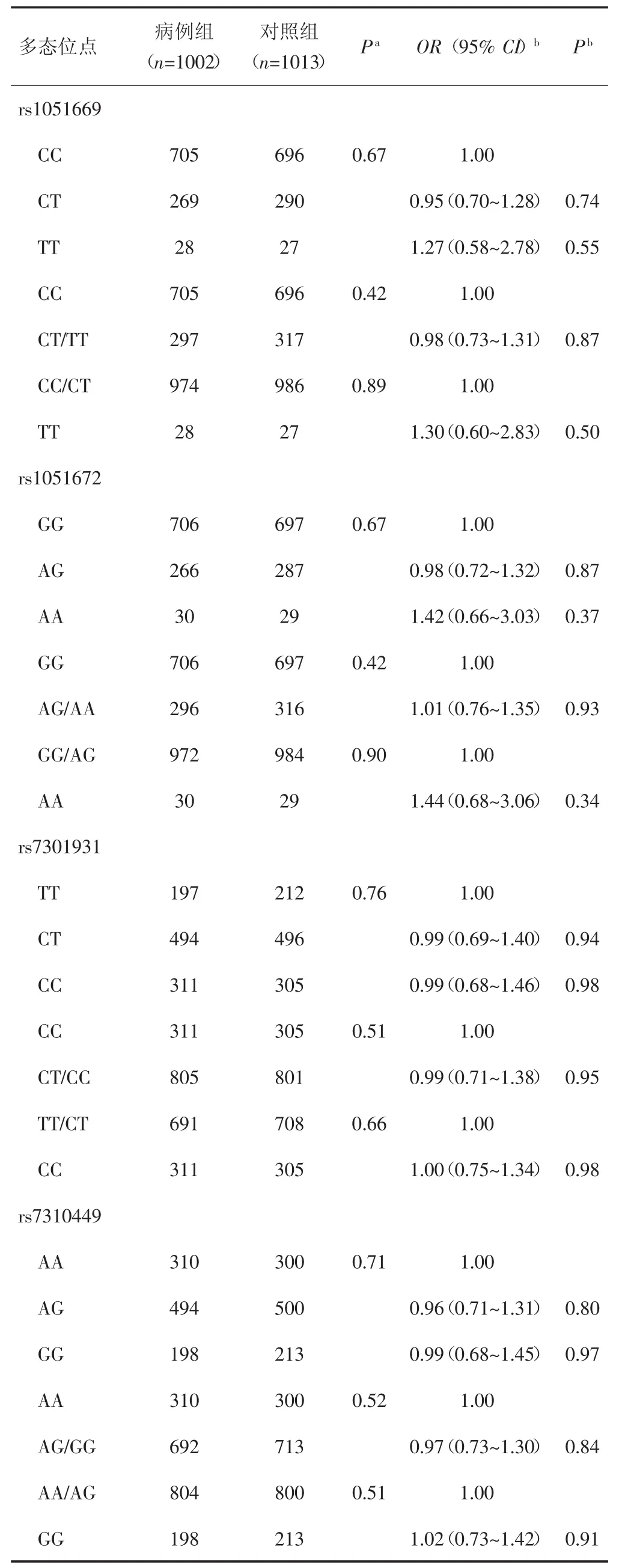
表4 RAD52基因各SNPs基因型分布及其与HCC遗传易感性的关系
RAD52基因作为HRR的关键因子,其在酵母的DNA双链断裂(double-strand break,DSB)修复、细胞减数分裂、有丝分裂重组及保持基因组稳定性等细胞生物学过程中不可或缺,细胞中RAD52基因低表达或缺失将导致大范围染色体变异,导致基因组不稳定[7]。功能学研究发现,在BRCA1、BRCA2或 PALB2基因缺陷细胞中,RAD52缺失能通过增加损伤诱导的染色体异常、降低HRR修复效率,缩短细胞生存期[6,8-9]。由此可见,RAD52 在肿瘤的发生发展及预后过程中可能发挥重要作用。
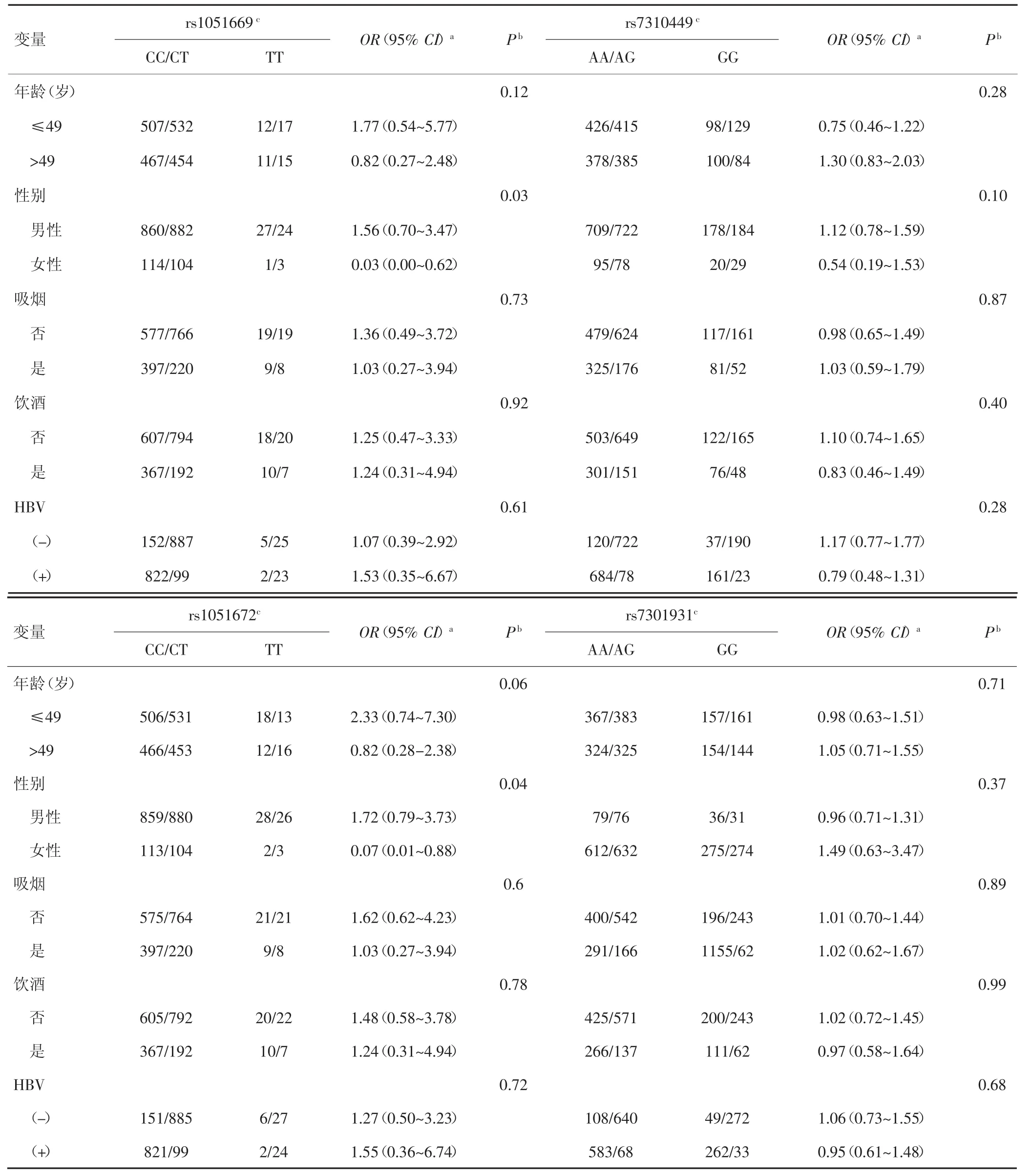
表5 RAD52基因多态位点基因型与HCC发病关系的分层分析
基因3'-UTR具有miRNA的结合位点,是参与基因转录后表达调控的重要区域。研究表明,miRNA具有癌基因和抑癌基因样作用,可能参与细胞发育、增殖、分化、凋亡等[10-11]。而miRNAs靶基因结合位点SNPs与HCC发生发展有关[12-13]。
Naccarati等[14]以捷克1 111例结直肠癌患者与1 469名健康对照者为研究对象,探讨rs1051669位点与结直肠癌易感性的关系,结果发现,rs1051669 AA纯合型个体罹患结直肠癌的风险明显高于GG型个体(OR=1.68,95%CI:1.11~2.54)。但在中国人群中,发现 rs1051669 与肺癌[15]、神经胶质瘤[16]等肿瘤的遗传易感性显著关联。本研究亦未发现RAD52基因3'-UTR miRNA靶序列SNPs与HCC易感性的相关性。以年龄、性别、吸烟、饮酒、HBV感染等因素进行分层分析,发现在女性人群中,与携带RAD52基因rs1051669位点C等位基因型者相比,TT基因型携带者罹患HCC的风险明显降低;与携带rs1051672位点G等位基因型者相比,AA基因型携带者罹患HCC的风险亦明显降低。据此推测,rs1051669与rs1051672位点可能影响广西地区女性个体对HCC的易感性。
尽管本研究病例组和对照组的样本量较大,但因某些SNP位点某种基因型在人群中分布频率较低,致使该基因型个体频数较小,可能对统计学检验效能产生一定影响。同时,本研究采用以医院为基础的病例对照研究,研究对象均来自医院,亦可能存在一定程度的选择偏倚。但本研究通过调查前统一培训调查人员、使用统一调查问卷、病例组与对照组在年龄(±5岁)、性别等方面匹配等措施尽可能减少偏倚。
本研究结果发现,在广西地区女性人群中,RAD52基因3'-UTR区域miRNA结合位点rs1051669与rs1051672与HCC易感性可能有关,但仍需在大样本人群中进一步验证。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Ghouri YA,Mian I,Rowe JH.Review of hepatocellular carcinoma:Epidemiology,etiology,and carcinogenesis[J].J Carcinog,2017,16:1.
[3] He Z,Yu Y,Nong Y,et al.Hepatitis B virus X protein promotes hepatocellular carcinoma invasion and metastasis via upregulating thioredoxin interacting protein[J].Oncol Lett,2017,14(2):1323-1332.
[4] Lin YY,Yu MW,Lin SM,et al.Genome-wide association analysis identifies a GLUL haplotype for familial hepatitis B virus-related hepatocellular carcinoma[J].Cancer,2017,123(20):3966-3976.
[5] 刘坤,杨小丽,窦东伟.DNA修复蛋白RAD52在胃癌中的表达及意义[J].世界华人消化杂志,2014,22(2):239-243.
[6] 韦黎黎,杨小丽,明慧馨,等.鼻咽癌中Rad52的表达及其临床意义[J].临床耳鼻咽喉头颈外科杂志,2014,28(7):486-489.
[7] Munoz-Galvan S,Jimeno S,Rothstein R,et al.Histone H3K56 acetylation,Rad52,and non-DNA repair factors control double-strand break repair choice with the sister chromatid[J].PLoS Genet,2013,9(1):e1003237.
[8] Jensen RB,Carreira A,Kowalczykowski SC.Purified human BRCA2 stimulatesRAD51-mediatedrecombination[J].Nature,2010,467(7316):678-683.
[9] Cramer-Morales K,Nieborowska-Skorska M,Scheibner K,et al.Personalized synthetic lethality induced by targeting RAD52 in leukemias identified by gene mutation and expression profile[J].Blood,2013,122(7):1293-1304.
[10] Krol J,Loedige I,Filipowicz W.The widespread regulation of microRNA biogenesis,function and decay[J].Nat Rev Genet,2010,11(9):597-610.
[11]Farazi TA,Spitzer JI,Morozov P,et al.miRNAs in human cancer[J].J Pathol,2011,223(2):102-115.
[12]Jiang ZC,Tang XM,Zhao YR,et al.A functional variant at miR-34a binding site in toll-like receptor 4 gene alters susceptibility to hepatocellularcarcinomainaChineseHanpopulation[J].Tumour Biol,2014,35(12):12345-12352.
[13]Tan C,Liu S,Tan S,et al.Polymorphisms in microRNA target sites of forkhead box O genes are associated with hepatocellular carcinoma[J].PLoS One,2015,10(3):e0119210.
[14]Naccarati A,Rosa F,Vymetalkova V,et al.Double-strand break repair and colorectal cancer:gene variants within 3'UTRs and microRNAs binding as modulators of cancer risk and clinical outcome[J].Oncotarget,2016,7(17):23156-23169.
[15]Han S,Gao F,Yang W,et al.Identification of an SCLC susceptibility rs7963551 genetic polymorphism in a previously GWAS-identified 12p13.33 RAD52 lung cancer risk locus in the Chinese population[J].Int J Clin Exp Med,2015,8(9):16528-16535.
[16]Lu C,Chen YD,Han S,et al.A RAD52 genetic variant located in a miRNA binding site is associated with glioma risk in Han Chinese[J].J Neurooncol,2014,120(1):11-17.

