受体相互作用蛋白激酶3在大鼠神经病理性疼痛模型中的表达及其作用机制
侯伟楠 周艳琼 李昌龙 朱敏 黄东海 罗丽红 梁锐
神经病理性疼痛是由神经系统损伤引起的一种慢性疼痛疾病,主要临床表现为痛觉过敏、触诱发痛和自发性疼痛[1]。肿瘤患者在疾病发生发展中常因肿瘤压迫、侵袭周围神经等诱导神经病理性疼痛,严重影响患者的生活质量及预后。目前神经病理性疼痛的研究热点之一是促炎因子产生神经炎症[2],但促炎因子的激活、炎症因子的来源尚未明了。受体相互作用蛋白激酶3(receptor-interacting protein kinase 3,RIP3)是调控程序性坏死和炎性因子的关键蛋白。有学者报道[3-5]RIP3在炎症反应中发挥重要作用,可通过多种途径介导炎症反应。本研究通过观察大鼠脊神经结扎神经病理性疼痛模型中RIP3的表达,探讨其在神经性病理性疼痛发病机制中的作用,为神经病理性疼痛研究、改善肿瘤患者的生活状态提供新的思路。
1 材料与方法
1.1 主要试剂和仪器
抑制剂GSK'872购自MedChem Express公司,RIP3抗体购自Abcam公司,GAPDH购于CST公司,TNF-α、IL-1β ELISA试剂盒购自欣博盛公司,即用型免疫组化试剂盒购自迈新公司;BCA蛋白检测试剂盒购自碧云天生物公司,电泳转膜设备购于Bio-rad,电动组织研磨器购于天根公司。
1.2 实验动物及分组
选取健康雄性SD大鼠40只,体重200~250 g。购自广西医科大学实验动物中心,许可证号:SCXK桂2003-0003。实验前大鼠禁食12 h,自由饮水。随机分为手术组、生理盐水组、抑制剂组和假手术组,每组10只。每天测量大鼠体重并观察是否有缩足、舔足、跛行等行为学改变。
1.3 动物模型的制备
手术组参考Kim等[6]方法建立大鼠腰5脊神经结扎模型。用10%浓度0.3 mL/kg水合氯醛麻醉大鼠,以小镊子夹大鼠后足无反应为标准。大鼠取俯卧位,沿后正中线背部皮肤(L4~S1棘突水平)做纵向切口,长度2~3 cm。在平双侧骼脊处钝性分离肌肉和筋膜,直至观察到第5腰锥横突,用止血夹折断横突,避免损伤神经,折断后可观察到腰4脊神经和腰5脊神经并行排列在下方。用眼科镊分离腰4脊神经和腰5脊神经,手术缝线针折弯套上5-0丝线绕腰5脊神经1周,结扎神经。止血,逐层缝合皮肤与肌肉。保持无菌操作,避免术后感染。假手术组手术过程同上,但不结扎脊神经。抑制剂组在造模前30 min,左手探及大鼠髋结节(平L5~6间隙)定位,右手持微量进样器于L5~6棘突间隙缓慢垂直进针,出现甩尾反射后停止进针,微量进样器缓慢注射4 μL抑制剂GSK'872(25 mmol/L)。生理盐水组造模前30 min注入等量生理盐水,与抑制剂组操作相同。
1.4 大鼠机械痛域(paw withdrawal threshold,PWT)值测定
造模后每天上午10时测量,室温(23±1)℃。用von Frey filament进行大鼠左后足底机械痛域测试,测量时以von Frey filament弯曲45°为标准,用up and down法检测大鼠的机械痛域值。大于26g记为26 g。机械痛域值越低,表示机械性触发痛越严重。
1.5 免疫组化法检测脊髓组织RIP3的表达
造模后第8天,每组各取5只大鼠灌注,固定取材,大鼠僵硬后取脊髓和背根神经节组织。标本用4%多聚甲酵固定24 h,蔗糖脱水,进行免疫组化染色。剩余大鼠断头取脊髓和背根神经节,-80℃保存。泡过多聚甲醛的组织经石蜡包埋,切片,烤片,脱蜡,脱水,抗原修复后,一抗(1∶200)4℃过夜后二抗室温孵育10 min,DAB染色,苏木素染核后在普通光镜下观察。分别对镜下阳性细胞的百分比和染色强度给予评分,阳性细胞百分比:0计为0分,1%~25%计为1分,26%~50%计为2分,51%~75%计为3分,76%~100%计为4分;阳性着色强度:无色计为0分,淡黄色计为1分,棕黄色计为2分,棕褐色计为3分。两者计分相乘即为IRS评分等级:0~4分为低表达,5~12分为高表达。
1.6 Western blot检测大鼠脊髓RIP3表达情况
用组织裂解液制备大鼠脊髓组织匀浆,4℃12 000 r/min离心5 min后取上清液,BSA法进行蛋白定量。蛋白经电泳,转膜,封闭,一抗(RIP3为1∶1 000;GAPDH 为 1∶2 000)4 ℃过夜,二抗(羊抗兔IgG 1∶2 000)室温孵育 1 h,显影,比较条带灰度值。
1.7 ELISA检测各组大鼠脊髓中TNF-α、IL-1β含量
取出保存的腰段脊髓,置于组织匀浆液,匀浆器4℃下匀浆,离心30 min,保留上清液,按照ELISA试剂盒说明书操作,检测TNF-α、IL-1β蛋白含量。
1.8 统计学方法
采用SPSS 16.0统计软件处理数据,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;对于重复测量的数据采用重复测量方差分析比较组间是否有统计学意义及各组间的变化趋势。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 大鼠体重和行为学改变情况
4组大鼠术后7 d内体重均增长,但差异无统计学意义(P>0.05),见表1。
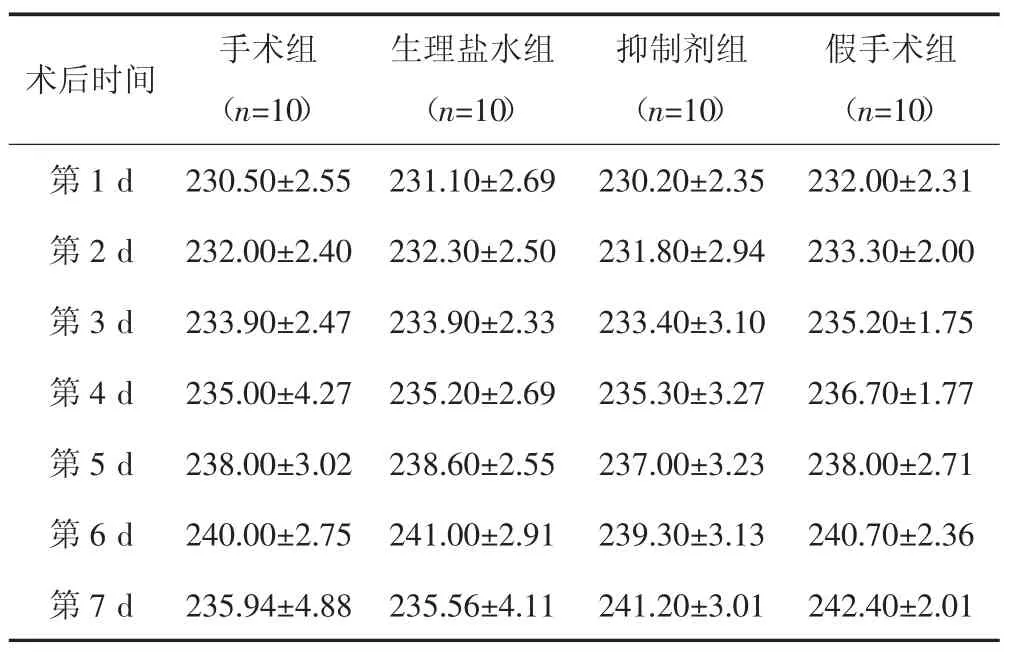
表1 术后各组大鼠体重变化[(x±s),g]
2.2 各组大鼠PWT值测定
各组大鼠造模前机械痛域值均为26 g。造模后4组大鼠术后PWT值均下降,其中生理盐水组前3 d PWT值下降后又上升,手术组、生理盐水组与假手术组PWT值呈明显下降趋势(P<0.05),但手术组与生理盐水组比较差异无统计学意义(P=0.499);抑制剂组分别和假手术组、手术组相比PWT值下降,差异有统计学意义(P<0.001)。见表2。
2.3 免疫组化法检测各组大鼠脊髓中RIP3的表达情况
手术组与生理盐水组RIP3呈强阳性表达,抑制剂组和假手术组RIP3呈弱阳性表达,且手术组和生理盐水组IRS评分明显高于抑制剂组和假手术组,差异有统计学意义(P<0.05),见图 1。
2.4 Western blot实验检测大鼠脊髓中RIP3的表达情况
手术组、生理盐水组、抑制剂组和假手术组RIP3表达水平(目的蛋白/内参蛋白)依次为 0.90±0.16、0.89±0.20、0.49±0.15、0.15±0.05。手术组与生理盐水组RIP3表达水平均高于假手术组,差异有统计学意义(t=6.855,6.746,P<0.001);抑制剂组RIP3表达水平低于手术组与生理盐水组,差异有统计学意义(t=6.855,6.746,P<0.001);生理盐水组RIP3表达水平与手术组比较,差异无统计学意义(t=0.095,P=0.926)。见图 2。
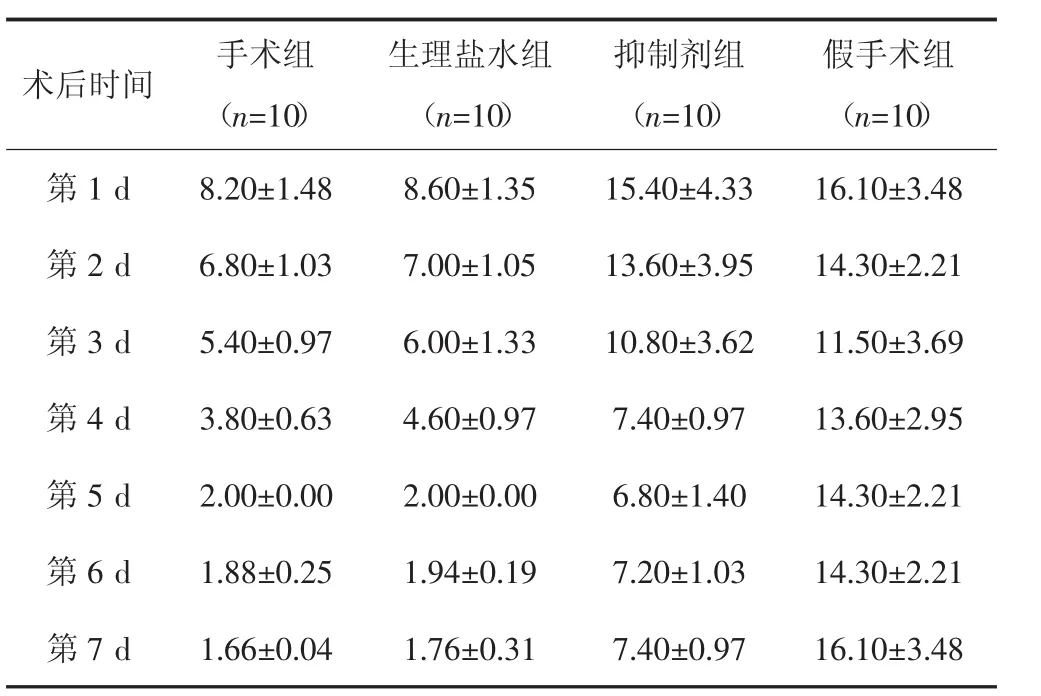
表2 术后各组大鼠PWT值变化[(x±s),g]
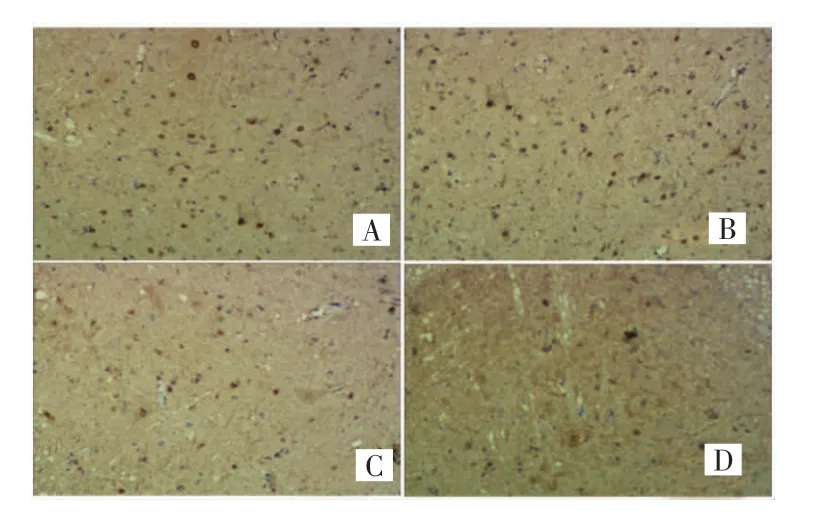
图1 免疫组化法测定各组大鼠脊髓中RIP3的表达情况(HP染色,×100)
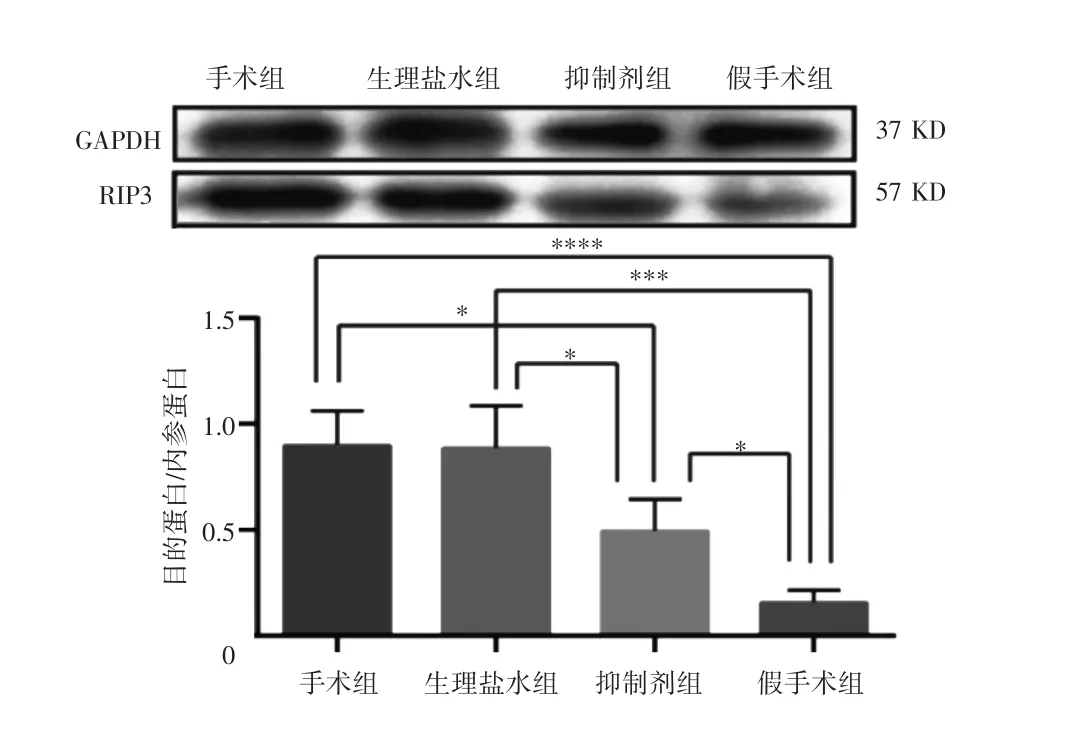
图2 Western blot实验测定各组大鼠脊髓中RIP3的表达情况
2.5 ELISA检测大鼠脊髓中TNF-α、IL-1β的含量
与假手术组比较,抑制剂组、生理盐水组和手术组 TNF-α、IL-1β 含量均明显升高(P<0.05);与抑制剂组比较,生理盐水组和手术组TNF-α、IL-1β含量升高,差异有统计学意义(P<0.001);而生理盐水组与手术组TNF-α、IL-1β含量比较,差异无统计学意义(P>0.05)。见表3。
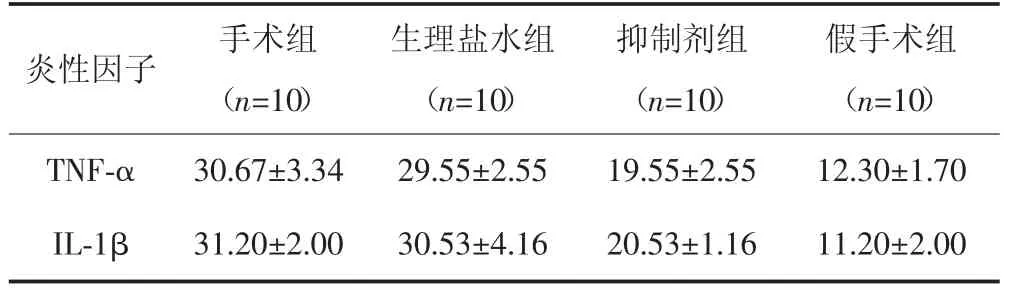
表3 ELISA检测各组大鼠脊髓中TNF-α、IL-1β的含量[(x±s),pg/mg]
3 讨论
神经病理性癌痛是癌痛的一种类型,据统计约30%的恶性肿瘤患者有神经病理性癌痛[7],严重影响患者生活质量,因镇痛不佳甚至可阻碍抗肿瘤治疗计划,但目前有关神经病理性癌痛的临床研究较少,如何有效控制神经病理性癌痛成为亟需解决的难题。脊神经结扎是神经病理性疼痛研究中常见的一种模型,其结扎部位和强度变异性较小,操作简单,可出现较长时间的机械痛敏和触诱发痛[8]。本研究手术组、生理盐水组、抑制剂组的机械痛域值均较假手术组高,提示采用腰5脊神经结扎成功构建了神经病理性疼痛模型,为后续研究奠定基础。
RIP3蛋白是程序性坏死中的重要调控分子,但目前尚缺乏有关RIP3蛋白与神经病理性疼痛的研究,本研究4组神经病理性疼痛模型大鼠中,抑制剂组分别与假手术组和手术组相比机械痛域值均下降,表明RIP3表达量高的大鼠疼痛更明显,而抑制RIP3表达疼痛减轻,提示RIP3可能在大鼠神经病理性疼痛发生过程中发挥重要作用。
目前已有大量研究表明TNF-α、IL-1β在神经病理性疼痛过程中起重要作用。姚伟伟等[9]给大鼠鞘内注射TNF-α抑制剂,发现可改善大鼠脊神经结扎诱导的神经病理性疼痛。Mei等[10]在小鼠腰5脊神经结扎模型中发现鞘内注射IL-1β中和抗体可减轻腰5脊神经结扎引起的痛觉过敏。而有研究报道RIP3是调节促炎因子的关键蛋白,可特异性激活炎症小体3,促进Caspase-1活化,从而形成炎性体,导致炎症因子 TNF-α、IL-1β 分泌[11]。在脓毒血症实验模型中[12],RIP3基因缺失或提前给予Necrostatin-1均可避免由TNF诱导的全身炎症性反应。Moriwaki等[13]研究亦发现RIP3可对炎症产生独立作用。为进一步研究RIP3与IL-1β、TNF-α等炎性因子在神经病理性疼痛发生机制中的作用,本研究采用ELISA进一步检测4组大鼠脊髓中IL-1β和TNF-α的表达,结果发现,生理盐水组和手术组TNF-α、IL-1β含量较抑制剂组高,表明RIP3可能促进了TNF-α、IL-1β分泌。分析原因认为,当结扎大鼠腰5脊神经时神经损伤,可能诱发RIP3表达增高,而RIP3蛋白通过RIP3-肿瘤坏死因子通路、RIP3-IFN通路、RIP3-LPS通路、RIP3-病原微生物通路等促进 TNF-α、IL-1β 炎性因子释放[14],导致了神经病理性疼痛发生。
综上所述,本研究用脊神经结扎的方法成功构建了神经病理性疼痛模型,发现RIP3表达增高的大鼠TNF-α、IL-1β释放增多、疼痛行为更明显;而抑制RIP3表达时TNF-α、IL-1β释放减少、疼痛程度减轻,说明RIP3蛋白可能参与神经病理性疼痛发生。但本研究仅在动物模型中验证了RIP3、炎性因子与神经病理性疼痛的关系,在大鼠体内何种因素诱发RIP3增高,神经病理性疼痛是否与程序性坏死有关,以及RIP3在人体内是否发挥同样作用,仍需一步研究。
[1] Beggs S,Trang T,Salter MW.P2X4R+microglia drive neuropathic pain[J].Nat Neurosci,2012,15(8):1068-1073.
[2] 李秋月,许海玉,杨洪军,等.促炎因子 TNF-α,IL-1β,IL-6在神经病理性疼痛中的研究进展[J].中国中药杂志,2017,42(19):3709-3712.
[3] Welz PS,Wullaert A,Vlantis K,et al.FADD prevents RIP3-mediated epithelial cell necrosis and chronic intestinal inflammation[J].Nature,2011,477(7364):330-334.
[4] Gunther C,Martini E,Wittkopf N,et al.Caspase-8 regulates TNF-alpha-induced epithelial necroptosis and terminal ileitis[J].Nature,2011,477(7364):335-339.
[5] He S,Wang L,Miao L,et al.Receptor interacting protein kinase-3 determines cellular necrotic response to TNF-alpha[J].Cell,2009,137(6):1100-1111.
[6] Kim SH,Chung JM.An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J].Pain,1992,50(3):355-363.
[7] Bennett MI,Rayment C,Hjermstad M,et al.Prevalence and aetiology of neuropathic pain in cancer patients:a systematic review[J].Pain,2012,153:359-365.
[8] Hogan Q.Animal pain models[J].Reg Anesth Pain Med,2002,27(4):385-401.
[9] 姚伟伟,周凯翔,王健,等.TNF-α抑制剂对神经病理性痛大鼠镇痛作用及其机制探讨[J].神经解剖学杂志,2016,32(4):423-428.
[10]Mei XP,Sakuma Y,Xie C,et al.Depressing interleukin-1beta contributed to the synergistic effects of tramadol and minocycline on spinal nerve ligation-induced neuropathic pain[J].Neurosignals,2014,22(1):30-42.
[11]Menu P,Vince JE.The NLRP3 inflammasome in health and disease:the good,the bad and the ugly[J].Clin Exp Immunol,2011,166(1):1-15.
[12]Duprez L,Takahashi N,Van Hauwermeiren F,et al.RIP kinase-dependent necrosis drives lethal systemic inflammatory response syndrome[J].Immunity,2011,35(6):908-918.
[13]Moriwaki K,Chan FK.RIP3:a molecular switch for necrosis and inflammation[J].Genes Dev,2013,27(15):1640-1649.
[14]于泽奇,衣泰龙,程世翔,等.受体相互作用蛋白3在炎症中的作用[J].医学综述,2016,22(16):3121-3124.

