通过新生树鼩乙型肝炎病毒感染模型动态观察宿主体内TLR-4和IL-6的表达
范倪 陆玉秀 唐艳萍 李科志 何盼 曹骥 陆玉雷 林有智 杨春
机体感染乙型肝炎病毒(hepatitis B virus,HBV)后可表现为急、慢性肝炎、肝硬化,甚至肝癌,据统计慢性乙型肝炎感染患者中约15%以上最终发展为肝癌[1]。本课题组前期建立了实验室人工繁育树鼩的基本方法,用培育的围生期树鼩接种HBV,逐步证实HBV能在树鼩体内复制,部分形成慢性HBV感染状态并逐步发生类似人类慢性乙型肝炎的病理改变[2],对多个可影响树鼩体内感染HBV效率的因素[3]进行实验筛选、优化。Toll样受体(toll-like receptor,TLRs)是重要的天然免疫受体[4],在机体天然免疫反应及诱发获得性免疫反应中起重要作用。TLR-4是最早发现能直接介导机体与病原反应的Toll样受体[5],与其配体结合后可激活信号传导途径,引发炎性因子IL-6、IL-8、IL-10等释放,与慢性乙型肝炎发生密切相关[6]。也有研究发现TLR-4基因突变或基因多态性与肝癌发生或恶性程度密切相关[7]。本实验通过研究新生期树鼩HBV感染模型体内TLR-4及其相关因子IL-6的动态变化,初步探讨慢性HBV的致病机制。
1 材料与方法
1.1 感染血源的选择
选用经检测HBsAg、HBeAg和HBcAb 3项指标均阳性,HBV-DNA 拷贝数为 7.53×107copies/mL(HBV基因亚型为C型)的慢性乙型肝炎患者的血清作为感染血源,分离血清,分装后置-80℃保存。
1.2 主要试剂与仪器
TLR-4、IL-6 ELISA检测试剂盒均购自深圳雅安达科技生物有限公司;PCR引物购自上海生物工程有限公司;RNA反转录试剂盒和荧光定量PCR试剂盒购自TAKARA宝生物工程(大连)有限公司;DNA提取试剂盒购自天根生物科技有限公司;Trizol试剂购自Life生物公司;HBsAg检测试剂盒购自中山生物工程有限公司;HBV-DNA检测试剂盒购自中山达安生物技术有限公司。PCR分析仪(LightCycler480型Ⅱ)购自瑞士Roche公司。
1.3 动物来源
本研究所涉及动物实验均严格遵循动物保护法进行。实验所用的31只新生树鼩(其中雌性16只、雄性15只)均为本实验室用成年树鼩(购自昆明动物研究所)雄雌合笼,自然受孕所产出的幼仔(约150 g)。将31只健康新生树鼩分为实验组(n=25)和对照组(n=6),实验组树鼩分别于出生第1天、第3天经双侧大腿皮下接种300 μL HBV病毒液;对照组不做任何处理。饲养环境:室温25~28℃,湿度60%~80%,每日清洁2 次[8]。
1.4 标本采集
血清采集为接种后分别于第8周、第12周、第16周、第20周、第24周经树鼩股静脉抽血,采血0.8~1.0 mL,室温下静置2~3h后分离血清,4℃、4000 r/min离心15 min,置于冻存管,-80℃保存。肝组织采集为接种后第12周开始,每间隔3~6个月定期对树鼩行麻醉后肝活检术,术前经臀大肌注射氯胺酮(浓度0.1 mL/100g)和腹腔皮下注射0.1%戊巴比妥钠(浓度0.3 mL/100g)全身麻醉后,剖腹切取肝组织约100 mg,一半置于液氮中速冻,1 h后转-80℃冻存,用于提取DNA与RNA进行分子生物学检测;另一半置入10%中性福尔马林液固定,用于病理组织学检查。
1.5 树鼩血清HBsAg和HBV-DNA病毒载量检测
1.5.1 酶联吸附反应(ELISA)检测树鼩血清HbsAg
-80℃冰箱取出血清,平衡至室温后设置样本阴性、阳性、空白对照孔,依次加入各样本血清及各对照血清,严格按照ELISA试剂盒说明书步骤进行,用酶标仪450 mm测取各孔吸光度,根据公式Cut-off值=2.1×阴性对照的均值(N)计算临界值,判断HbsAg阳性动物。
1.5.2 RT-PCR荧光探针法检测树鼩血清HBV-DNA病毒载量 提取血清DNA,向HBV反应管中各加入待检测DNA样本、HBV阳性质控品、HBV阴性质控品及阳性定量参考品,上机,PCR反应程序条件:93℃反应2 min,93℃保温45 s,55℃ 60 s,共10个循环;93℃30 s到55℃45 s退火,共30个循环。RCR分析仪计算HBV-DNA定量值。操作步骤严格按照试剂说明书进行。
根据血清HBsAg和HBV-DNA病毒载量将实验组分为慢性感染组(血清HBsAg或HBV-DNA持续阳性时间达24周)和疑似慢性感染组(血清HBsAg或HBV-DNA不连续出现2次或2次以上阳性)。
1.6 双抗体夹心法检测树鼩外周血TLR-4、IL-6蛋白表达水平
-80℃冰箱取出血清,平衡至室温后,设置空白孔、标准品孔、样本反应孔,加样后严格按照试剂盒说明书操作步骤进行。在酶标仪450 mm波长测量各孔吸光度;计算标准曲线的回归方程,计算对应样品浓度,以pg/mL为单位。严格按照试剂说明书进行。
1.7 RT-PCR法检测树鼩肝组织TLR-4、IL-6 mRNA的表达水平
-80℃冰箱取出冰冻肝组织,Trizol提取肝组织总RNA,逆转录成cDNA,以逆转录后的cDNA为模版,进行 RT-PCR,采用 2-△△Ct法计算肝组织中 TLR-4、IL-6 mRNA的相对表达量。引物序列信息见表1。PCR反应体系:SYBR Premix Ex Taq II(2×)10 μL,PCR上、下游引物(10 μM)各 0.4 μL,DNA 模板 2.0 μL,ddH2O 6.2 μL,总反应体系 20 μL。两步法 PCR 扩增,反应条件:95℃预变性30 s;95℃变性5 s;60℃退火34 s,共40个循环,95℃延伸15 s。
1.8 统计学分析
采用SPSS 19.0统计软件进行数据分析。计量数据用均数±标准差(x±s)表示,组间比较采用单因素方差分析,若整体差异有统计学意义,进一步的两两比较使用LSD检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 树鼩血清HBsAg和HBV DNA病毒载量检测结果
在第8~24周观察周期内,实验组25只接种树鼩HBsAg和(或)HBV-DNA均阳性12只,其中慢性感染组7只,疑似慢性感染组5只,HbsAg和HBV-DNA均阴性13只(不纳入研究)。对照组血清HBsAg和HBV-DNA均阴性。
2.2 双抗体夹心法检测树鼩外周血TLR-4、IL-6蛋白表达水平
在第8周、第12周、第16周、第20周、第24周,慢性感染组与疑似慢性感染组树鼩外周血TLR-4蛋白表达水平均高于对照组(P<0.05),但慢性感染组与疑似慢性感染组差异无统计学意义(P>0.05);慢性感染组与疑似慢性感染组树鼩外周血IL-6蛋白表达水平均高于对照组(P<0.05),慢性感染组与疑似慢性感染组第8周、第12周、第16周IL-6蛋白表达水平差异无统计学意义(P>0.05),在第20周、第24周差异有统计学意义(P<0.05)。见表2。
2.3 RT-PCR法检测树鼩肝组织TLR-4、IL-6 mRNA的表达水平
第12周,疑似慢性感染组与慢性感染组IL-6 mRNA表达水平均高于对照组,差异有统计学意义(P<0.05);慢性感染组TLR-4 mRNA表达水平高于对照组,差异有统计学意义(P<0.05)。见表3。

表1 引物序列信息
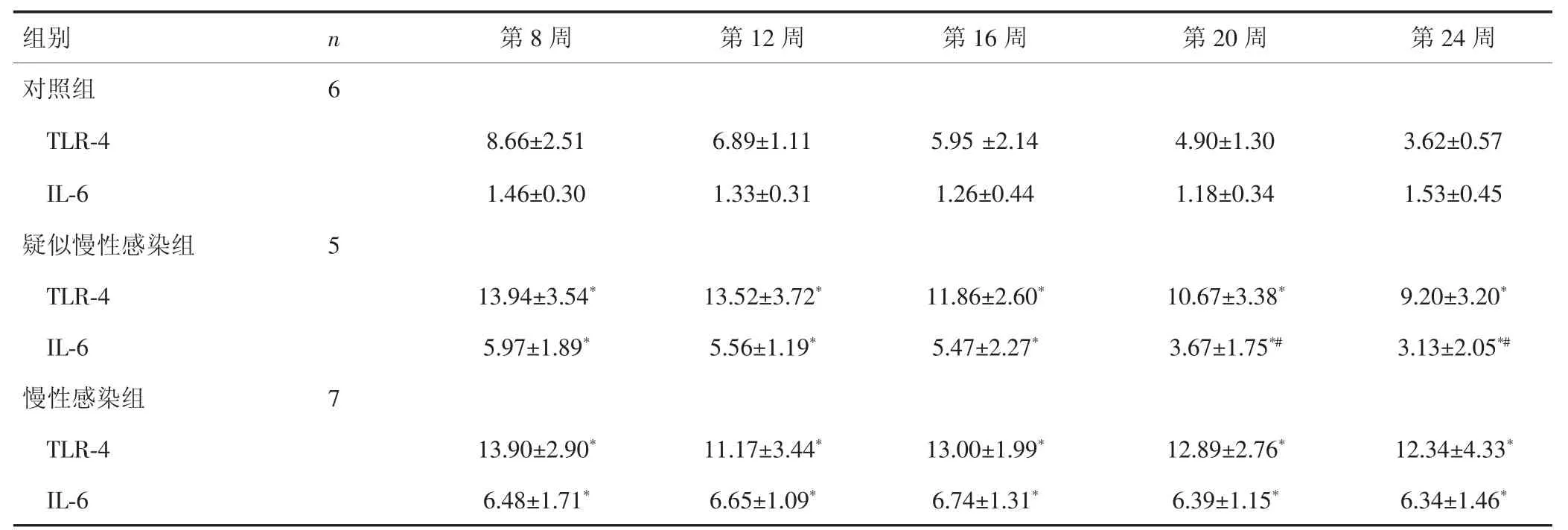
表2 3 组树鼩外周血 TLR-4、IL-6 蛋白水平的比较[(x±s),ng/mL]

表3 3组树鼩肝组织中IL-6及TLR-4 mRNA表达水平的比较(x±s)
3 讨论
HBV感染是我国肝癌发生的主要因素,多数肝癌发生与慢性HBV关系密切,特别是与乙型肝炎病毒复制密切相关,而机体抗HBV病毒侵扰主要通过感染早期先天免疫反应和后期病毒持续感染导致的特异免疫反应。宿主感染HBV的病程变化及不同转归,取决于机体对病毒免疫应答的强弱。HBV的清除应答包括强效的先天免疫和后天获得性细胞应答,不同感染状态可能在病毒清除过程中有不同影响[9]。HBV与先天、后天免疫之间的关系决定感染的结局[10]。
TLR-4是一类病原分子识别受体,与其配体结合后可被激活,活化信号通路,最终进入细胞核内,启动核内相关基因,转导出相应的mRNA,合成并释放IL-6、IL-8、TNF、IFN等细胞因子,引起毛细血管通透性增高、淋巴细胞浸润等炎症反应,发挥早期免疫应答效应。此外,TLR-4活化可诱导表达协同刺激信号,目前已有证据表明巨噬细胞和树突状细胞上的协同刺激分子 B7(CD86/CD80)出现可能与此有关[11]。IL-6 来源于单核巨噬细胞、活化的T细胞、B细胞、成纤维细胞及上皮细胞等,为体内重要的致炎性细胞因子。当HBV感染发生后,血清IL-6含量明显升高,这与肝细胞受损,产生大量抗原免疫应答反应,使单核细胞、淋巴细胞等被激活后分泌IL-6,可调节多种急性期反应蛋白合成有关[12]。此外有研究[13]发现,在肝癌组织中TLR-4表达与NF-κB表达呈正相关,其下游炎性因子IL-6的表达量亦升高,说明TLR-4/NF-κB/IL-6通路激活可能促进肝癌发生发展。
根据2015年《乙型肝炎诊断标准》[14],慢性乙型肝炎症状持续半年以上可诊断为慢性乙型肝炎感染。本研究接种的25只树鼩,其中HBV-DNA或HBsAg出现2次或以上阳性12只,其中HBV-DNA和(或)HBsAg能持续24周阳性,形成慢性感染7只;另5只疑似慢性感染不连续出现HBV-DNA或HBsAg阳性。检测发现疑似慢性感染组与慢性感染组新生树鼩血清TLR-4、IL-6分泌水平高于对照组,表明人HBV能在新生树鼩体内成功感染,激活树鼩体内的免疫应答。其中,树鼩血清中TLR-4和IL-6的表达量在疑似慢性感染组与慢性感染组中均较对照组明显升高,但是疑似慢性感染组与慢性感染组间的表达量大部分时间无明显差异。可见TLR-4、IL-6在HBV感染过程中均升高,与人乙型肝炎感染者的血清TLR-4、IL-6表达水平一致。本研究发现TLR-4与IL-6在血清中的分泌量,疑似感染组随时间呈进行性下降趋势,而慢性感染组保持相对恒定高水平分泌,可能是疑似慢性感染组树鼩呈一过性感染表现,机体通过体内免疫反应,引起被感染细胞凋亡,并促进机体的适应性免疫,最终清除感染病毒[15]。
进一步采用RT-PCR法检测3组树鼩肝组织中TLR-4及IL-6 mRNA的表达,发现疑似慢性感染组与慢性感染组树鼩实验第12周肝组织中TLR-4、IL-6 mRNA表达量高于对照组,说明树鼩感染HBV后肝组织中TLR-4、IL-6持续升高,再次验证TLR-4、IL-6在HBV感染过程中可能起重要作用。
本实验表明,新生树鼩感染HBV可观察到与人感染HBV相似的免疫变化过程,说明树鼩在感染人HBV后可产生与人类相似免疫应答过程,给应用树鼩感染HBV模型研究人乙型肝炎的致病机制提供新思路。同时检测TLR-4与IL-6可能有助于了解HBV患者机体的免疫情况,对临床判断病情进展程度有一定意义。此外,由于HBV持续复制可能导致肝癌发病率升高,在HBV感染早期阶段采用TLR-4激动剂,抑制HBV复制从而减轻肝脏损伤可能有助于预防肝癌的发生。
[1] 魏矿荣,彭侠彪,梁智恒,等.全球肝癌流行概况[J].中国肿瘤,2015,24(8):621-630.
[2] Ruan P,Yang C,Su J,et al.Histopathological changes in the liver of tree shrew (Tupaia belangeri chinensis) persistently infected with hepatitis B virus[J].Virol J,2013,10:333.
[3] 陆玉秀,范倪,唐艳萍,等.不同剂量乙肝病毒对新生树鼩感染的影响[J].广西医科大学学报,2017,34(5):646-649.
[4] Lu X,Xu Q,Bu X,et al.Relationship between expression of toll-like receptors 2/4 in dendritic cells and chronic hepatitis B virus infection[J].Int J Clin Exp Pathol,2014,7(9):6048-6055.
[5] 朱楠.Toll样受体4致乙型肝炎病毒免疫损伤的研究进展[J].肾脏病与透析肾移植杂志,2011,20(1):50-53.
[6] Zhang S,Yang N,Ni S,et al.Pretreatment of lipopolysaccharide(LPS)ameliorates D-GalN/LPS induced acute liver failure through TLR4 signaling pathway[J].Int J Clin Exp Pathol,2014,7(10):6626-6634.
[7] 张艳婷.TLR4、NF-κB、IL-6、HSP60 在肝癌患者外周血中的表达及意义[D].宁夏:宁夏医科大学,2014.
[8] 梁亮,李瑗,杨春,等.树鼩实验室繁殖及育幼的探讨[J].四川动物,2005,24(2):199-201.
[9] 殷稼雯,王进科,殷国庆,等.HBV感染免疫学应答的新进展和新观点[J].中国肝脏病杂志(电子版),2016,8(3):34-37.
[10]王琴,刘嘉,杨东亮,等.慢性HBV感染的天然免疫与获得性免疫应答[J].临床肝胆病杂志,2016,32(10):1863-1869.
[11]王慧.TOLL样受体4在慢性HBV感染患者外周血单个核细胞中的表达及意义[D].济南:山东大学,2007.
[12]刘锋.IL-6/PGRN/mTOR途径在肝细胞癌中的功能[D].济南:山东大学,2016.
[13]张艳婷,杨少奇,孟磊,等.TLR4在肝癌患者外周血单核细胞中的表达及意义[J].宁夏医科大学学报,2014,36(2):161-163.
[14]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015 年更新版)[J].临床肝胆病杂志,2015,31(12):1941-1960.
[15]朱大艳,赵钢.Toll样受体与乙型病毒性肝炎的研究进展[J].中国中西医结合消化杂志,2012,20(1):41-43.

