轻度脑外伤急性期局部脑区的区域一致性变化
王田尧 魏春晓 刘永康 刘 军*
研究显示大部分轻度脑外伤(mild traumatic brain injury,mTBI)患者在受伤后一周内存在一定程度的认知和情感功能的异常,部分患者的症状可以持续3~6个月甚至更长时间,而临床目前依旧缺乏可靠的检测手段来明确诊断以及预测患者临床转归。
静息态脑功能成像(resting-state functional MRI,rsfMRI)作为无创性研究手段,通过显示静息状态下脑内不同功能区之间的功能连接模式的变化来反映人类的认知和行为变化,在各种精神和神经系统疾病中得到了广泛应用。区域一致性(regional homogeneity,ReHo)作为测量局部活动模式的指标,ReHo假设自发给定体素的神经活动与其相邻的体素类似,是一种基于数据驱动的方法,不需要事先提供感兴趣区域,所以具有良好的可重复性。作为局部短距离连通的测量指标,ReHo可以被用来测量mTBI导致的局部区域损伤。最近的研究显示ReHo在诸如阿尔茨海默病、帕金森病及抑郁症等许多疾病的诊断中都有较好的应用[1-2]。
已有研究显示静息态功能成像在评估急性期mTBI患者脑损伤的病理生理方面有着极其重要的作用,急性期出现的脑功能连接异常与患者临床症状的持续性可能存在一定的联系[3]。本研究旨在检测mTBI患者在创伤早期(创伤后3天内)的脑功能网络连接的异常。
方 法
1.资料
本研究包括47例早期(创伤后3天内)mTBI患者(男性31例,女性15例,平均年龄30.04±6.82岁)和37例年龄、性别相匹配的健康志愿者(男性20例,女性15例,平均年龄31.41±8.67岁)。mTBI诊断依据1993年美国康复医疗协会(American Congress of Rehabilitation Medicine,ACRM)制定的标准[4]。mTBI患者的入组标准:①创伤后应该在1周内,最好24小时或48小时以内;②GSC评分13~15分;③意识丧失(LOC)<30分钟;④创伤后失忆(PTA)<24小时。mTBI患者的排除标准:①既往有耳部手术史、头部外伤史;②神经发育或神经方面障碍(痴呆症或精神错乱),心理疾病;③妊娠;④缺血性和出血性脑卒中;⑤30天内违禁药物服用史;⑥尿毒症,肝硬化,心力衰竭,肺水肿,凝血功能障碍,肾功能不全;⑦活体植入物(如铁,耳蜗植入物,血管夹等)以及心脏起搏器等MRI检查禁忌物;⑧病人送抵医院前已接受心肺复苏;⑨常规颅脑CT有异常表现。
2.图像采集与分析
2.1 图像采集:所有的图像采集于Philips Achieva 3.0T TX MRI scanner,采集序列包含DWI、3D-T1WI MPRAGE(TR/TE =8.2ms/3.5ms;flip angle=8degree;resolution=1mm×1mm×1mm。slice thickness=1mm,voxel size=1mm×1mm,FOV=256mm×256mm)、以及静息态血氧饱和 成 像(TR/TE=1500/35,flip angle=90,resolution=3.75mm×3.75mm×5mm。sl°ice thickness=5mm,voxel size=3.75mm×3.75 mm,FOV=240mm×240mm,matrix 64×64,dyn=210,total acquisition time is 5.35minutes)。在图像采集期间所有被试者被要求睁眼,保持身体静止以及尽量不思考问题。
2.2 数据分析:基于MATLAB 2013b平台和SPM8工具包,采用由北京师范大学认知神经科学与学习国家实验室开发的DPARSF(v2.3)批处理工具包下对实验数据进行处理。步骤如下:①去除功能像扫描前10个时间点的数据;②层面内时间校正;③头颅运动校正;④空间标准化;⑤平滑处理;⑥去线性飘移;⑦频域滤波。对低频振荡0.01~0.08Hz频带计算脑功能信号的功率并进行开方,得到脑功能低频振荡幅度值(amplitude of low frequency fluctuation,ALFF)和比率低频振幅值(fraction amplitude of low frequency fluctuation,fALFF)。在数据计算第⑤步前直接计算ReHo图,即计算每个体素的肯德尔和谐系数 (Kendall's coefficient of concordance,KCC),脑内每个体素与其周围相邻的体素在时间序列上的一致性。
3.统计分析
对mTBI组和正常对照组的数据进行双样本t检验(P<0.05,连续体素>228),获得两组间脑激活区的ALFF、fALFF及ReHo差异t图,利用REST工具包报告体素值有显著性差异的区域所在的解剖位置、坐标(MNI 坐标)及激活强度(t值)。
结 果
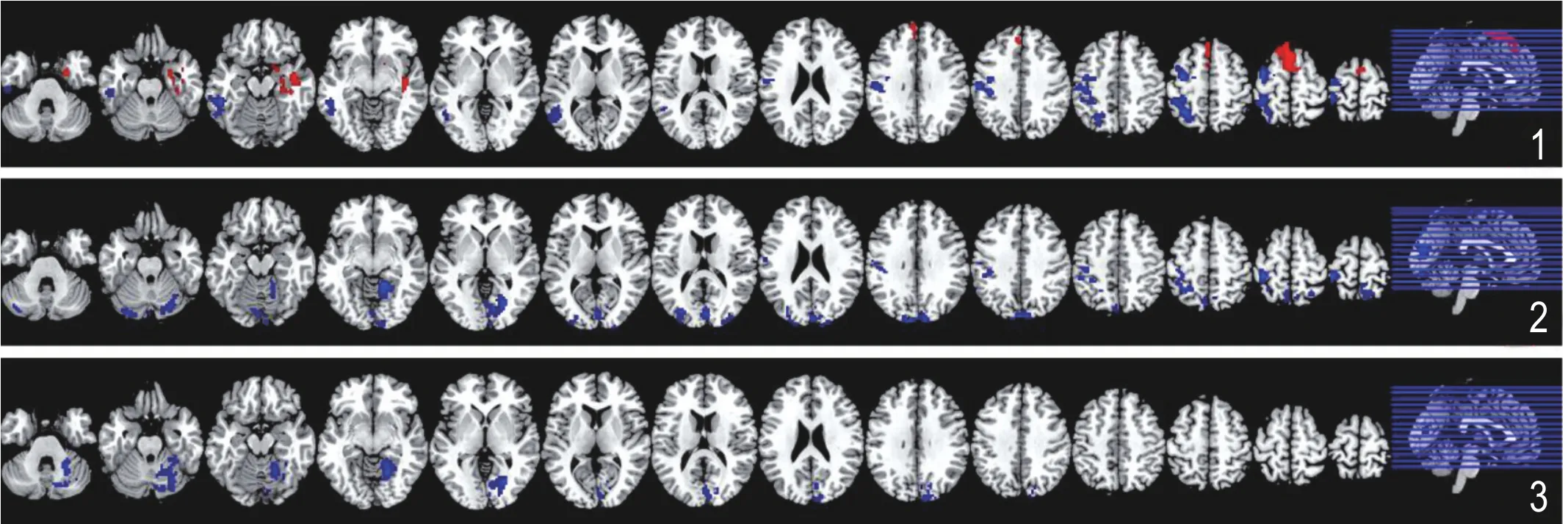
图1 ReHo脑网络连接。红色区域为功能连接增强,蓝色为功能连接减弱;图2 ALFF脑网络连接。红色区域为功能连接增强,蓝色为功能连接减弱;图3 fALFF脑网络连接。红色区域为功能连接增强,蓝色为功能连接减弱。
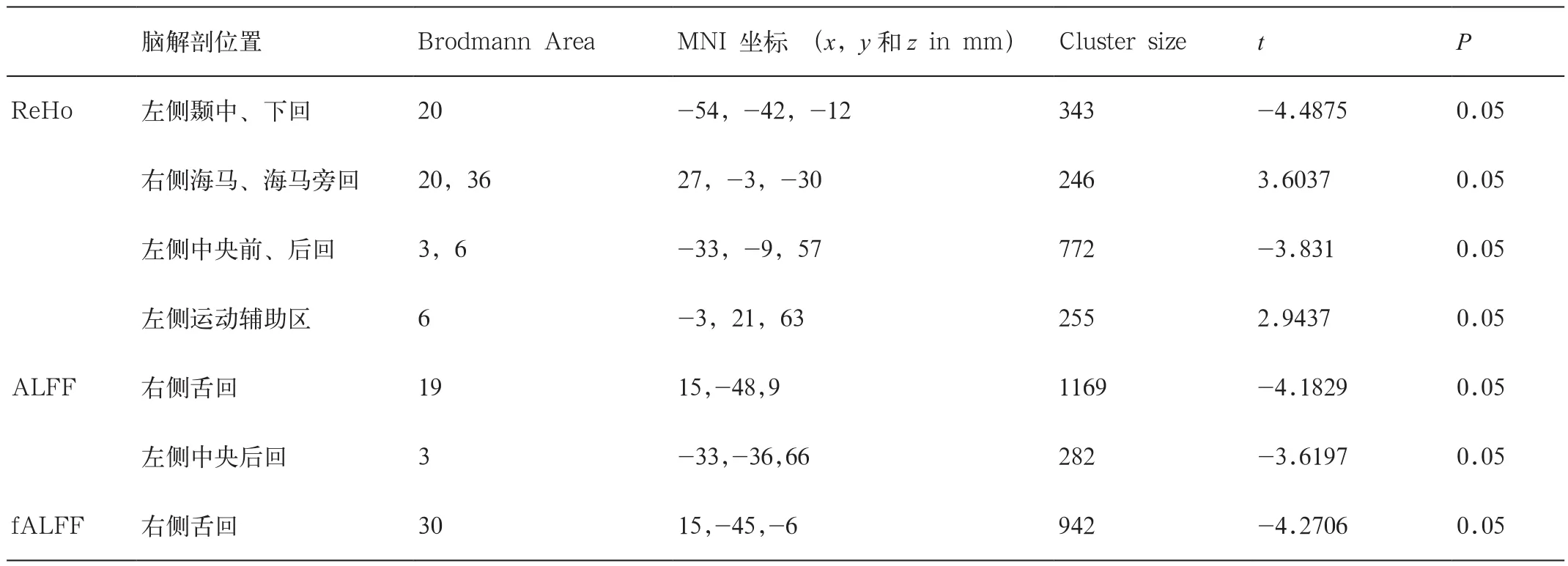
表1 mTBI组较健康对照组静息态脑激活网络改变
急性期轻度脑外伤患者较健康对照组出现左侧颞中回、颞下回、中央前(后)回、舌回的不同程度的局部一致性脑功能连接减弱。在右侧海马及海马旁回和左侧运动辅助区出现局部一致性脑功能连接增强(图1~3及表1)。
讨 论
由于临床常规CT、MRI检查的局限性,mTBI在临床很容易被忽视。实际上mTBI患者也同样存在不同程度的脑组织结构和功能的微损伤,正因为存在这些损伤或可解释患者出现甚至长期存在的神经生理功能及认知功能损伤的症状。在我们前期研究中发现该组早期mTBI患者已经存在双侧额叶的弥散FA显著性减低,提示他们存在特定的解剖结构损伤[5]。本研究采用静息态功能磁共振成像探究早期mTBI患者的脑组织功能连接改变的基础,结果发现该组早期mTBI患者在左侧颞叶、左侧中央前、后回、右侧边缘叶以及左侧运动辅助区脑功能连接出现显著的异常,这些损伤和患者的临床症状之间存在一定的相关性,为进一步深入解释和评估mTBI患者的临床转归提供了一定的理论依据。
本研究中一个ReHo减低的cluster跨越了左侧中央前、后回。而此处被认为是感觉网络的重要组成部分[3,6],中央前回作为初级运动皮质的重要构成部分,与运动规划和执行相关,而中央后回是初级触觉感觉皮质,主要接受机体触觉感觉。在Elena的TBI研究中发现感觉网络连接的增加可能与注意障碍呈正相关[7],而感觉网络连接减弱可能与运动的计划和执行能力减低相关[3,8]。在本组被试中该区域的ReHo减低可能提示患者的计划和执行运动功能受到一定的损伤。
另外一个ReHo减低的cluster位于右侧海马和海马旁回。海马结构对于情绪记忆至关重要,其涉及到机体的记忆编码和检索[9]。此外海马和海马旁回也是脑默认网络的重要组成部分。在TBI后出现记忆和认知障碍的患者人群研究中大量的证据提到海马结构的萎缩,同样颞叶由于位于大脑表面邻近颅骨,在中度至重度TBI后通常也出现显著的萎缩[10-12]。而这些改变在mTBI研究中,目前文献支持较少。在Bigler等的mTBI研究中提到了海马功能网络连接受损[10,12-13]。本研究中出现右侧海马及海马旁回区域的ReHo增加可能提示患者出现记忆受损后右侧海马区域对于记忆的代偿作用。
运动辅助区是位于大脑半球内侧面的主要与运动功能相关的区域,与运动的计划有关,其主要参与机体自身产生和控制的运动,而不是外界刺激下产生的运动。例如运动辅助区参与从记忆中产生的序列运动[14]。在Chandler的研究中发现mTBI患者中出现记忆障碍的人群在运动辅助区出现功能连接增加[15]。本组研究中同样出现了左侧运动辅助区的ReHo增加,提示可能与记忆障碍相关。
虽然这些ReHo的变化与mTBI后的病理生理机制的关联尚未完全阐明,但一部分区域的ReHo变化却可以解释mTBI引起的机体功能异常[3]。因此这种可能的相关性值得进一步探究。
我们认为临床的常规CT/MRI检查对于mTBI的诊断帮助十分有限,而在患者有一定的临床症状前提下,功能磁共振检查十分必要。功能磁共振对于mTBI患者的临床症状以及转归的解释十分有帮助。
本研究依然存在一定的局限性,首先被试样本量比较小,受限于mTBI患者的来源多样性,所以部分研究结果不一定具有可重复性,而更大样本的研究可以减低这些因素对于结果的影响。另外受限于条件,这组mTBI患者中被试缺失了部分认知功能评估,故认知功能的统计结果并未纳入本次研究结论中。接下来的工作,我们会重点观察这些被试的长期随访的临床转归情况,并且纳入弥散张量成像研究结果,来进一步探究mTBI后脑解剖结构和功能连接的改变。
[1]Liu Y, Zhao X, Cheng Z, et al. Regional homogeneity associated with overgeneral autobiographical memory of first-episode treatment-naive patients with major depressive disorder in the orbitofrontal cortex:A resting-state fMRI study. Journal of Affective Disorders,2016,209:163-168.
[2]Kang DW. Impact of amyloid burden on regional coherence changes in preclinical Alzheimer’s disease: a resting state fMRI study.Alzheimer's & Dementia: The Journal of the Alzheimer's Association,2017, 13:1538-1539.
[3]Zhan J, Gao L, Zhou F, et al. Decreased regional homogeneity in patients with acute mild traumatic brain injury: a resting-state fMRI study. The Journal of Nervous and Mental Disease, 2015, 203:786-791.
[4]Kay T, Harrington DE, Adams R, et al. De finition of mild traumatic brain injury. Journal of Head Trauma Rehabilitation.,1993,8:86-87.
[5]Liu Y, Wang T, Chen X, et al. Tract-based Bayesian multivariate analysis of mild traumatic brain injury. Computational and Mathematical Methods in Medicine, 2014, 2014:120182.
[6]Agcaoglu O, Miller R, Mayer AR, et al. Lateralization of resting state networks and relationship to age and gender. Neuroimage, 2015,104:310-325.
[7]Shumskaya E, van Gerven MA, Norris DG, et al. Abnormal connectivity in the sensorimotor network predicts attention deficits in traumatic brain injury. Experimental Brain Research, 2017, 235:799-807.
[8]齐志刚,王晓怡,邬 霞,等. 健康老年人的海马功能连接:基于体素的相关分析研究. 中国医学计算机成像杂志,2013,19:115-119.
[9]Eichenbaum H, Yonelinas AP, Ranganath C. The medial temporal lobe and recognition memory. Annu Rev Neurosci, 2007, 30:123-152.
[10]Terpstra, AR. Higher Anxiety Symptoms Predict progressive hippocampal atrophy in the chronic stages of moderate to severe traumatic brain injury. Neurorehabil Neural Repair, 2017, 31:1063-1071.
[11]Ng K, Mikulis DJ, Glazer J, et al. Magnetic resonance imaging evidence of progression of subacute brain atrophy in moderate to severe traumatic brain injury. Archives of Physical Medicine and Rehabilitation, 2008, 89:S35-S44.
[12]Bigler ED. Default mode network, connectivity, traumatic brain injury and post-traumatic amnesia. Brain, 2016, 139:3054-3057.
[13]Rangaprakash D, Deshpande G. Compromised hippocampus‐striatum pathway as a potential imaging biomarker of mild‐traumatic brain injury and posttraumatic stress disorder. Human Brain Mapping, 2017, 38:2843-2864.
[14]Shima K, Tanji J. Both supplementary and presupplementary motor areas are crucial for the temporal organization of multiple movements. Journal of Neurophysiology, 1998, 80:3247-3260.
[15]Sours C, Zhuo J, Janowich J, et al. Shanmuganathan K, Gullapalli RP.Default mode network interference in mild traumatic brain injury–a pilot resting state study. Brain Research, 2013, 1537:201-215.

