应用DWI指导胶质瘤放疗靶区勾画的初步研究
倪春霞 汪 洋 于同刚 周菊英 盛晓芳 孟 歌
间变性星形细胞瘤(AA)和胶质母细胞瘤(GBM)是临床上最常见的高级别胶质瘤(high grade glioma,HGG)。该类肿瘤预后差,推荐术后进行放疗。但无论是2016年NCCN指南还是《中国中枢神经系统胶质瘤诊断和治疗指南》,均未对以上两种肿瘤的放疗靶区进行细分,而事实上病理类型不同,肿瘤对周围组织的浸润范围和浸润细胞的密度是不同的,在放疗技术上应有所区别。目前相关研究很少。近年来多项研究表明DWI技术可以帮助界定胶质瘤边界及其周围情况,并能通过ADC值进行定量分析[1-2]。本研究通过DWI技术,测量新诊断的HGG(包括AA和GBM)术后残留肿瘤及周围不同区域的ADC值,探讨其在放疗靶区勾画方面的价值。
方 法
1.临床资料
201 3年9月至2014年12月我院收治的术后有残留的AA和GBM新诊断患者。共有76例患者入组,其中24例AA,52例GBM;男性51例,女性25例;病灶部位:颞叶26例,额叶21例,枕叶10例,顶叶7例,丘脑基底节5例,小脑5例,胼胝体2例;患者中位年龄47岁。入组患者在术后2~4周内接受放疗,并在放疗开始前3天内行常规增强MRI、DWI检查。
2.仪器与方法
2.1 MRI检 查: 采 用 GE Signa 1.5T MRI扫描仪,单通道头颅线圈进行常规MRI和DWI检查。先行常规MRI扫描,包括轴位FSE T1WI(TR/TE=440ms/14ms),轴 位T2WI(TR/TE=3300ms/92ms),矢 状 位T1WI (TR/TE=440ms/9.4ms);然后行增强扫描,增强采用钆喷酸葡胺(Gd-DTPA,北陆公司),肘静脉注射,剂量为0.15mmol/kg。DWI均在注射对比剂前进行,DWI(TR/TE=4900ms/85ms)的扩散敏感因子b值取1000s/mm2,层厚6mm,间隔2mm,采集时间39秒。
2.2 图像及参数采集:利用AW4.5工作站的Functool 9.4.05a软件包对图像进行后处理。感兴趣区的选取:参照中国胶质瘤治疗指南推荐,肿瘤区为结合术前、术后的T1增强和T2/FLAIR所显示的残留肿瘤组织;肿瘤外侧再分4个区域,即:肿瘤外0~1cm区域为近瘤周区、1~2cm区域为中瘤周区、2~3cm区域为远瘤周区及3~4cm区域为瘤周区外(本研究中1cm处划为近瘤周区,2cm处划为中瘤周区,3cm处为远瘤周区)。以上区域均随机选取区内五个不同部位,作为感兴趣区(regions of interest,ROI),分别测量ADC平均值、ADC最小值,测量时注意避开脑沟、脑室、出血、坏死和囊变区。
3.图像融合方法
DWI图像不能直接应用于放疗计划的设定,通过医科达公司的Oncentra治疗计划系统自带的图像融合功能,进行定位CT与常规MRI、DWI图像融合 (图1)
4.统计学处理
应用SPSS 16.0软件进行统计分析,计量资料以均数±标准差表示,对所得数据均采用独立样本t检验,P值<0.05为差异有统计学意义。
结 果
本组病例各区域的ADC值(包括平均值和最小值)见表1、2。可见,AA的ADC值(包括平均值及最小值)在近瘤周区最大;而GBM的ADC值在中瘤周区达到最大。对本组病例进行单独样本t检验,结果显示:在肿瘤区、中瘤周区和远瘤周区,AA和GBM的ADC值(包括最小值和平均值)均有统计学差异;在瘤周区外,两组无显著差异(表3、4)。

表1 HGG残留肿瘤及其瘤周区ADC平均值情况(×10-3mm2/s)
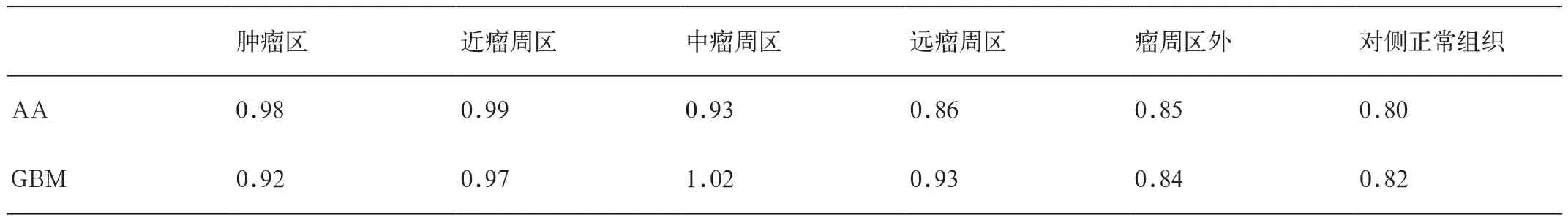
表2 HGG残留肿瘤及其瘤周区ADC最小值情况(×10-3mm2/s)

表3 ADC平均值独立样本t检验

表4 ADC最小值独立样本t检验
讨 论
HGG预后差、生存期短,推荐行术后放疗。2015年版《中国中枢神经系统胶质瘤诊断和治疗指南》对放疗靶区作了明确推荐,即:GTV(大体肿瘤体积,gross tumor volume)为术后残留病灶和(或)术腔;第一临床阶段靶体积(clinical target volume,CTV1)为GTV外扩2cm,第二临床阶段靶体积(CTV2)为GTV外扩1cm。目前放疗靶区的勾画主要依赖CT和常规MRI,但CT和常规MRI很难将残留肿瘤与水肿区分开来,同时对肿瘤周围瘤细胞浸润的情况也难以精确显示。DWI可以通过检测水分子扩散运动来显示病变的微观结构变化,并通过ADC值进行定量分析,因此有望对瘤周区域进行勾画。近年来,DWI已被逐渐应用于恶性肿瘤的放疗[3]。既往有研究[4]将胶质瘤患者CT图像和尸检病理对照,认为CT上瘤周3cm范围内仍可见散在肿瘤细胞浸润。本研究基于以上情况,将肿瘤区及周边区域共划分为5个区域分别测量,希望得出不同级别HGG在以上区域内是否有差别,初步探讨DWI对HGG术后放疗靶区的指导作用。
既往研究显示ADC值与胶质瘤细胞密度成反比关系[5]。Nakai等[6]认为ADC平均值与胶质瘤的细胞密度相关;而Laprie等[7]则认为ADC最小值代表了肿瘤增殖最旺盛、细胞密度最大、恶性程度最高的区域,故本研究将ADC平均值和ADC最小值均纳入进行分析。
在肿瘤区,本研究结果显示肿瘤ADC值比近瘤周区低,即在DWI上可将残留肿瘤和周边水肿区分开来,以指导GTV勾画。这与既往研究结果一致[8]。同时AA的ADC值(ADC平均值为1.14×10-3mm2/s,ADC最小值0.98×10-3mm2/s)高于GBM组(ADC平均值为1.05×10-3mm2/s,ADC最小值0.92×10-3mm2/s),且两者差异显著(P均为0.01)。这主要是因为GBM肿瘤细胞密度更高,细胞更密集所致,Higano等[9]也认为ADC值可区分AA和GBM。GBM肿瘤区域细胞密集,恶性程度更高,对比AA在该区域(即GTV)应接受更高剂量的照射,以达到更好的局部控制。
HGG向周围浸润性生长,并且距离肿瘤越远细胞浸润越少[10]。在瘤周区域,肿瘤细胞密度逐渐减低,同时肿瘤刺激造成浸润性水肿,水分子弥散明显增加,造成ADC值逐渐升高,本研究中,AA组在近瘤周区达到最高,而GBM组则在中瘤周区达到最大。之后随着肿瘤细胞浸润减少,对血管刺激减轻,血管通透性恢复,水分子外渗减少,ADC值逐渐降低,直至与正常脑组织相当。
通过独立样本t检验,AA组和GBM组在近瘤周区差异不显著,而中瘤周区、远瘤周区差异显著。近瘤周区无论是AA,还是GBM都有大量的肿瘤细胞的浸润,是放射治疗的重点区域,但GBM组的ADC平均值(1.14×10-3mm2/s)比AA组的ADC平均值(1.19×10-3mm2/s)低,表明在该区域(即《中国中枢神经系统胶质瘤诊断和治疗指南》中的CTV2)GBM的肿瘤细胞浸润更密集,两组有差异,说明GBM可能需要比AA更大的照射剂量,但差异无统计学意义,需要进一步加大样本量进行研究;在中瘤周区AA因肿瘤细胞浸润减少,血管通透性逐渐恢复,ADC值开始下降;而GBM的中瘤周区仍有大量浸润肿瘤细胞的刺激,血管通透性达到最大,故ADC值达到最大,两者在此区域差异显著。故在CTV2临床推量照射时GBM可能需要比AA有更大的照射范围,可能需要包及瘤周外2cm的区域;在远瘤周区,AA组因肿瘤细胞浸润较少,血管通透性进一步恢复,ADC值继续下降,只比对侧正常脑组织略高;而GBM组也随着肿瘤细胞周边浸润渐变的特点,肿瘤细胞浸润减少,血管通透性有所恢复,ADC值略有下降,但仍明显比对侧正常脑组织高,故在《中国中枢神经系统胶质瘤诊断和治疗指南》CTV1的照射阶段,AA可能仅需至GTV外2cm,而GBM则可能需要至GTV外3cm;在瘤周区外,无论是AA组,还是GBM组,ADC值与对侧正常脑组织均基本接近,考虑该区域已无明显的肿瘤细胞浸润及相关的刺激性水肿,可不行预防性照射,与指南相符。
根据以上研究结果,AA应与GBM的放疗靶区应有所不同,AA的放疗靶区可相应缩小,AA的生存时间相对较长,减少照射容积,可能有助于提高患者生活质量。而GBM因为残留肿瘤细胞密度高,肿瘤向周边区域侵犯范围广,侵犯程度重,需要较AA组更大的照射范围和照射剂量。
本研究将ADC平均值和ADC最小值均纳入进行分析,结果显示两组的ADC最小值的变化规律与ADC平均值保持一致。但是肿瘤以及肿瘤周围区域内肿瘤细胞的分布是不均匀的。如果给予某个靶区以均匀剂量照射,部分肿瘤细胞可能因为剂量不足而导致日后的复发,而该区域的其他部位可能会因为照射剂量过高,发生放射性损伤。笔者认为无论是残留肿瘤区,还是瘤周区,ADC最小值区域代表了肿瘤细胞密度最高及浸润最严重的区域,该区域应提高照射剂量,达到精准照射的目的。因此,DWI技术有助于HGG及其周边组织性质的确定,指导HGG放疗靶区的勾画。
[1]Gauvain KM,Mckinatry RC,Mukherjee P.Evaluating Pediatric brain tumor cellularity with diffusion-tensor imaging.AJR,2001,177:449-454.
[2]马明平,方 可,吴光耀,等.大鼠C6胶质瘤的MR扩散加权成像及病理对照研究.中华放射学杂志,2005,39:608-612.
[3]朱向帧,康帧,何侠.磁共振弥散加权成像对鼻咽癌靶区勾画和复发转移预测的临床价值.肿瘤学杂志,2012,21:105-107.
[4]Burger P C,Dubois P J,Schold S C,et al.Computerized tomographic and pathologic studies of the untreated,quiescent,and recurrent glioblastoma multiforme.J Neurosurg,1983,58:159-169.
[5]李治国,秦尚振,龚 杰.磁共振表观弥散系数及多体素磁共振波谱与脑胶质瘤增殖活性的相关性研究.中国临床神经外科杂志,2012,17:146-150.
[6]Nakai T,Muraki S,Bagarinao E,et al. Application of independent component analysis to magnetic resonance imaging for enhancing the contrast of gray and white matter.Neuroimage,2004,21:251-260.
[7]Laprie A,Pirzkall A,Hass-Kogan DA,et al.Lonfitudinal multivoxel MR spectroscopy study of pediatric diffuse brainstem glioms treated with radiotherapy.Int J Radiat Oncol Biol Phys,2005,62:20-31.
[8]张 冰,朱 斌.DWI在胶质瘤与单发转移瘤及其瘤周水肿中的诊断价值.中国医学计算机成像杂志,2006,12:80-83.
[9]Higano S,Yun X,Kumabe T,et al.Malignant astrocytic tumors:clinical importance of apparent diffusion coefficient in prediction of grade and prognosis.Radiology,2006,241:839-846.
[10]张竞文,伍建林,苗延巍,等.磁共振弥散加权成像对脑肿瘤瘤周水肿的临床应用.中国医学影像技术,2005,21:1810-1814.

