PSA密度与PI-RADS(第二版)对各PSA区间前列腺癌的诊断价值
陈志远 张 艳 周懂晶 黄丽霞 刘玉品 胡 萍 郑广娟
前列腺癌(prostate cancer,PCa)是临床常见的恶性肿瘤,发病率及死亡率均较高。在美国的男性患者中,PCa是肿瘤致死的第二大病因[1];而在中国,随着人口老龄化加快及生活方式西化,PCa的发病率也在逐年升高,最近发布的2013年中国恶性肿瘤数据显示,PCa发病率及死亡率分别位于男性恶性肿瘤的第6位及第10位[2]。近些年来,随着多参数磁共振(multi-parameter MRI,MP-MRI)广泛应用于前列腺的扫描,PCa的诊断准确率得到明显的提高,但仍存在着扫描不规范、图像解读一致性差、临床与影像科医疗交流欠佳等问题。为了解决该问题,2015年欧洲泌尿生殖协会联合美国放射协会、AdMeTech基金会推出了前列腺影像报告和数据系统第二版(prostate imaging reporting and data system version 2,PI-RADS v2)[3],自其发布以来,多项研究证实其应用简单、准确率高。而前列腺特异性抗原密度(prostate specific antigen density,PSAD)也为多项研究所证实无论是单独使用还是联合PI-RADS v2评分应用均有较高的敏感性及特异性[4-7]。在此,我们对我院2015年01月至2017年09月行前列腺穿刺活检的患者进行回顾性分析,研究PSAD、PI-RADS v2及两者联合应用对各个PSA区间人群PCa的诊断作用,并比较它们之间的差异。
方 法
1.病人资料
本回顾性分析获得医院伦理委员会批准,所有参与穿刺及MRI检查的患者均签署了知情同意书。连续收集于2015年01月至2017年09月在我院接受了前列腺穿刺活检的患者资料共221例,并选择合适的病例纳入研究群体中。纳入标准:①穿刺前接受MP-MRI检查,②穿刺病理结果明确为肿瘤或非肿瘤病变,③穿刺时间在MRI检查后3个月以内,④血清PSA的检查在穿刺前一周内进行且PSA值≤30 ng/ml。排除标准:①未在我院行MRI检查者,②图像质量不佳或序列不全无法进行PI-RADS v2评分者,③MRI检查前接受过内分泌治疗或放疗者。最后纳入研究的患者人群再按血清PSA水平0~ 10ng/ml、10~ 20ng/ml及 20~ 30ng/ml分为三个区间,再将每个区间群体根据穿刺病理结果分为前列腺癌组(PCa组)和非前列腺癌组(良性组)。
2.MRI扫描参数
MRI检查在前列腺穿刺前进行,MRI检查与穿刺间隔时间平均约为5天(范围:1~33天)。所有检查均在3.0T磁共振上进行(GE Sigma Excite HD 3.0T MR Scanner或 Toshiba Titan 3.0T MR Scanner)。检查前让患者尽量排便以避免肠气影响图像,适度充盈膀胱,仰卧位扫描,使用盆腔相控阵线圈。所有患者均进行了轴位、冠状位及矢状位高分辨T2WI序列、高b值DWI序列及动态增强扫描(dynamic contrast enhancement,DCE)检查。扫描参数如下:T2WI:TR:4100ms,TE:96ms;层厚:4mm;层间距:1mm;FOV:20cm,包全前列腺及精囊腺;距阵:224×384,并使用脂肪抑制技术。DWI系列b值取0,800,1200s/mm2;TR:3600ms,TE:80ms;层厚:4mm;层间距:1mm;FOV:26cm,距阵:128×128,定位线与轴位T2WI一致。DCE动态扫描者使用马根维显0.2mmol/kg进行注射,随后使用0.9%氯化钠溶液10ml冲洗。注射对比剂后马上进行轴位3D序列扫描,连续扫描6期。
3.图像分析
图像分析由2位腹部影像专业的高年资主治医师在我院PACS系统上进行,分别拥有8年和10年阅读前列腺MR的经验,2位医生在评分时对穿刺病理及前列腺抗原等临床资料并不知情。病灶评分标准按欧洲泌尿生殖协会所发布的PI-RADS v2标准执行。图像测量及评分均由2位主治医生商讨后确定,如果2位医生图像分析有分歧,则与另1位有15年前列腺阅片经验的副主任医师共同讨论后由副主任医师最终确定。
前列腺大小的测量在高分辨T2WI上进行,最长上下径线在矢状位T2WI上进行,范围为前列腺底部至尖部,最长前后及左右径线在轴位T2WI上进行,前列腺体积=最长上下径线×最长前后径线×最长左右径线×0.52。收集前列腺穿刺前一周内的PSA数据,并计算PSAD值,PSAD=TPSA/前列腺体积。
4.前列腺穿刺及组织病理学诊断
前列腺穿刺由一位有500例以上前列腺穿刺经验的高年资泌尿外科医生进行,采取经会阴系统饱和穿刺加MRI可疑病灶认知定点穿刺法,系统饱和穿刺采用国际通用的12针法,病灶定点穿刺针数约1~3针。穿刺后立即送病理科进行石蜡包埋及染色,并由一位有5年前列腺病理诊断经验的高年资病理科医生进行阅片。
5.统计学分析
使用SPSS 24.0对患者临床资料进行描述,两组间PSAD的比较使用Mann-Whitney U检验进行统计分析,PI-RADS v2评分的比较使用Fisher确切概率法进行统计学分析,P<0.05为差异有统计学意义。使用MedCalc 15.2.2对PSAD及PI-RADS v2评分进行ROC曲线分析,PSAD与PI-RADS v2联合应用的ROC曲线的统计方法为先使用SPSS 24.0对PSAD与PI-RADS v2进行二元回归并计算出概率,然后再使用概率进行ROC曲线分析,分别计算AUC,并使用Delong法进行两两比较。
结 果
1.病人资料
共141例患者符合入选标准被纳入研究,平均年龄为67.87±8.75岁,病理学诊断PCa者共30例,阳性率21.13%。其中PSA为0~10ng/ml区间的患者共85例,病理学诊断PCa者共15例,阳性率17.65%;10~20ng/ml区间的患者共35例,病理学诊断PCa者共10例,阳性率25.64%;20~30ng/ml区间的患者共18例,病理学诊断PCa者共5例,阳性率 27.78%。
2.PSA 密度
无论是在PSA值为0~30ng/ml的总体人群中,还是在0~10ng/ml、10~20 ng/ml、20~30ng/ml的区间人群中,PCa组与良性组间PSAD相比较均有统计学意义(P<0.05)。
3.PI-RADS v2 评分
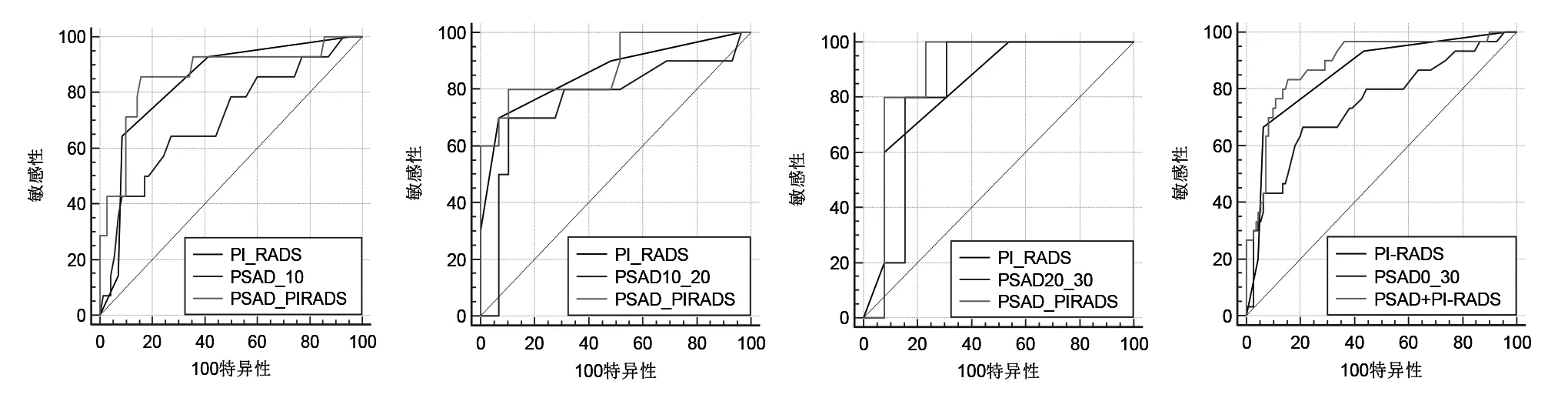
图1 从左到右分别为PSAD、PI-RADS v2评分及两者联合应用诊断PSA为0~10 ng/ml、10~20 ng/ml及20~30 ng/ml、0~30ng/ml区间人群PCa的ROC曲线。
无论是在PSA值为0~30ng/ml的总体人群中,还是在0~10ng/ml、10~20ng/ml、20~30ng/ml的区间人群中,PCa组与良性组间PI-RADS v2评分相比较均有统计学意义(P<0.05)。
4.ROC曲线分析
使用PSAD、PI-RADS v2评分及两者联合应用诊断各个PSA区间人群PCa的ROC曲线如图1。各区间人群的曲线下面积AUC、两两比较P值如表1所示。从中可以看出,在PSA值在0~30 ng/ml总体区间人群与0~10 ng/ml区间人群中,PSAD与PI-RADS v2评分联合应用诊断PCa较PSAD效能更佳(P<0.05),而虽然其他区间人群的两两比较未发现统计学差异,但我们仍可以发现无论是单独使用PSAD、PI-RADS v2评分或两者联合应用,其AUC值随PSA值得升高而呈现上升的趋势。
讨 论
PSA是由前列腺上皮细胞分泌的一种单糖蛋白,是PCa的特异性血清标志物,对诊断PCa有一定的临床价值。PSA值越高,则患有PCa的风险越大。根据我国《中国泌尿外科疾病诊断治疗指南》,依血清 PSA 水平 4~ 10ng/ml、10~ 20ng/ml、及20ng/ml以上可将前列腺癌分为低危,中危,高危3类。本研究参考指南把PSA值分为三个区间,分别为0~10ng/ml、10~20ng/ml及20~30ng/ml。在本研究群体中,PCa的总发病率约为21.13%,而且随着PSA区间的升高,PCa发病率也随着升高[8]。但PSA的升高不仅可以出现在PCa患者中,也可以出现在良性前列腺增生或前列腺炎患者中。部分良性前列腺增生明显的患者可以出现PSA较前列腺癌患者更高的现象,因此单纯使用PSA来诊断PCa敏感性较高,特异性却较差。在我们的研究群体中,如果以PSA>4 ng/ml作为标准进行穿刺,会致使68.54%(85/124)的患者遭受了不必要的穿刺。
为了改善PSA的特异性,近些年来越来越多的文献推荐使用PSAD代替PSA来诊断PCa。PSAD是血清PSA与前列腺体积的比值,一般认为,前列腺体积越大,分泌的PSA值就越高,所以良性病变的PSAD值常较为稳定。但是PCa患者由于肿瘤组织侵犯上皮细胞及导管,促使PSA经导管入血增多,血清中PSA与前列腺体积不成比例的升高,而且PCa患者的前列腺体积常小于良性前列腺增生患者体积,因此PCa患者的PSAD常较良性前列腺增生者明显升高,使用PSAD来诊断PCa较PSA更为准确。我们的研究发现,无论对于0~30ng/ml研究总体人群,还是其细分的三个区间人群,PCa组与良性组间的PSAD均有统计学差异。而且随着PSA值区间的升高,PSAD诊断PCa的AUC也不断升高(分别为 0.720、0.760、0.831),提示 PSA 值区间越高,PSAD诊断PCa的效果越好。
自从2015年PI-RADS v2发布后,多项临床研究证明其对PCa的诊断准确率较高[9-11]。Woo等[12]最近发布的Meta分析显示,PI-RADS v2在诊断PCa方面具有良好的敏感性及较高的特异性,以≥4分为界,PI-RADS v2诊断PCa的敏感性约为89%,特异性约为80%。以≥3分为界,PI-RADS v2诊断PCa的敏感性约为96%,特异性约为49%。我们的研究显示,在0~30ng/ml总的研究人群中,以≥4分为界,PI-RADS v2诊断PCa的敏感性约为66.67%,特异性约为93.67%。以≥3分为界,PIRADS v2诊断PCa的敏感性约为93.33%,特异性约为56.36%。我们的研究与Woo等的相比较,以≥3分为界时,敏感性及特异性大致相仿,但以≥4分为界时,我们的敏感性明显降低,可能的原因是我们的研究纳入标准与他们的不同,我们的研究将PSA 30ng/ml以上的人群排除在外,而该部分人群PCa发病率及PI-RADS v2评分均较高,主要以4分以上为主,排除该部分人群会导致PCa阳性率及PIRADS v2高评分病例减少,从而使敏感性降低。另外,我们的研究发现在0~10ng/ml、10~20ng/ml及20~30ng/ml的区间中,PI-RADS v2诊断PCa的敏感性及特异性较为接近,以≥3分为界时,敏感性分别为66.67%、70.00%、60.00%,而特异性分别为91.43%、93.10%、92.31%;以≥4分为界时,敏感性分别为 93.33%、90.00%、100.00%,而特异性分别为58.57%、51.72%、46.15%。它们的ROC曲线下面积也证实了这一点,三者AUC分别为0.841、0.859、0.838,相互之间数值较为接近,说明与PSAD不同,PI-RADS v2评分对PCa的诊断效能较好,而且在不同PSA区间具有良好的一致性,不会因为PSA值的高低而出现波动,在PSA较低的区间人群使用PI-RADS v2评分来诊断PCa较PSAD更佳。
我们使用了Delong法对各个区间人群的PSAD、PI-RADS v2评分及两者联合应用诊断PCa的ROC曲线进行了两两对比,结果显示,在0~30ng/ml的总体研究人群和0~10ng/ml的区间人群中,PSAD与两者联合应用之间有统计学差异,说明在该区间人群中PSAD与PI-RADS v2联合应用诊断PCa较单独使用PSAD效果更佳。我们都知道,PSA值4~10ng/ml被认为是PCa诊断的灰度区间,在该区间里PCa的发病率较低,若对该区间的患者进行前列腺穿刺结果会出现穿刺阳性率低,无必要穿刺的患者明显增加;若对该部分患者进行随访,则会遗漏相当数量的PCa。而我们的研究表明,在0~10ng/ml区间人群中,PSAD、PI-RADS v2评分及两者联合应用均能有效的诊断PCa。若使用PSAD>0.17ng/ml作为最佳截断点(cut off value),PSAD诊断该区间PCa的敏感性为66.67%(10/15),特异性为72.86%(51/70);若将PSAD与PI-RADS v2评分联合使用,以PSAD>0.17 ng/ml或PI-RADS v2评分≥4作为标准,则诊断PCa的敏感性为86.67%(13/15),特异性为64.29%(45/70)。与单独使用PSAD对比,两者联合使用可在特异性轻度下降的情况下明显增加了诊断的敏感性,且漏诊PCa均为Gleason评分6分及以下病灶,大部分为前列腺临床非显著癌(clinical insignificant prostate cancer,ciPCa),具有较高的临床应用价值。我们的研究结果与Washino等[13]的研究较为接近,他们的研究发现,对于评分4分以上的人群PSAD取值0.15,或者对于评分3分的人群PSAD取值0.30时,对诊断临床意义的PCa有最佳的准确率(76%~97%)。虽然我们的研究显示除了在0~30ng/ml和0~10ng/ml区间人群PSAD与两者联合应用之间有统计学差异,其他的两两比较暂未发现有统计学差异,但我们的研究显示每个区间人群PSAD、PI-RADS v2评分及两者联合应用的AUC值均呈升高的趋势,提示随着PSA的升高其诊断PCa的效能也在提升。
综上所述,血清PSA值30ng/ml以内者的人群中PCa的发生率约21.13%。在PSA值0~30ng/ml、0~ 10ng/ml、10~ 20ng/ml、20~ 30ng/ml各个区间人群,PSAD、PI-RADS v2及两者联合应用诊断PCa均可以获得较好的效果,而在0~30ng/ml和0~10ng/ml的区间人群,两者联合使用较PSAD单独使用效果更佳。在0~10ng/ml的区间人群,以PSAD>0.17或PI-RADS v2评分≥4作为标准,PSAD与PI-RADS v2评分联合应用诊断PCa的敏感性为86.67%,特异性为64.29%。
[1]American Cancer Society. Key statistics for prostate cancer. www.cancer.org/cancer/ prostatecancer /detailedguide/
[2]陈万青,郑荣寿,张思维,等. 2013年中国恶性肿瘤发病和死亡分析, 中国肿瘤,2017,26:1-7.
[3]Weinreb JC, Barentsz JO, Choyke PL, et al. PI-RADS Prostate Imaging Reporting and Data System: 2015, Version 2. Eur Urol,2016,69:16–40.
[4]MacAskill F, Lee SM2, Eldred-Evans D, et al. Diagnostic value of MRI-based PSA density in predicting transperineal sector-guided prostate biopsy outcomes. Int Urol Nephrol,2017, 49:1335-1342.
[5]Niu XK, Li J, Das SK, et al. Developing a nomogram based on multiparametric magnetic resonance imaging for forecasting highgrade prostate cancer to reduce unnecessary biopsies within the prostate-specific antigen gray zone. BMC Med Imaging,2017,17:11.
[6]Hansen NL, Barrett T, Koo B, et al. The influence of prostatespecific antigen density on positive and negative predictive values of multiparametric magnetic resonance imaging to detect Gleason score 7-10 prostate cancer in a repeat biopsy setting. BJU Int,2017,119:724-730.
[7]Distler FA, Radtke JP, Bonekamp D, et al. The Value of PSA Density in Combination with PI-RADS for the Accuracy of Prostate Cancer Prediction. J Urol,2017,198 : 575-582.
[8]吴 斌,金 彪,王永杰,等. MR动态增强定量参数对鉴别前列腺良恶性病变的价值及与血清PSA的相关性. 中国医学计算机成像杂志,2017,23:252-255.
[9]Purysko AS, Bittencourt LK, Bullen JA, et al. Accuracy and Interobserver Agreement for Prostate Imaging Reporting and Data System, Version 2, for the Characterization of Lesions Identified on Multiparametric MRI of the Prostate. AJR Am J Roentgenol,2017,209:339-349.
[10]Kasel-Seibert M, Lehmann T, Aschenbach R, et al. Assessment of PIRADS v2 for the Detection of Prostate Cancer. Eur J Radiol,2016,85:726-731.
[11]Mehralivand S, Bednarova S, Shih JH, et al. Prospective Evaluation of PI-RADS Version 2 Using the International Society of Urological Pathology Prostate Cancer Grade Group System. J Urol,2017,198:583-590.
[12]Woo S, Suh CH, Kim SY, et al. Diagnostic Performance of Prostate Imaging Reporting and Data System Version 2 for Detection of Prostate Cancer: A Systematic Review and Diagnostic Meta-analysis.Eur Urol,2017,72:177-188.
[13]Washino S, Okochi T, Saito K, et al. Combination of prostate imaging reporting and data system (PI-RADS) score and prostate-specific antigen (PSA) density predicts biopsy outcome in prostate biopsy naïve patients. BJU Int,2017,119:225-233.

