表现为反晕征的肺磨玻璃结节CT诊断
任 华 李惠民 虞崚崴 刘富富 孙姗姗 蔡 静
反晕征(reversed halo sign,RHS)原意是指胸部CT肺窗上表现为中心磨玻璃低密度影、外周呈环形或新月形实性高密度影的CT征象[1]。RHS最初报道于隐源性机化性肺炎(cryptogenic organizing pneumonia,COP)[1],并有学者认为RHS是COP相对特异的影像征象[2]。随后报道多种感染及非感染性疾病均可表现为RHS[3-5]。而表现为RHS的肿瘤性肺部疾病(包括肺腺癌)多为个案报道[3,5]。近年来,随着多层螺旋CT的临床应用,肺磨玻璃结节(Ground-glass nodules,GGN)检出随之增多。在GGN中,表现为RHS的GGN可认为是一种特殊类型的RHS。作者收集一组表现为RHS的GGN的病例,回顾性分析其CT表现及其诊断。
方 法
1.临床资料
201 3年1月-2017年1月间CT超高分辨率靶扫描上表现为RHS的GGNs共71例,目前13例仍在随访中,失访24例。最终获得手术病理证实的共34例34个GGN(其中我院手术20例,上海其他三甲医院手术14例)纳入研究。其中男性5例,女性29例,男女比例1:5.8,年龄范围24~78岁,平均44.2±13.6岁 ,中位 42.5 岁。
2.检查方法
全部病例均采用Philips iCT 256层螺旋CT扫描仪完成超高分辨率CT靶扫描(G-方案[6]):根据常规CT扫描图像上病灶位置确定扫描体位,使病灶位于体轴重力线上方,嘱病人尽力深吸气后屏气完成靶扫描。CT扫描参数包括:准直0.625mm×64,扫描野(FOV)250mm,扫描矩阵1024×1024,120kV,250mAs;先采用滤过反投射算法无间隔重建获得2.5mm层厚原始图像,然后重新确定病灶位置和范围进行回顾性重建:FOV约120~180mm,矩阵1024×1024,迭代算法iDose44,层厚0.67mm,无间隔连续重建。
3.图像分析
所有薄层图像数据组传至Philips Extended Workspace后处理工作站,首先完成多层面重组(multiplanar reformation,MPR):以支气管血管束为轴或平行于胸膜(邻近胸膜病变)完成三维正交显示,然后在上述图像基础上将层厚增加至3mm完成thickness MPR 以 及 Slab-VR(volume rendering,VR)显示(此时厚度为略大于结节直径)。
图像分析均在MPR三维正交后肺结节最大截面层面上分析。评价内容包括:①肺结节最大截面的最大径;②环的最大厚度及其均匀性、完整性;③密度。
密度测量方法:代表性密度(即环上不均匀磨玻璃密度的高密度区域,ROI直径>2mm)和环内密度(即病灶中心区域的密度)
4.病变分组
参照依据2015年WHO肺腺癌病理分类将本组肿瘤性病灶分为侵袭前病变和侵袭性病变,前者包括不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位腺癌(adenocarcinoma in situ,AIS),后者包括微侵袭性腺癌(minimally invasive adenocarcinoma,MIA)和 侵 袭 性 腺 癌(invasive adenocarcinoma,IAC)。
5.统计分析
采用SPSS 19.0软件进行数据分析。计量资料以均数±标准差表示,组间比较采用t检验或非参数检验;计数资料以百分率表示,组间比较采用χ2检验。以P<0.05为有统计学意义。病灶最大径及环的最大厚度对侵袭前病变和侵袭性病变的鉴别诊断作ROC曲线分析。
结 果
1.总体情况
34例共34个RHS-GGN。肿瘤性病变32个,包括侵袭前病变21个(AAH 7个和AIS 14个)和侵袭性病变11个(MIA 9个和IAC 2个)。良性病变2例,病理均证实为肺泡间隔纤维组织增生,慢性炎症细胞浸润(图1)。
合并病变情况:23例为单纯RHS-GGN,12例伴发其它结节或肿块性病变。1例淋巴结转移,但该患者在右肺上叶可见大小约4.2cm×2.7cm的腺癌。
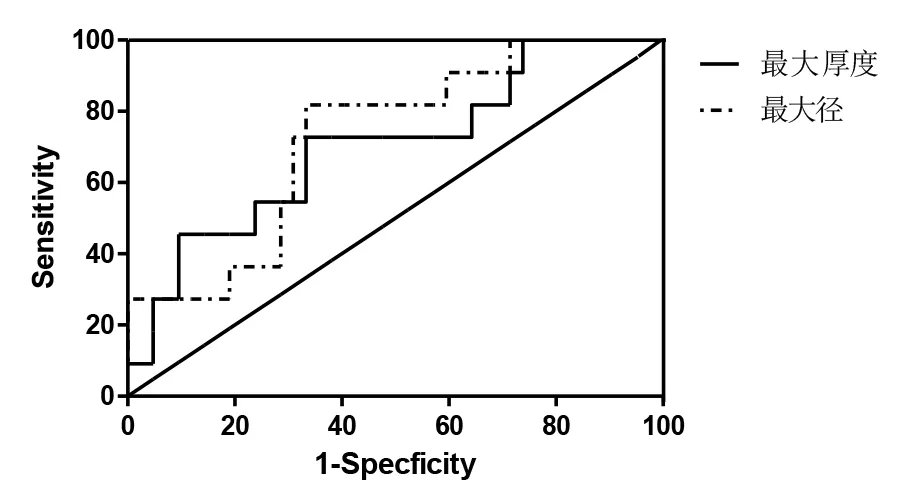
图2 两组病变最大径、环最大厚度的ROC曲线分析。
2.RHS-GGN的CT表现及侵袭性
从表1可见各CT评价指标中,仅病灶最大径、磨玻璃环最大厚度具有统计学上显著性差异(P<0.05)。ROC曲线分析(图2)显示了上述两个指标对肿瘤侵袭性的最佳分割阈值,即病灶最大径大于9mm诊断侵袭性病变的曲线下面积为0.725,敏感度和特异性分别为81.8%和66.7%。病灶环最大厚度大于4mm诊断侵袭性病变的曲线下面积为0.701,敏感度和特异性分别为45.5%和90.5%(图3、4)。
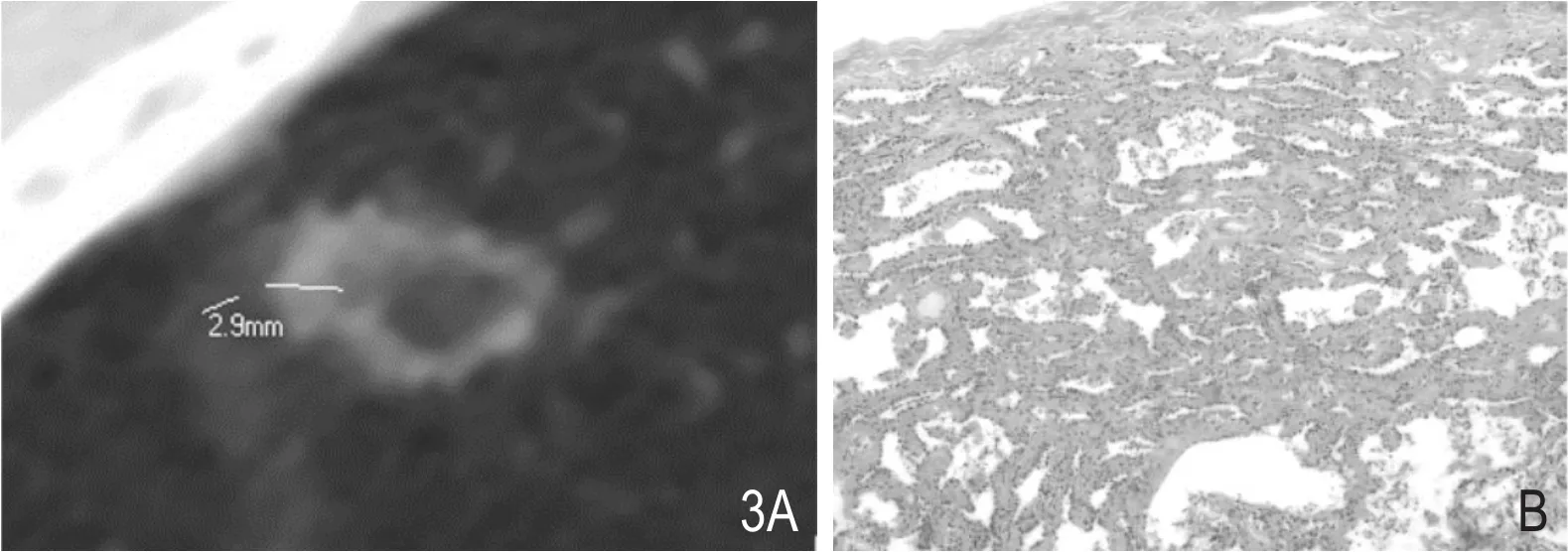
图3 女,29岁。 A.UHRCT:右肺中叶RHS-GGN,环完整,厚度不均匀,环最大厚度2.9mm,最大径11.4mm,环内CT值约-735HU,代表性CT值约-383HU。B.病理:显示为肺AIS(HE×100)。

图 4 男,31岁。 A.UHRCT:右肺下叶RHS-GGN,环完整,厚度均匀,环最大厚度4.3mm,最大径11.6mm,环内CT值约-805HU,代表性CT值约-568HU。B.病理:显示为肺IAC(HE×100)。
讨 论
在本组病例中,超过90%的RHS-GGN为肺肿瘤性病变。关于肺腺癌的CT征象有不少文献进行详细阐述,但未涉及本文所指的CT征象—RHS。明确判断RHS可提示肿瘤诊断。
1.了解现实问题。为了让学生全面了解问题,主动参与课堂教学,笔者为学生播放相关视频纪录片,学生在感到震撼的同时,也对环境污染问题有了更深入的了解,产生了掌握相关词汇的迫切欲望。
RHS通常是指局灶性类圆形磨玻璃影被或多或少的实变环所包绕[7],是一种较少见的影像征象。而在本组病例中的RHS在CT上则表现为外周呈环形磨玻璃密度,而中心低于外周密度。这与传统定义略有不同。以往文献报道的表现为RHS的疾病外周环为实性。其原因可能是病理机制不同,如在非感染疾病中,COP的中心低密度区为肺泡间隔的炎性渗出和肺泡腔内的细胞碎屑,而周围新月形或环形的实变高密度影是远端气腔内的机化性炎症[1]。在感染性疾病中,Wahba等[8]则认为RHS在侵袭性真菌感染的早期出现,其形成可能与肺组织梗死有关,伴外周环形实变区大量肺出血且多于中心磨玻璃区域。结核的外周则是由肉芽肿结节组成[3]。文献也有报道表现为RHS的肺腺癌,但大多为个案报道且病理分析较少。Godoy等[5]认为当病灶中心出现磨玻璃密度时,即形成所谓的RHS。结节内的磨玻璃成分与肿瘤组织生长缓慢有关,在组织病理学表现为贴壁式生长。而本组病例中,外周环呈磨玻璃密度,中心呈更低的磨玻璃密度。其病理形成机制有待进一步研究。
RHS的形态不同,其临床意义也有所不同,特别是RHS的环及内部表现。Marchiori等[4]比较了具有RHS的15例侵袭性真菌感染和25例COP的形态学特点,发现RHS内部呈网格样改变见于93%的侵袭性真菌感染,COP患者未见此征象;且侵袭性真菌感染患者的外周实性环的最大厚度(2.04±0.85cm)大于机化型肺炎(0.50±0.22cm)。因此,RHS内部呈网格样改变及外周环形实变影厚度大于1cm合并胸腔积液,则高度提示侵袭性真菌感染而不是COP。而在本组病例中,最大厚度大于4mm提示侵袭性病变可能。说明RHS-GGN的环代表肿瘤成分,可用于提示肿瘤的侵袭性。Marchiori等[9]对表现为RHS的12例肺结核和10例COP进行对比后,发现RHS外周壁或内部由密集微小结节围绕组成,则高度提示结核而不是COP。这些结节通常提示活动性肉芽肿疾病[5]。在本组病例中,环及环内均未见小结节。
RHS的进展程度及演变过程也需引起注意。Rampinelli等[10]报道了一例不常见的呈向心性生长的肺腺癌病例:患者女,73岁,有肺类癌病史,右肺下叶表现为RHS的病灶,大小约23mm;随访4年后,病灶向心性生长,中心被磨玻璃密度填充,而大小未见明显增大;随访10年后,大小依旧约23mm,而中心出现实性高密度,呈晕征(Halo Sign)表现,病灶表现为从RHS到晕征的进展过程。在本组病例中,病灶未见相似的进展过程,其原因可能是患者随访时间较短。关于表现为RHS的肺腺癌进展也未见相关研究。但上述病例最初的影像学表现与本组病例相似,均呈环形磨玻璃密度。RHS-GGN的进一步演变仍有待研究。
大小是评估结节进展程度的重要因素之一。Sang等[11]对272个亚实性结节研究发现,对于纯磨玻璃结节,鉴别侵袭前病变和侵袭性病变的最佳临界值是10mm。本组数据显示,鉴别RHS-GGN的侵袭性病变和侵袭前病变的最佳临界值是9mm,与上述研究结果相仿。说明无论病灶是否表现为RHS,最大径都可用于病灶侵袭性的评估。
Lee等[12]许多作者报道纯磨玻璃结节的密度值高低可用于评估其侵袭性。而本组数据两组病变的密度参数均未见显著性差异。这可能归因于测量误差及本组病例数较小。作者认为对于RHS-GGN,密度测量应分析环形磨玻璃密度区域,即代表性密度,其与肿瘤成分相对应,而不是测量病灶的整体平均密度。这仍需扩大样本量进一步研究。
总之,表现为RHS-GGN绝大多数为肺腺癌。病灶多呈类圆形,边界清楚。病灶最大径大于9mm及环的最大厚度大于4mm提示肿瘤的侵袭性。
[1]Voloudaki A E, Bouros D E, Froudarakis M E, et al. Crescentic and ring-shaped opacities. CT features in two cases of bronchiolitis obliterans organizing pneumonia (BOOP). Acta Radiol,1996, 37:889-892.
[2]Sang J K, Lee K S, Ryu Y H, et al. Reversed halo sign on highresolution CT of cryptogenic organizing pneumonia: diagnostic implications. AJR, 2003, 180:1251-1254.
[3]Marchiori E, Zanetti G, Meirelles G S, et al. The reversed halo sign on high-resolution CT in infectious and noninfectious pulmonary diseases. AJR, 2011, 197:69-75.
[4]Marchiori E, Marom E M, Zanetti G, et al. Reversed halo sign in invasive fungal infections: criteria for differentiation from organizing pneumonia. Chest, 2012, 142:1469-1473.
[5]Godoy M C, Viswanathan C, Marchiori E, et al. The reversed halo sign: update and differential diagnosis. Br J Radiol, 2012, 85:1226-1235.
[6]李 鲁, 李惠民, 舒锦尔,等. 生理通气辅助超高分辨率CT扫描技术探讨. 中国医学计算机成像杂志, 2015, 21:228-231.
[7]Hansell D M, Bankier A A, Macmahon H, et al. Fleischner Society:glossary of terms for thoracic imaging. Radiology, 2008, 246:697-722.
[8]Wahba H, Truong M T, Lei X, et al. Reversed Halo Sign in Invasive Pulmonary Fungal Infections. Clin Infect Dis,2008, 46:1733-1737.
[9]Marchiori E, Zanetti G, Irion K L, et al. Reversed halo sign in active pulmonary tuberculosis: criteria for differentiation from cryptogenic organizing pneumonia. AJR, 2011, 197:1324-1327.
[10]Rampinelli C, Vecchi V, Bellomi M. From reversed halo sign to halo sign: unusual centripetal growing of a lung adenocarcinoma. J Thorac Oncol, 2014, 9:1230-1230.
[11]Sang M L, Chang M P, Jin M G, et al. Invasive Pulmonary Adenocarcinomas versus Preinvasive Lesions Appearing as Ground-Glass Nodules: Differentiation by Using CT Features. Radiology,2013, 268:265-273.
[12]Lee HY, Choi YL, Lee KS, et al. Pure ground-glass opacity neoplastic lung nodules: histopathology, imaging, and management. AJR, 2014,202: W224-33.

