古田红曲米抗氧化活性物质的分离纯化
张红林,李桂玲,2,苏国成,刘静雯,2,李健,3
(1.集美大学食品与生物工程学院,福建厦门 361021)(2.厦门市海洋功能食品重点实验室,福建厦门 361021)(3.福建省海洋功能食品工程技术研究中心,福建厦门 361021)
红曲又称丹曲,是由红曲霉接种到大米发酵而来的一种紫红色米曲,是一种药食两用的传统食品。明代《天工开物》中记载:红曲具有杀菌和抑菌作用,在鱼肉上涂红曲可以延缓它的变质[1]。虽然古代有此记录,但近现代对红曲的研究较少。1979年,日本学者远藤章[2]首次从红曲中分离到一种可抑制人体胆固醇合成的活性物质,命名为 Monacolin K,才由此掀起国内外学者对红曲的广泛关注。Lee等[3]研究了红曲发酵产生的色素Monascin和Ankaflavin,发现它们对提高学习和记忆能力以及延缓衰老有很好的功效。温学伟等[4]通过对红曲的抗氧化研究得出:红曲中含有许多如色素、酚类、Dimerumic acid、他汀类等不同的抗氧化物质,它们的存在可以消除氧自由基的伤害,保护人体健康。Liu等[5]以分离纯化到的红曲色素Ankascin 568 plus喂食小鼠4个月,结果表明:4个月后总胆固醇下降与低密度脂蛋白均有所下降。李明起等[6]以柱层析分离纯化功能性红曲米中的有效成分,得到了红曲黄色素,洛伐他汀粗品,醇溶性红曲红色素,水溶性红曲红色素4种组分。
现代研究表明,红曲中除含有洛伐他汀和红曲色素外,还有脂肪酸、甾醇、生物碱和黄酮等多种活性物质,具有降血压、降血脂、降血糖以及抗肿瘤等药理作用[7]。红曲的功效众多,成分复杂,但近年来,对红曲的研究主要集中在红曲色素及其功效,红曲菌株筛选以及发酵等方面的研究,对其进行脂溶性活性物质的分离纯化研究报道较少,因此对红曲进行活性物质的分离纯化研究就有一定的现实意义。本文以不同产地红曲及不同有机溶剂红曲提取物为材料,对其进行抑菌,抗氧化活性的测定,并以此结果为依据,选择抑菌活性较好的古田红曲为材料,进一步对甲醇提取物进行活性物质的分离纯化,采用 Sephadex LH-20凝胶柱层析、制备型反相中压色谱柱层析、正相硅胶柱层析等分离纯化方法,结合薄层层析(TLC),紫外吸收光谱(UV)、核磁共振波谱(NMR)以及质谱(MS)等技术,对其进行分析追踪和结构鉴定,最终分离出亚油酸和α-亚麻酸两个活性化合物。亚油酸能抑制肠道病原菌,具有防癌,抗氧化作用,其参与人体心血管疾病的控制,增强机体免疫能力[8]。α-亚麻酸也在抗氧化,调节血脂,降低血糖血压,预防心血管疾病,抑制癌症的发生和转移方面具有很好的生理活性[9],此2种物质为红曲相关食疗和药用的研究提供了理论基础和一定的借鉴作用。
1 材料与方法
1.1 主要材料与试剂
古田红曲米,福建古田平湖镇玉源村;梅州红曲米,广东梅州市客家红曲生物制品有限公司;丽水红曲米,浙江丽水力克生物科技有限公司;上饶红曲米,江西省诺博生物科技有限公司;酿酒酵母、枯草芽孢杆菌、大肠杆菌、黑曲霉和塔宾曲霉,菌株由集美大学食品与生物工程学院提供;牛津杯(Φ8 mm),东台市吉泰制品厂;甲醇、丙酮、乙酸乙酯、分析纯,西陇化工股份有限公司;乙醇、石油醚、分析纯,国药集团有限公司;DPPH、标准品,Sigma公司;技术琼脂粉、酵母浸膏,广东环凯微生物科技有限公司;胰蛋白胨,北京奥博星生物技术有限公司;氘代氯仿、色谱纯,上海麦克林生化科技有限公司。
1.2 主要仪器设备
RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;SHB-3型循环水多用型真空泵,郑州杜甫仪器厂;DBS-100型全自动部分收集器,上海青浦沪西仪器厂;ZF型紫外分析仪,上海康华生仪器制造厂;Lambda 265型紫外可见分光光度计,美国珀金埃尔默公司;AVANCE 400 MHz型核磁共振仪,Bruker公司;P0100型制备型中压反相色谱仪,北京慧德易科技有限公司;Varian 300型液质联用仪,瓦里安公司;Sephadex LH-20型葡聚糖凝胶,GE Healthcare公司。
1.3 方法
1.3.1 测定样品的制备
将购买的古田、梅州、丽水,上饶4个地区的红曲米以粉碎机高速粉碎,过100目筛,然后各称取50 g置于300 mL锥形瓶,以甲醇、乙醇、丙酮、乙酸乙酯、石油醚5种有机溶剂进行萃取,萃取条件:料液比1:3,温度30 ℃,超声时间2 h,超声功率100 Hz,萃取3次,将提取液合并,抽滤,旋转蒸发仪浓缩蒸干,分别配制2、5、10、20、40、80、160、320 mg/mL母液备用。
另外称取50 g和1000 g古田地区红曲米以同样提取条件进行提取。50 g的一份将提取物以100%水-甲醇、75%水-甲醇、50%水-甲醇、25%水-甲醇、100%甲醇共5个梯度进行洗脱,每个梯度洗1 L,将洗脱液浓缩蒸干,配制2 mg/mL的样品液备用。1000 g的一份则经过抽滤,旋转蒸发浓缩成甲醇粗提物的浸膏。
1.3.2 牛津杯法测定抑菌活性
按照Huang等[10]的方法稍作改动,在无菌条件下,将经过高压蒸汽灭菌的固体培养基(酿酒酵母,黑曲霉和塔宾曲霉用 YPD培养基,枯草芽孢杆菌和大肠杆菌用LB培养基)冷却至温度在40 ℃~45 ℃之间,加入一定量的未经稀释菌悬液,使菌浓度为(1.0~5.0)×104CFU/mL,摇匀后均匀倒入培养皿中,待培养基冷却凝固后,用经灭菌的镊子夹取经灭菌的牛津杯摆放于其中,用移液枪吸取200 μL各供试化合物加入牛津杯内,同时做试剂空白和阳性对照。酿酒酵母阳性对照用两性霉素B,枯草芽孢杆菌和大肠杆菌用氯霉素,待溶剂扩散后,取下牛津杯,放入恒温培养箱中培养。测量抑菌圈直径,并计算3次测量的平均值。
1.3.3 DPPH法测定抗氧化能力
参照曾岚等[11]的方法并做稍微的改动进行测定。将2 mg/mL不同有机溶剂萃取古田红曲米粗提物、不同地区红曲米粗提物以及不同梯度甲醇-水洗脱液 0.1 mL分别加入2 mL 6.25×10-5mol/L DPPH甲醇溶液中,混匀暗处放置30 min,以甲醇溶液做空白对照,测量其在517 nm处的吸光度(Ai)。同时,测定2 mL DPPH甲醇溶液与0.1 mL甲醇混合液在517 nm处的吸光度(A0);测定2 mL甲醇溶液与0.1 mL样品液在517 nm处的吸光度(Aj)。按照以下公式(1)计算自由基清除率
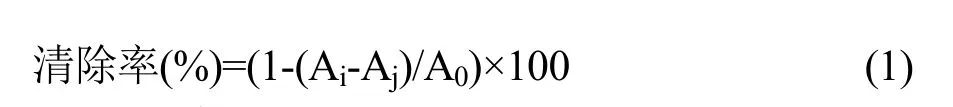
1.3.4 化合物的分离纯化,结构鉴定
1.3.4.1 化合物的分离纯化
将古田地区甲醇萃取物浸膏以少量硅胶粉(200~300目)拌样,拌至呈肉松状松散。上预先处理好的制备型中压液相(反相C18硅胶柱)色谱,水(H)和甲醇(M)用不同比例配成混合物,分别是100%H;75%H-25%M;50%H-50%M;25%H-75%M;100%M,形成不同极性的洗脱溶剂对样品进行梯度洗脱,洗脱液经过旋转蒸发仪浓缩,以TLC进行分析,用紫外分析仪、碘显色、5%硫酸-95%乙醇、碘化铋钾分别显色,比较不同显色方法的情况差异,合并相似的组分,寻找目标点进行下一步的分离纯化。
将合并后的目标组分以 Sephadex LH-20凝胶柱进行纯化,经过中压液相和LH-20凝胶柱层析多次分离纯化,得到相对比较纯的单一目标组分,最后以正相硅胶柱层析进行除杂,得到纯化后的化合物。
1.3.4.2 化合物的结构鉴定
(1)核磁共振分析(NMR)
将纯化后得到的化合物A和B经过旋蒸浓缩后转移至核磁管中,真空减压蒸发蒸干溶剂,加入氘代氯仿,以TMS作为内标,通过400 MHz核磁共振仪测定化合物的核磁谱。测定的项目包括:1H-NMR,13C-NMR。
(2)电喷雾质谱分析(ESI-MS)
将纯化得到的化合物A和B蒸干,取微量以25%氯仿-甲醇溶液溶解,过0.22 μm有机滤膜后测定质谱。电离源为电喷雾电离源,采用负离子及正离子相切换的模式测定。
1.3.5 数据统计分析
红曲粗提物抑菌、抗氧化实验部分所有测定数据均做 3个平行,测定结果以平均值±标准偏差表示。其中不同产地红曲米甲醇萃取物对细菌抑菌能力的比较及不同有机溶剂的古田红曲米萃取物抑菌能力的比较这两部分以 SPSS 17.0软件分析并处理数据,以p<0.05表示具有统计学差异;其它部分实验数据均采用Origin 9.1软件进行处理。
2 结果与讨论
2.1 牛津杯法测定抑菌活性
2.1.1 不同产地红曲米甲醇萃取物对细菌抑菌能力的比较
将福建及其周边地区的红曲米各取一份,对其进行甲醇提取做枯草芽孢杆菌和大肠杆菌的抑菌实验,以SPSS 17.0软件进行数据处理,实验结果如表1。
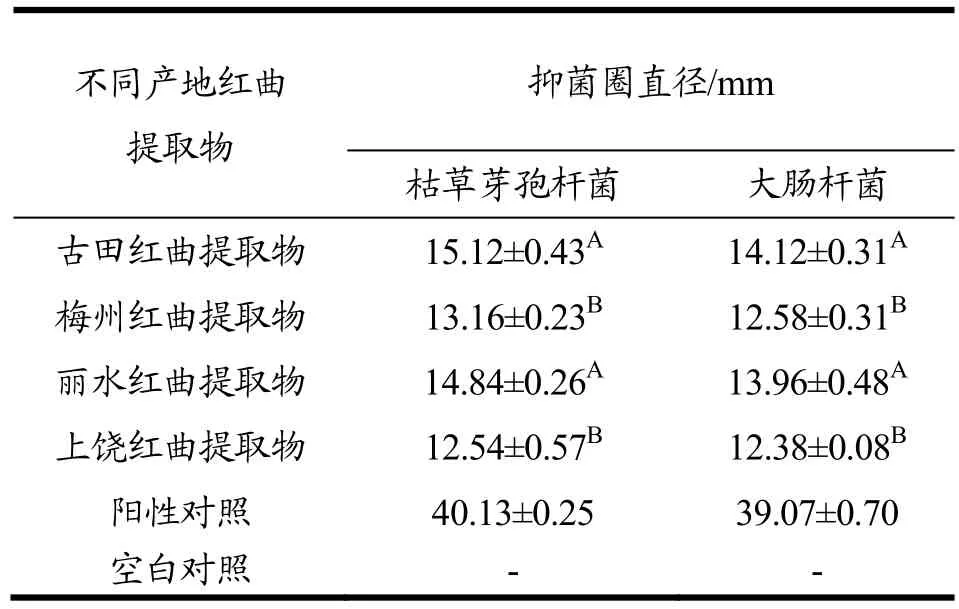
表1 不同产地红曲米甲醇提取物对细菌的抑菌作用Table 1 Bacteriostatic effects of methanol extracts of red yeast rice on bacteria from different regions
从表1分析我们得出,同一地区红曲提取物对枯草芽孢杆菌和大肠杆菌的抑菌效果有差异,其中,红曲提取物对枯草芽孢杆菌的抑菌效果要略高于大肠杆菌;不同产地的红曲米甲醇提取物对枯草芽孢杆菌和大肠杆菌的抑菌效果也不相同,古田和丽水红曲提取物之间对这两种菌株的抑菌效果差异不显著(p>0.05),但是它们对枯草芽孢杆菌和大肠杆菌抑菌效果要好于梅州和上饶红曲米提取物,且古田红曲米相对于其它3个地区,其对枯草芽孢杆菌和大肠杆菌的抑菌作用更好。赵树新等[12]人报道,红曲具有抑菌作用主要是具有多种抑菌活性物质,包括红曲色素、Monascidin A、安卡内酯、几丁质酶、桔霉素和糖肽类物质等。本研究得出的红曲提取物具有抑菌作用,可能是由于红曲提取物中的红曲色素及其它活性物质的存在导致的。
2.1.2 古田红曲米甲醇提取物对不同菌种的抑菌活性
配制系列梯度的古田红曲米甲醇提取物样品溶液,对它做细菌和酿酒酵母的抑菌实验,实验数据以Origin 9.1进行处理,结果如下图1所示。
从图1可以看出,随着红曲米提取物浓度的逐渐增大,对某一菌种而言,其抑菌圈直径呈逐渐增大的趋势。同一浓度的红曲米提取物对不同菌种的抑菌效果也不相同,其中抑菌效果从大到小为枯草芽孢杆菌>大肠杆菌>酿酒酵母菌。因为牛津杯直径为8 mm,因此我们认为,如果抑菌圈直径小于8 mm则无明显的抑菌效果。从图中可以看出,当甲醇提取物浓度为20 mg/mL时,红曲米提取物对酿酒酵母菌无明显作用。
此外,由实验结果我们可以推断出,不同菌种对同一浓度的样品敏感性不同,枯草芽孢杆菌敏感性微大于大肠杆菌,细菌的敏感性远远大于酿酒酵母菌。
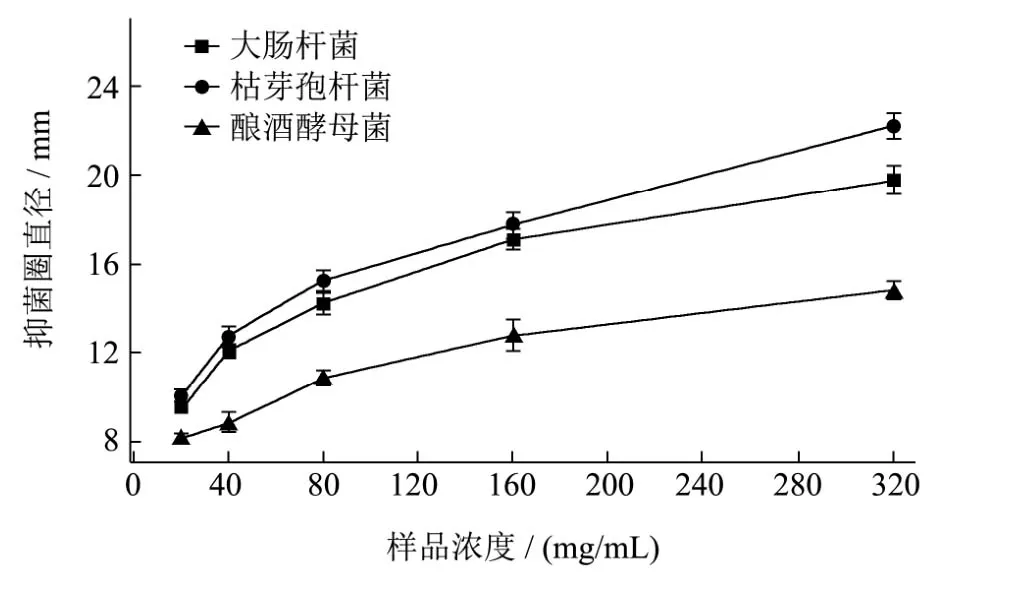
图1 不同浓度古田红曲米甲醇提取物对细菌和酿酒酵母的抑菌作用Fig.1 Bacteriostatic effects of methanol extracts of different concentrations of Gutian red yeast rice on bacteria and saccharomyces cerevisiae
2.1.3 不同有机溶剂的古田红曲米萃取物抑菌能力的比较
选取80 mg/mL以不同有机溶剂萃取的古田红曲米提取物为实验材料,对其做大肠杆菌、枯草芽孢杆菌、酿酒酵母,黑曲霉和塔宾曲霉的抑菌实验,以SPSS 17.0软件进行数据处理,实验结果如表2。
从表2可以得出,同一浓度乙酸乙酯和丙酮提取物对相同菌株的抑菌活性差异不显著(p>0.05),且这两种提取物对各供试菌株均有很好的抑菌效果。甲醇和乙醇提取物之间的抑菌活性除了黑曲霉差异显著外(p<0.05),其余的差异不显著(p>0.05);石油醚提取物与其余提取物相比,同一菌株抑菌方面,均表现为差异显著(p<0.05)。对同一溶剂提取物而言,除丙酮和乙酸乙酯提取物对枯草芽孢杆菌和大肠杆菌的抑菌效果差异不显著外,甲醇、乙醇和石油醚的提取物对这两种细菌均表现为差异显著;在对黑曲霉和塔宾曲霉的抑菌实验中,除乙醇提取物对这两种霉菌抑菌显著外,其余有机溶剂提取物抑菌效果均表现为不显著(p>0.05);此外,同一有机溶剂提取物中,酿酒酵母菌和其它菌种的抑菌活性基本上表现为差异显著(p<0.05)。
总的来说,不同有机溶剂萃取出的古田红曲米提取物对同一菌种的抑菌活性并不相同,对不同菌种的抑菌活性差异也很大。其中同一溶剂,同一浓度的提取物对不同菌种的抑菌活性从大到小基本分为:枯草芽孢杆菌>大肠杆菌>黑曲霉>塔宾曲霉>酿酒酵母,大致可分布为:细菌>霉菌>酵母菌。此外,我们也可以发现,随着提取溶剂极性的较低,相应提取物抑菌活性大致呈现先升高再降低的趋势,其中丙酮和乙酸乙酯提取物抑菌活性相对较高,甲醇和乙醇次之,石油醚提取物抑菌活性最弱,其原因可能是由不同微生物细胞类型不同以及其对抑菌活性物质的敏感度差异造成的[13]。
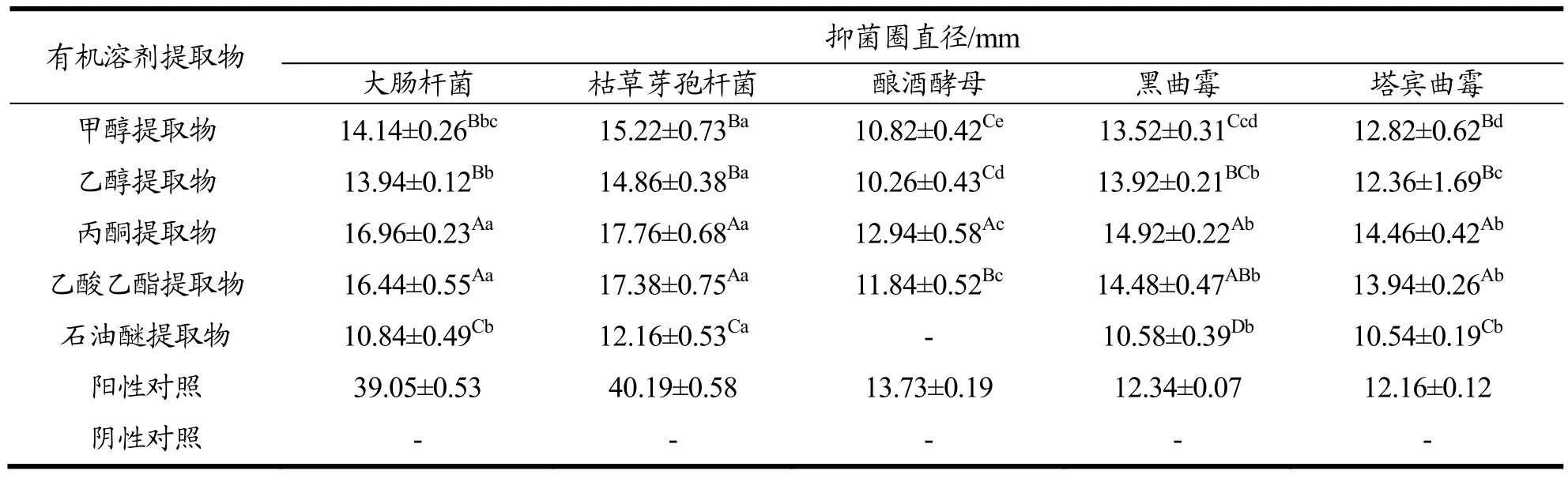
表2 古田红曲米不同有机溶剂提取物对不同菌种的抑菌作用Table 2 Bacteriostatic effects of different organic solvent extracts of red yeast rice on different strains
2.2 DPPH法测定抗氧化能力
2.2.1 不同产地红曲米甲醇提取物清除 DPPH自由基的能力
将甲醇提取古田红曲米粗提物与甲醇提取梅州、丽水、新余红曲米粗提物进行清除DPPH自由基能力的测定,其结果如图2。
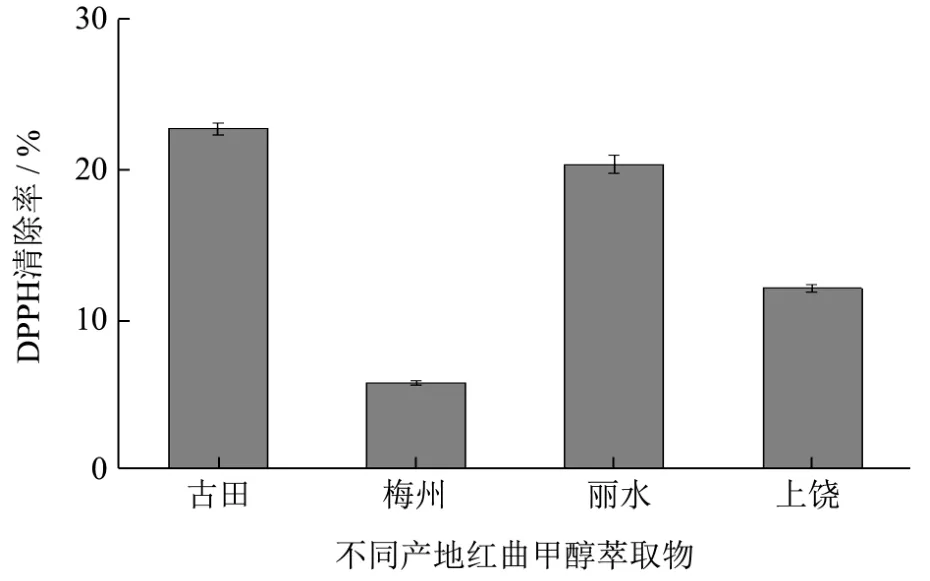
图2 古田与其它地区红曲米提取物清除DPPH自由基的能力Fig.2 Ability of the extracts of red yeast rice from Gutian and other regions to scavenge DPPH free radicals
由图 2可知,不同地区红曲米甲醇提取物清除DPPH自由基的能力有显著差异。其中古田红曲米甲醇提取物清除DPPH自由基的能力最强,丽水红曲米次之,但是和甲醇提取物抗氧化能力相近。古田和丽水红曲米抗氧化能力明显高于上饶和梅州红曲米,出现这种原因的情况可能是与地域环境有关,不同地域产生的红曲其抗氧化成分也不尽相同。林风[14]曾经研究过,国内红曲主要起源于古田地区,悠久的红曲菌种历史环境可能导致了它的独特菌种及相对高抗氧化性。
2.2.2 不同有机溶剂萃取古田红曲米提取物清除DPPH自由基的能力
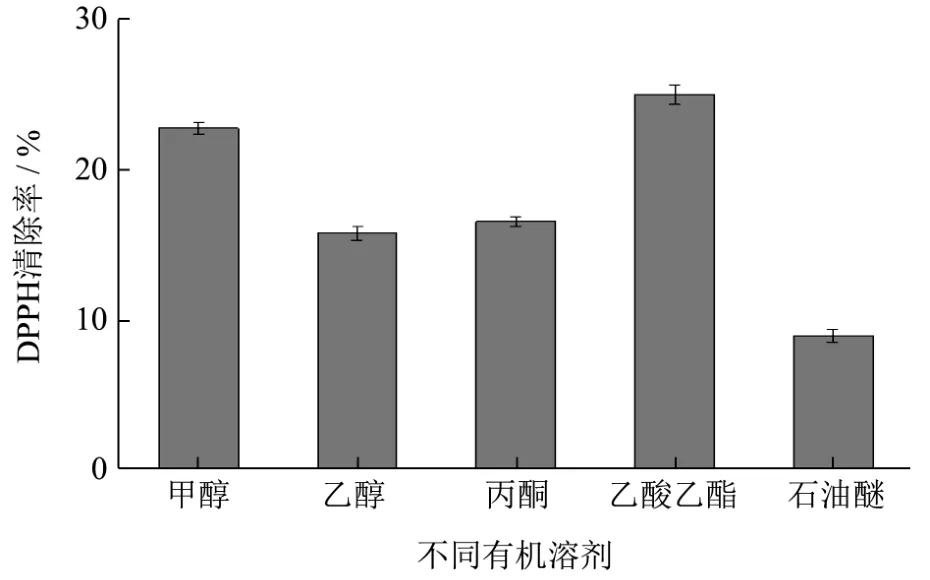
图3 不同有机溶剂萃取古田红曲米提取物清除DPPH自由基的能力Fig.3 Ability of different organic solvent extracts of Gutian red yeast rice to scavenge DPPH free radicals
将甲醇提取古田红曲米粗提物与乙醇、丙酮、乙酸乙酯、石油醚提取古田红曲米粗提物进行清除DPPH自由基能力的测定,其结果如图3。
由图3可知,不同有机溶剂萃取古田红曲米粗提物其清除DPPH自由基的能力存在差异,按照由大到小的顺序排列为:乙酸乙酯>甲醇>丙酮>乙醇>石油醚。甲醇提取物清除DPPH自由基的能力除了比乙酸乙酯提取物清除DPPH能力略低外,都显著高于其它有机溶剂提取物。甲醇提取物比乙酸乙酯提取物清除DPPH自由基能力低的原因推测可能和它的极性有关,由于甲醇极性较大,萃取出一些非活性物质杂质,导致其有效成分相对降低。
2.2.3 古田红曲米甲醇梯度洗脱液清除 DPPH自由基的能力
将2 mg/mL古田红曲米甲醇萃取物不同梯度洗脱液进行清除DPPH自由基的测定,结果如图4。
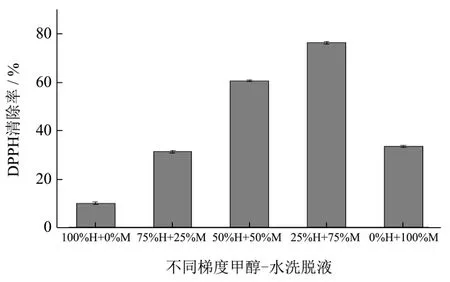
图4 古田红曲米水-甲醇梯度洗脱液清除DPPH自由基的能力Fig.4 Ability of gradient eluent by water and methanol from Gutian red yeast rice to scavenge DPPH free radicals
由图4可知,不同梯度洗脱液其抗氧化活性也不一样。随着甲醇比例的加大,其抗氧化能力在逐渐的升高,在75%M时达到最大值,然后随着甲醇比例继续增大,其清除DPPH自由基的能力开始下降。不同梯度洗脱液清除DPPH自由基能力从大到小依次排列为:75%M>50%M>100%M>25%M>0%M。说明与水相比,相对极性小一点的甲醇洗脱液其清除DPPH自由基的能力较强。因此,选择实验样品时,最好挑选50%M~100%M洗脱液部分进行抗氧化实验研究。
2.3 结构鉴定
2.3.1 化合物A的结构鉴定
用氘代氯仿溶解化合物A,得出的NMR数据如表3所示。化合物A的氢谱中有8种质子信号,δ10.24为羧基的氢信号,δ5.37为双键的氢信号,δ2.80(2H, m)为处于两个双键之间的-CH2-质子信号,δ2.07(2H, m)为-CH2-CH=CH-中-CH2-质子信号,δ1.66(2H, m)为饱和脂肪酸上的-CH2-质子信号,δ1.33(12H, m)为C-8~C-13上的-CH2-质子信号,δ0.91为末端甲基氢信号。
化合物A的碳谱中有17个碳信号,其中δ130.24、δ130.04、δ128.08、δ127.91可推测为共轭双键的碳信号,δ33.70为-CH2-COOH中-CH2-信号,δ14.08为末端-CH3碳信号,其它信号可推测为甲基或者亚甲基的碳信号。用25%氯仿-甲醇溶解化合物A进行ESI-MS分析。ESI(-)-MS:m/z=279.41[M-H]-,则 M=280.41。

表3 化合物A的C、H归属Table 3 C, H assignment of compound A
经数据解析,并与数据库比对,鉴定化合物A为亚油酸,分子式为C18H32O2,结构如图5所示。亚油酸可以作为医药品的原料,有研究表明,亚油酸具有降低体内脂肪含量,防止动脉硬化,抑制癌症和肿瘤生成,同时它也可以增强人体免疫力,降低人体血液中胆固醇和血脂的作用[15]。
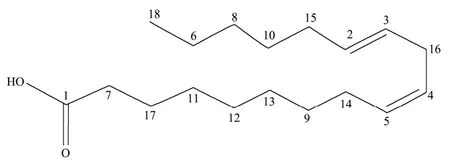
图5 化合物A的结构图Fig.5 The structure of compound A
2.3.2 化合物B的结构鉴定
用氘代氯仿溶解化合物B,得出的NMR数据如表4所示。化合物B的氢谱中有8种质子信号,δ9.79为羧基的氢信号,δ5.37为双键的氢信号,δ2.81(4H, t)为处于两个双键之间的-CH2-质子信号,δ2.07(4H, m)为-CH2-CH=CH-中-CH2-质子信号,δ1.65(2H, s)为 C-3上的-CH2-质子信号,δ1.33(8H, m)为 C-4~C-7上的-CH2-质子信号,δ0.95为末端甲基氢信号。化合物B的碳谱中有 18个碳信号,其中δ130.23、δ130.09、δ130.03、δ128.08、δ127.98 和δ127.91 为-CH=CH-上的碳信号,δ33.68为-CH2-COOH中-CH2-信号,δ27.21为C-3上-CH2-碳信号,δ29.36、δ29.08、δ29.06和δ29.03为C-4~C7的-CH2-碳信号,δ27.19和δ22.58为C-8和C-17的碳信号,δ14.06为末端-CH3碳信号。用25%氯仿-甲醇溶解化合物 B进行 ESI-MS分析。ESI(+)-MS:m/z=301.09[M+Na]+,则 M=278.09。
经数据解析,并与文献[16]比对,鉴定化合物B为α-亚麻酸,分子式为C18H30O2,结构如图6所示。
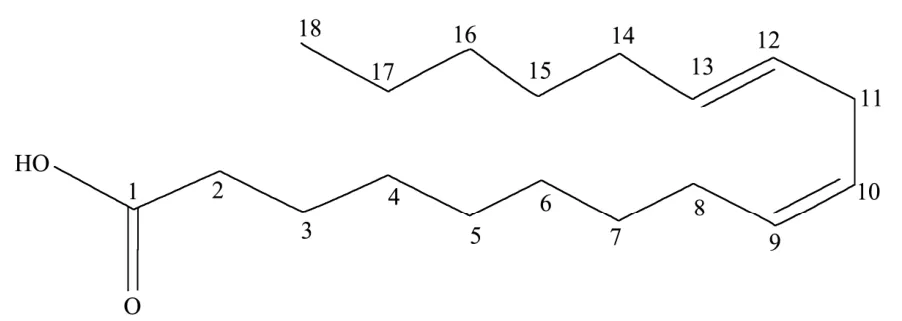
图6 化合物B的结构图Fig.6 The structure of compound B

表4 化合物B的C、H归属Table 4 C, H assignment of compound B
α-亚麻酸是人体必需的油脂,具有降脂、降血压、改善心血管疾病等作用,将其作为食品添加剂加入到食品中可用来预防和治疗视力下降,心血管疾病,老年痴呆症和癌症等病症[17]。α-亚麻酸对损伤细胞具有保护作用,对部分癌细胞具有抑制生长作用,能调节胰岛素缺乏小鼠体内脂肪和血糖代谢[18],其众多功效有待进一步研究。
3 结论
3.1 本文通过比较古田红曲和其它地区红曲对枯草芽孢杆菌和大肠杆菌的抑菌作用研究,得出古田红曲米相比其它地区红曲具有较高的抗细菌活性这个结论,并以此为依据,选取古田红曲米对其不同有机溶剂萃取物进行了进一步的抑菌研究,结果表明,不同有机溶剂萃取物对同一菌种的抑菌活性差别很大,同一溶剂萃取物对不同菌株的抑菌活性也不相同,其中乙酸乙酯和丙酮提取物的抑菌活性与其它有机溶剂提取物相比总体上来说具有较好的效果。此外,我们得出不同菌株对红曲提取物的敏感度由大到小依次为:枯草芽孢杆菌>大肠杆菌>黑曲霉>塔宾曲霉>酿酒酵母菌。同时,在以甲醇-水为洗脱剂对古田红曲米不同极性洗脱液抗氧化活性实验中,我们发现,50%水-甲醇洗脱液至 100%甲醇洗脱液这一部分相对而言具有较高的抗氧化活性。最后,对古田红曲米甲醇提取物进行了分离纯化及结构鉴定,成功分离出亚油酸和α-亚麻酸两种活性物质,这两种活性物质都具有一定的抗氧化,降血脂及抗肿瘤等生理活性作用,这在一定程度上验证了红曲是具有功能性活性成分的药食两用的食材。
3.2 综上,本实验所得结果为红曲相关抑菌、抗氧化产品的开发提供了一定的理论指导及借鉴作用,同时红曲中的活性物质为进一步开发研究功能性红曲产品奠定了基础。
[1]王亚威,武晓红,王鸿.红曲霉抑菌作用和抑菌成分的研究[J].中国调味品,2012,37(2):32-34,41 WANG Ya-wei, WU Xiao-hong, WANG Hong. Studies on thei nhibitory effect and components of monascus [J]. China Condiment, 2012, 37(2): 32-34, 41
[2]王玲,吴军林,吴清平.红曲降血脂功能的研究及应用概况[J].食品工业科技,2014, 35(8):387-389,393 WANG Ling, WU Jun-lin, WU Qing-ping. Research and application progress of red yeast rice for lowering the blood Chelosterol Level [J]. Science and Technology of Food Industry, 2014, 35(8): 387-389, 393
[3]Lee C L, Lin P Y, Hsu Y W, et al. Monascus-fermented monascin and ankaflavinImprove the memory and learning ability in amyloidβ-protein intracerebroventricular-infused rat via the suppression of alzheimer's disease risk factors [J].Journal of Functional Foods, 2015, 18: 387-399
[4]温学伟,马新,周立平,等.红曲抗氧化的研究进展[J].食品工业科技,2011,32(2):376-378 WEN Xue-wei, MA Xin, ZHOU Li-ping, et al. Research advances of antioxidant action in monascus [J]. Science and Technology of Food Industry, 2011, 32(2): 376-378
[5]Liu S F, Wang Y R, Shen Y C, et al. A Randomized,double-blind clinical study of the effects of ankascin 568 plus on blood lipid regulation [J]. Journal of Food & Drug Analysis, 2017
[6]李明起,陈运中,潘叶.柱层析分离纯化功能性红曲米中的有效成分[J].中国酿造,2011,30(5):41-45 LI Ming-qi, CHEN Yun-zhong, PAN Ye. Separation and purification of effective components in functional monascus pigment by column chromatography [J]. China Brewing,2011,30(5): 41-45
[7]周香珍,林书发,何书华.红曲药学评价研究进展[J].中国现代中药,2016,18(7):936-941 ZHOU Xiang-zhen, LIN Shu-fa, HE Shu-hua. Research progress in pharmacodynamics evaluation red yeast rice [J].Modern Chinese Medicine, 2016, 18(7): 936-941
[8]赵敏.亚油酸及亚油酸甲酯的抗炎作用研究[D].成都:西南交通大学,2012 ZHAO Min. Research on anti-inflammatory action of linoleic acid and methyl linoleate [D]. Chengdu: Southwest Jiaotong University, 2012
[9]SanGiovanni J P, Chew EY. The role of omega-3 Long-chain polyunsaturated fatty acids in health and disease of the retina[J]. Progress in Retina and Eye Research, 2005, 24(1): 87-138
[10]Huang T H, Chen C L, Hung C J, et al. Comparison of antibacterial activities of root-end filling materials by an agar diffusion assay and alamar blue assay [J]. Journal of Dental Sciences, 2012, 7(4): 336-341
[11]曾岚,陈荣华,蒋昀,等.发酵麦麸酚酸类物质的抗氧化活性的研究[J].食品科技,2015,12:128-131 ZENG Lan, CHEN Rong-hua, JIANG Yun, et al. Study on antioxidant activity of phenolic acids fermented in the wheat bran [J]. Food Science and Technology, 2015, 12: 128-131
[12]赵树欣,张建玲.红曲抑菌物质研究的现状与展望[J].中国酿造,2011,30(3):5-8 ZHAO Shu-xin, ZHANG Jian-ling. Antibiotic components in hongqu [J]. China Brewing,2011,30(3):5-8
[13]Oskay M, Sari D. Antimicrobial screening of some turkish medical plants [J]. Pharmaceutical Biology, 2007, 45(3): 176-181
[14]林风.福建古田为红曲发源地考证[J].中草药,2017, 48(13):2793-2800 LIN Feng. Textual research on gutian as place where red yeast rice originated [J]. Chinese Traditional and Herbal Drugs, 2017, 48(13): 2793-2800
[15]Benjamin S, Spener F. Conjugated linoleic acids as functional food: an insight into their health benefits [J]. Nutrition &Metabolism, 2009, 6(1): 36
[16]Falkenstein E, Groth B, Mithöfer A, et al. Methyljasmonate and α-linolenic Acid are Potent Inducers of Tendril Coiling[J]. Planta, 1991, 185(3): 316-322
[17]吴俏槿,杜冰,蔡尤林,等.α-亚麻酸的生理功能及开发研究进展[J].食品工业科技,2016,37(10)WU Qiao-jin, DU Bing, CAI You-lin, et al. Research development of alpha-linolenic acid [J]. Science and Technology of Food Industry, 2016, 37(10)
[18]Oliva M E, Ferreira M R, Chicco A, et al. Dietary Salba(Salvia HispanicaL) seed rich inα-linolenic acid improves adipose tissue dysfunction and the atered skeletal muscle glucose and lipid metabolism in dyslipidemic insulinresistant rats [J]. Prostaglandins Leukotrienes & Essential Fatty Acids, 2013, 89(5): 279

