Arrb2基因敲除小鼠的繁育及基因型鉴定
孙妩弋,孙家昌,厉歆然,彭文婷,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,抗炎免疫药物安徽省协同创新中心,安徽 合肥 230032)
β-arrestin2属于Arrestin家族的一种调控蛋白,其基因编码为Arrb2,是在提纯β肾上腺素受体激酶的过程中被发现的。它不仅可以调节G蛋白偶联受体(G protein-coupled receptors, GPCRs)的脱敏和内化[1],还可以对酪氨酸激酶受体(tyrosine kinase receptor,TKR)、丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)等介导的信号转导产生一定影响,在细胞的增殖、凋亡及炎症反应中都起着至关重要的作用[2]。β-arrestin2广泛分布于各个组织器官,在恶性肿瘤、纤维化等多种疾病中,发挥重要的调控作用,使其成为研究热点[3]。Arrb2基因敲除模型可以利用敲除编码β-arrestin2的基因,从整体水平研究β-arrestin2蛋白的功能。本文针对Arrb2基因敲除小鼠的繁育和基因型鉴定,对其方法学进行探讨和优化,旨在为相关机制的研究建立更好的Arrb2敲除动物模型。
1 材料
1.1实验动物Arrb2基因敲除型(KO)纯合子(-/-)小鼠,♂,购自美国Jackson 实验室,为C57BL/6J遗传背景。野生型(wide type,WT) C57BL/6J小鼠购自中国科学技术大学生命科学学院实验动物中心。实验动物均在无特定病原体(specific pathogen free,SPF)级条件动物房饲养及繁育。所有实验动物的操作及饲养均符合国标及安徽省实验动物管理饲养条例。
1.2试剂Genotyping Mix(美国Kapa Biosystems公司);琼脂糖凝胶(美国Genetech公司);Proteinase K(美国Sigma Aldrich公司);异丙醇(上海试剂一厂);RIPA蛋白裂解液、苯甲基磺酰氯(phenylmethyl sulfonylfluoride,PMSF)、5×电泳加样缓冲液(碧云天生物技术公司);抗β-actin抗体、抗β-arrestin2抗体(美国Santa Cruz公司);辣根酶标记山羊抗小鼠IgG(北京中杉金桥生物公司);ECL化学发光试剂盒(美国Pierce Biology公司)。
1.3仪器通用型电泳仪JY200C(北京君意仪器厂),荧光定量PCR仪(美国ABI公司),Tanon-1600全自动数码凝胶图像分析系统(上海天能公司),LAS4000Mini型化学发光成像分析仪(美国GE公司)。
2 方法
2.1Arrb2基因敲除小鼠的饲养繁殖Arrb2基因敲除小鼠于中国科学技术大学生命科学学院实验动物中心SPF级动物房内饲养和繁殖。饲养温度18~22℃,相对湿度40%~70%,明暗循环12 h/d,自由饮食和饮水。小鼠笼盒、垫料、饲料、饮用水均经过高温高压消毒灭菌处理。同时,小鼠定期给予灭菌葵花籽以补充营养。饲养过程中,每天进入SPF动物房观察和记录小鼠的生长情况。每周更换2次小鼠垫料,每天补充饲料和饮用水。繁殖初期,纯合♂鼠与野生型♀鼠1 ∶2进行合笼,小鼠的性成熟期为8周左右,母鼠妊娠期为21 d左右。繁殖出F1代杂合子鼠后,1 ∶2进行合笼,以便得到更多F2代小鼠进行检测。
2.2小鼠尾部组织基因组DNA的提取待子鼠2周龄时,将小鼠尾部组织剪取长约0.5 cm的小段于1.5 mL EP 管中,加入490 μL的鼠尾裂解缓冲液和10 μL Proteinase K,枪头抽吸混匀,60℃水浴过夜。隔天置于沸水中煮10 min,终止裂解。置于4℃冰箱中,待管中析出大量白色絮状蛋白后,10 000×g离心10 min,吸取上清至另一新的1.5 mL EP管中,加入同等体积预冷的异丙醇,混匀,室温静置10 min,10 000×g离心10 min。弃上清,加入1 mL预冷的70%乙醇10 000×g离心10 min,弃上清。室温下静置30 min使乙醇挥发,再加入30 μL去核酸水溶解,置4℃冰箱备用。
2.3PCR扩增反应及琼脂糖凝胶电泳进行基因型鉴定
2.3.1引物设计 引物序列由上海Invitrogen公司合成,Wild type: 5′-GCCTGAGTGTTCCCTGAAGA-3′,Common: 5′-C TGAAAGGTGGGTGTCCTGT-3′,Mutant: 5′-AAAAGCGCCTCC CCTACG-3′。目的基因片断长度分别为186 bp 和224 bp。
2.3.2PCR体系 去核酸水7.75 μL,Genotyping Mix 12.5 μL,3种引物各加入1.25 μL,目的基因样本加入1 μL。采用PCR仪进行扩增,反应条件为:预变性95℃ 3 min,变性95℃ 15 s,退火60℃ 15 s,延伸72℃ 15 s,循环40次,72℃ 1 min 终止反应。
2.3.32%琼脂糖凝胶电泳 琼脂糖0.6 g,1×TAE buffer 30 mL,溴化乙啶(EB) 1 μL;上样DNA 10 μL,电泳电压110 V,时间为50 min。于化学发光凝胶成像系统中拍照观察。
2.3.4基因型结果判定 Common和mutant引物扩增产物长度为186 bp 左右条带,为KO小鼠;Wild type和common引物扩增产物长度为224 bp左右条带,为WT小鼠;两条电泳条带均存在的为杂合小鼠。
2.4Westernblot检测β-arrestin2蛋白的表达提取F2代小鼠肝组织和肾组织总蛋白,进行标准蛋白定量。上样后采用10% SDS-PAGE电泳,后转移至PVDF膜,5%脱脂奶粉室温封闭2 h,加入β-arrestin2一抗(1 ∶1 000),4℃孵育过夜,次日用TPBS洗3次,每次10 min,加入对应山羊抗小鼠IgG(1 ∶6万),室温孵育2 h,TPBS洗3次,每次 10 min。PBS洗10 min,化学发光成像分析仪扫膜并采集图像,定影。Image J 软件分析目的条带灰度值。

3 结果
3.1小鼠的繁殖情况F1代母鼠成功繁殖出子代幼鼠(F2)。将获得的F2代纯合子小鼠与异性杂合子交配,成功繁殖出更多的基因敲除纯合子小鼠(F3)。每只母鼠妊娠期为19~21 d,每胎产3~8只幼鼠,成活率>90%。纯合Arrb2基因敲除小鼠体型相比杂合子小鼠较小(Fig 1),且幼崽相对不易存活。
3.2小鼠基因型鉴定结果F2代部分小鼠基因型鉴定结果见Fig 2A,其中1、2、3、4、6号出现1条224 bp的条带,为野生型小鼠;5、7、9号分别出现186 bp 和224 bp两条条带,为杂合子小鼠;8号出现1条186 bp的条带为纯合子小鼠。把F2代纯合子小鼠和异性杂合子小鼠挑出进行合笼,产生F3代小鼠进行基因型检测,结果见Fig 2B,其中1、2、5、7、8、9号出现186 bp 和224 bp 的两条条带,为杂合子小鼠;3、4、6只出现1条186 bp 左右条带,为纯合子小鼠。分别挑选♀、♂纯合子基因型小鼠进行扩繁,得到的F4代及以后只出现1条186 bp 左右条带(Fig 2C),全部为纯合基因敲除小鼠。
3.3基因敲除小鼠β-arrestin2蛋白表达情况为了进一步确认PCR结果的可靠性,我们选取经PCR鉴定获得的野生型、纯合子、杂合子小鼠,应用 Western blot方法检测β-arrestin2蛋白在肝脏和肾脏组织中的表达。结果如Fig 3、4所示,野生型和杂合型小鼠脏器中可见β-arrestin2蛋白的表达,纯合子小鼠脏器几乎不表达β-arrestin2蛋白,结果与PCR方法鉴定所得的结果一致。说明应用PCR方法鉴定小鼠基因型结果快捷、可靠。

Fig 1 Appearance of F3 generation mice at difference age
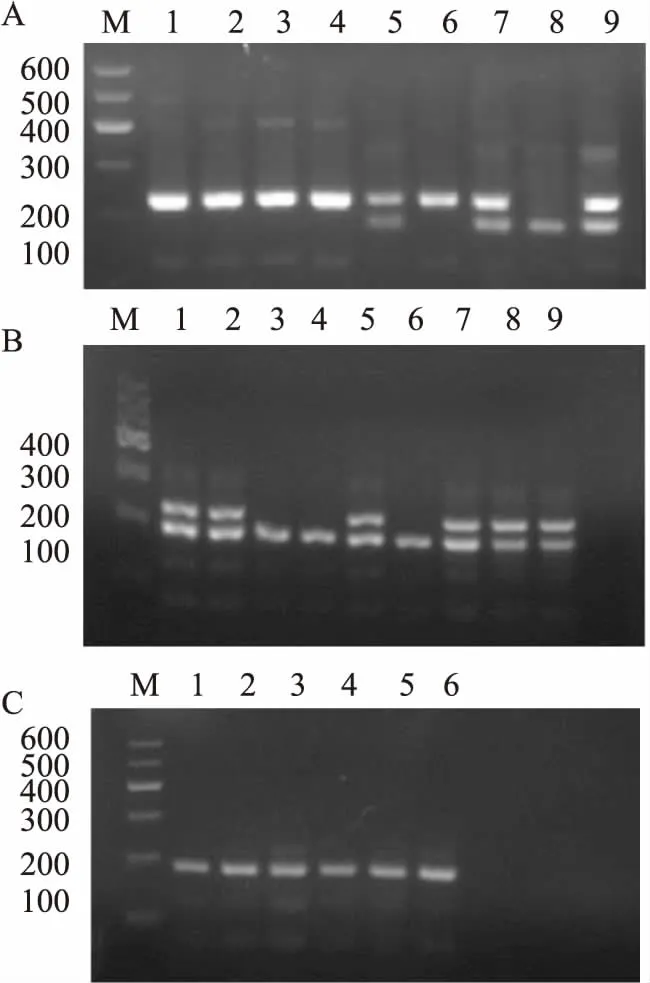
Fig 2 Results of genotype identification of mice by PCR
A: Genotype identification of F2 generation mice; B: Genotype identification of F3 generation mice; C: Genotype identification of F4 generation mice. M: Marker; 1-9: Mice of F2, F3 or F4 generation.
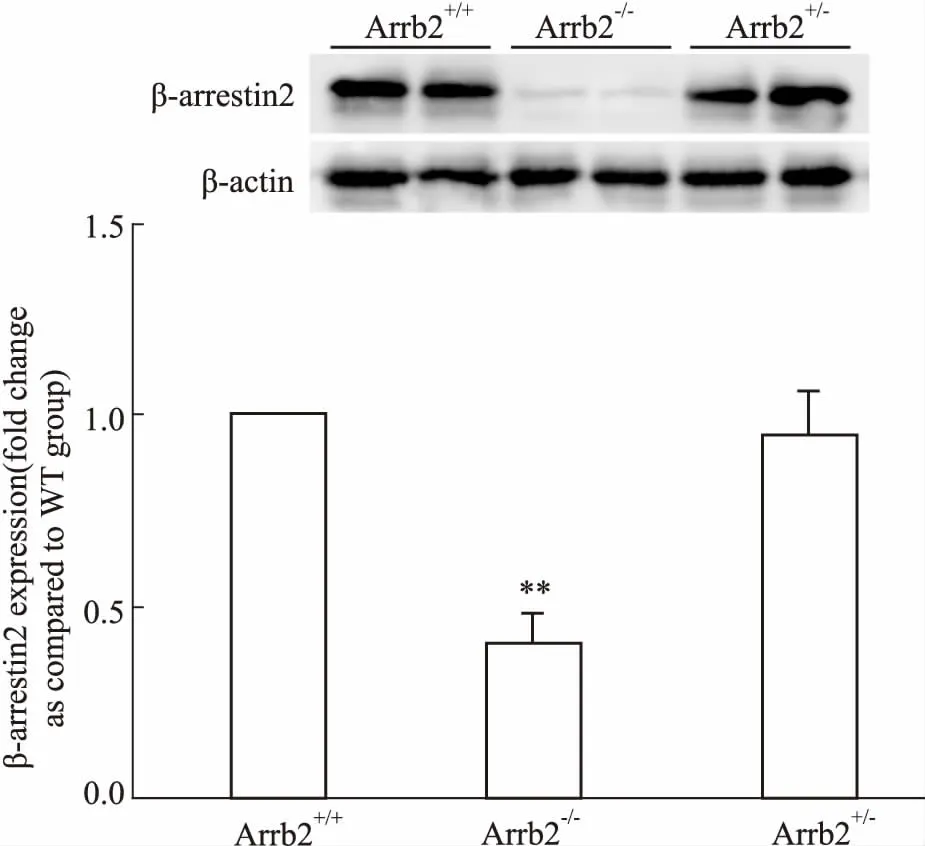
Fig 3 Expression of β-arrestin2 in liver of different genotypes
**P<0.01vsArrb2+/+group
4 讨论
Arrestin基因家族是一类信号调控蛋白,分子质量为48~55 ku,由4个成员构成。arrestin1主要分布在视网膜视杆和视锥细胞,被称做视觉arrestin;arrestin4仅分布在视网膜视锥细胞中,又称锥体arrestin;β-arrestin1(arrestin2)和β-arrestin2 (arrestin3)广泛分布在体内各个组织中[4]。β-arrestin1和β-arrestin2在结构上有78%的氨基酸是相同的,在功能上也有所重叠[5]。在基因敲除的过程中发现,单独敲除β-arrestin1或β-arrestin2的小鼠可以存活,同时敲除则致死,说明β-arrestin1和β-arrestin2在生理功能上有所重叠,且至关重要[6]。大量研究表明,β-arrestin2与多种疾病的发生密切相关。β-arrestin2与GPCRs结合后,可以从空间结构上阻止GPCRs与配体的结合,还能通过募集磷酸二酯酶4D和二乙酰激酶等,降解GPCRs信号转导通路中的第二信使环磷酸腺苷,从而终止GPCRs下游信号的转导[7]。除此之外,β-arrestin2还可以作为激酶信号通路的支架蛋白,与Src家族酪氨酸激酶、细胞外信号调节激酶(extracellular regulated protein kinase,ERK)、c-Jun氨基末端激酶3(c-Jun amino-terminal kinase 3,JNK3)等信号分子结合,形成支架蛋白复合物,将胞膜信号传导到激酶信号通路中[8]。β-arrestin2还可以通过调节免疫细胞,参与免疫反应[9]。
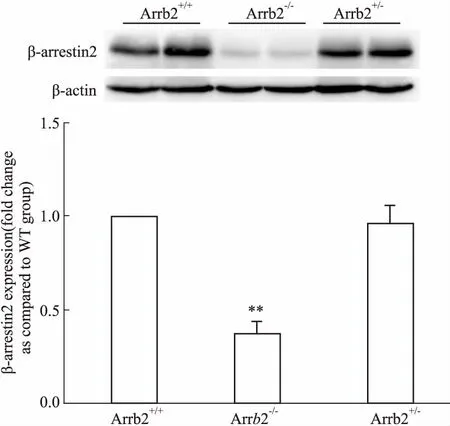
Fig 4 Expression of β-arrestin2 in kidney of different genotypes
**P<0.01vsArrb2+/+group
β-arrestin2在肝脏、肾脏等脏器中有丰富的表达。β-arrestin2可作为糖尿病研究的新靶点,在糖尿病肾病模型中,相比正常组,模型组小鼠肾脏中β-arrestin2的表达出现明显下降。在Ⅱ型糖尿病小鼠模型中,β-arrestin2敲除小鼠在糖代谢方面存在严重的缺陷,β-arrestin2过表达可明显提高对胰岛素的敏感性[10-11]。本课题组前期建立猪血清诱导的肝纤维化模型,研究发现随着肝纤维化程度加重,肝组织中β-arrestin2的表达逐渐增加。此研究表明β-arrestin2与肝纤维化疾病的发病机制有一定的联系,提示β-arrestin2可能促进了肝纤维化的发展[12]。在博来霉素诱导的小鼠肺纤维化模型中,β-arrestin1或β-arrestin2的缺失可以减少细胞外基质和胶原的沉积,保护肺功能[13]。此外,自身免疫病、心血管系统疾病、神经系统疾病、肿瘤等疾病的发生、发展,均发现与β-arrestin2有密切联系[14]。因此,β-arrestin2相关作用机制的研究还需不断地探索和发展。
基于此我们引进了β-arrestin2基因敲除小鼠,并按照SPF级标准进行饲养繁育。采用较为简便易行、重复性、适用性较好的琼脂糖凝胶电泳的方法,进行基因型分型。由于β-arrestin2广泛参与多种生理过程,该基因的敲除可能会造成生长发育的部分功能减弱或障碍,在饲养过程中我们也发现,Arrb2基因敲除纯合子小鼠相对体型较小,所以在饲养和繁殖的过程中要格外注意。本次实验我们采用杂合子小鼠杂交方式繁育,筛选所需基因型,野生型和纯合子小鼠可进行对照造模,进行表型分析;剩余的杂合子小鼠又可进行保种再繁育解决后续问题,该方法恰好能够同时兼顾两方面的需求。通过一段时间的饲养我们得到了一批基因敲除小鼠,这为β-arrestin2相关机制的研究提供了较好的模型,对整体实验具有重要意义。
[1] Fereshteh M, Ito T, Kovacs J J, et al. beta-Arrestin2 mediates the initiation and progression of myeloid leukemia[J].ProcNatlAcadSciUSA, 2012,109(31): 12532-7.
[2] Gu Y J, Sun W Y, Zhang S, et al. The emerging roles of beta-arrestins in fibrotic diseases[J].ActaPharmacolSin, 2015,36(11): 1277-87.
[3] Smith J S, Rajagopal S. The beta-arrestins: multifunctional regulators of G protein-coupled receptors[J].JBiolChem, 2016,291(17): 8969-77.
[4] Reiter E, Lefkowitz R J. GRKs and beta-arrestins: roles in receptor silencing, trafficking and signaling[J].TrendsEndocrinolMetab, 2006,17(4): 159-65.
[5] Yu M C, Su L L, Zou L, et al. An essential function for beta-arrestin 2 in the inhibitory signaling of natural killer cells[J].NatImmunol, 2008,9(8): 898-907.
[6] DeWire S M, Ahn S, Lefkowitz R J, et al. Beta-arrestins and cell signaling[J].AnnuRevPhysiol, 2007,69:483-510.
[7] Barki-Harrington L, Rockman H A. Beta-arrestins: multifunctional cellular mediators[J].Physiology(Bethesda), 2008,23:17-22.
[8] Becuwe M, Herrador A, Haguenauer-Tsapis R, et al. Ubiquitin-mediated regulation of endocytosis by proteins of the arrestin family[J].BiochemResInt, 2012,2012: 242764.
[9] Lanier L L.NK cell recognition[J].AnnuRevImmunol, 2005,23:225-74.
[10] Luan B, Zhao J, Wu H, et al. Deficiency of a beta-arrestin-2 signal complex contributes to insulin resistance[J].Nature, 2009,457(7233): 1146-9.
[11] Tang L Q, Ni W J, Cai M, et al. Renoprotective effects of berberine and its potential effect on the expression of beta-arrestins and intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 in streptozocin-diabetic nephropathy rats[J].JDiabetes, 2016,8(5): 693-700.
[12] Sun W Y, Song Y, Hu S S, et al. Depletion of beta-arrestin2 in hepatic stellate cells reduces cell proliferation via ERK pathway[J].JCellBiochem, 2013,114(5): 1153-62.
[13] Lovgren A K, Kovacs J J, Xie T, et al. beta-arrestin deficiency protects against pulmonary fibrosis in mice and prevents fibroblast invasion of extracellular matrix[J].SciTranslMed, 2011,3(74): 74ra23.
[14] 谷元婧, 孙妩弋, 张 森, 等. β-arrestins与纤维化疾病的研究进展[J]. 中国药理学通报, 2015,31(2):170-5.
[14] Gu Y J, Sun W Y, Zhang S, et al. Research progress of β-arrestins in fibrotic disease[J].ChinPharmacolBull, 2015,31(2):170-5.

