头顶一颗珠对AD模型大鼠脑海马组织Tau蛋白磷酸化及突触发育的影响
陈 玮,罗洪斌,2,3,4,鲁文杰,牟南樵,黄 胜,陈 娟,樊莎莎,谢文执,商 楠,杨晨宇,谢枫枫,谌 勤
(湖北民族学院1.医学院生物化学与分子生物学教研室、2.科技学院医学系生物化学与分子生物学教研室、3. 生物资源保护与利用湖北省重点实验室、4. 神经精神共患病研究所、5.附属民大医院神经内科,湖北 恩施 445000)
阿尔茨海默病(Azheimer’s disease, AD)是一种神经退行性疾病,也是最为常见的老年痴呆症,随着全球老龄化进程的不断加快,其发病率也呈上升趋势[1]。AD的主要临床特征为进行性认知功能障碍,老年斑(amyloid-β protein, SP)、神经纤维缠结(neurofibrillary tangles, NFTs)、营养不良性神经炎和神经元功能受损为其主要病理特征[2]。SP是由细胞外淀粉样前体蛋白(amyloid precursor protein, APP)异常分裂产生的毒性β淀粉样肽1~40, 42(Aβ1~40, 42)堆积形成,NFTs是由细胞内Tau蛋白过度磷酸化异常聚集形成的[2]。同时,Tau蛋白的过度磷酸化还是AD早期病理学特征性改变,所形成的NFTs数量与患者痴呆程度相关[3],因此,通过抑制Tau的过度磷酸化应该是治疗AD的关键。糖原合酶激酶3(glycogen synthase kinase 3,GSK-3)是一种多功能丝氨酸/苏氨酸蛋白激酶,包含GSK-3α和GSK-3β两种异构体。其中GSK-3β在促进Tau蛋白异常过度磷酸化、毒性Aβ的产生、营养不良性神经炎和神经元受损过程中都起着非常重要的作用[4],并通过PI3K/Akt信号通路发挥作用[4]。因此,寻找能影响其活性的药物便成为防治AD的重要研究途径。
传统中药在防治AD方面具有不可替代的优势,因此有必要进行深入研究以寻找较为有效的中药及其有效成分。头顶一颗珠(TrilliumTschonoskiiMaxim, TTM)为百合科延龄草属植物,为传统土家中药,多产于鄂西山区,为当地四大神药之一,主要功效为镇静安神、活血止血、祛痰除瘀等[5]。近年来的研究发现,TTM具有潜在的治疗AD作用[6],并有抗氧化、延缓衰老之疗效[6]。因此,有必要针对TTM对AD的防治作用进行深入研究,并掌握其详细作用机制,促进该药开发利用。
1 材料与方法
1.1药物与试剂TTM购自湖北华润新龙(恩施)医药有限公司,并经专家文德鉴副教授鉴定。根据临床用药人的剂量(60 kg)为标准,文献记载[5]TTM临床标准剂量为5~6 g,每人用药剂量为0.083 g·kg-1·d-1,成人与大鼠的折算系数为6.25,其相对于人的临床用量大鼠等效剂量为0.083×6.25=0.5 g·kg-1·d-1。换算成大鼠(250 g为标准体质量)的低、中、高剂量分别为0.125、0.25、0.5 g·kg-1·d-1,换算根据《药理实验中动物间和动物与人体间的等效剂量换算》进行计算。其水煎液制备方法:称量20 g TTM,提前1 d水充分浸泡,d 2加适量水煎煮1 h,煎煮2次,合并药液,纱布过滤,再低速离心弃底下沉淀物,得到上清液,再浓缩定量至0.2 kg·L-1的溶液,保存备用。GF-109203X (GFX):英国Tocris公司;Wortmannin (WT):美国Millipore公司;超敏二步法免疫组化检测试剂盒:中国北京中杉金桥生物技术有限公司;GSK-3β抗体:美国Cell Signaling Technology公司;S9-GSK-3β、pT205、pT231、pS262、pT356、pS396、pS404抗体:美国SAB公司;Tau-5抗体:美国Abcam公司;β-actin抗体:美国Proteintech公司;BCA蛋白测定试剂盒、DAB显色试剂盒:中国康为世纪生物科技有限公司。
1.2仪器DMS-2型Morris水迷宫系统(中国医学科学院药物研究所);大鼠68002双臂脑定位仪(中国瑞沃德生命科技有限公司);099CK5424电动匀浆机(美国GLAS-COL公司);FDL-400S超声仪(中国凡辛朗科技有限公司);1510全波长酶标仪(美国Thermo Fisher Scientific公司); Odyssey扫描仪(Licor biosciences,美国Gene Company);电泳仪电源、垂直电泳槽、湿转槽(美国Bio-Rad公司); VT1200S振荡切片机(德国Leica公司)。
1.3实验动物与分组购自湖北省实验动物研究中心的♂SD大鼠,合格证号42000600003985,该中心许可证号SCK(鄂)2015-0018。大鼠体质量(250±30)g,50只,自由进食饮水1周后随机分配为5组:假手术组、AD模型组、高、中、低TTM治疗组、每组10只。
1.4AD模型的建立及给药和Morris水迷宫训练给药组均按每只SD大鼠体质量给予足量TTM的水煎液灌胃7 d,假手术组和AD模型组则灌胃饮用水7 d。从灌胃d 2开始进行水迷宫训练,训练5 d后,寻找能在15 s内找到隐藏平台的SD大鼠(其搜索轨迹应简单、笔直)用于以下实验[7]。训练d 6,再行侧脑室注射WT+GFX各5 μL(将WT和GFX均溶于2% DMSO中,浓度均为100 μmol·L-1)造模[8]。假手术组给予10 μL的2% DMSO。术后给予温暖环境,待大鼠苏醒。24 h后立即进行Morris水迷宫测试。其训练和测试方法均参照文献[7],并做适当修改。记录实验大鼠寻找平台的潜伏期和游泳轨迹。
1.5海马匀浆蛋白Westernblot分析Morris水迷宫测试完后,立即断头取脑,并在冰上快速分离出完整海马,匀浆后行Western blot(WB)实验,参照本课题组前期建立实验方法完成[12-13]。一抗分别为Tau蛋白多个磷酸化位点(p-Tau)以及GSK-3β、S9-GSK-3β、PKC、PI3K、Akt、突触囊泡素(Synaptophysin)和突触素-1(Synapsin-1)等。荧光二抗孵育1 h后,用1×TBST洗涤3次,每次10 min。最后Odyssey扫描成像显色分析,使用其专有软件分析灰度值。
1.6脑片免疫组化法(immunohistochemistry,IHC)染色大鼠迷宫测试完后,7%水合氯醛麻醉大鼠,固定后,参照文献方法[7]行4%多聚甲醛液灌流内固定,取完整大脑后,再用4%多聚甲醛继续后固定。振荡切片机切完整脑片,保存于含0.02%的叠氮钠PBS液中备用。取有完整海马的脑片行IHC法染色,详见文献[7]。一抗抗体为Tau蛋白第404磷酸化位点抗体(pS404)(1 ∶100)。结束实验后再用中性树胶封片,显微镜下观察拍照。
1.7脑片尼氏染色(Nisslstaining) 取海马清楚的完整脑片置于16孔平板中。1×PBS洗涤3次,每次5 min。吸取适量尼氏染色液滴于脑片上,37℃染色10~15 min,ddH2O洗净,乙醇梯度脱水,二甲苯透明,最后中性树胶封片,显微镜下观察拍照。
1.8高尔基染色(Golgistaining) 水迷宫测试完后,上述同样药物麻醉,固定后,按参考文献方法[7]依次用冲洗液、固定液、媒染液体内灌流,灌流完毕后,取脑,切开两个半球,再横切成3等份。用新鲜媒染液泡3 d,每天更换新鲜媒染液。3 d后用1.5% AgNO3溶液在摇床里镀银,摇晃清洗3次,直至置换出的液体清亮,之后置于暗处镀银3 d,每日换新鲜的1.5% AgNO3溶液。在暗处配好2%重铬酸钾水溶液,把脑块置于其中切片,35~40 μm厚度,染色30 min,染色结束后用双蒸水清洗1 min×2次,贴片,脱水,透明,封片。
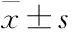
2 结果
2.1TTM对AD模型大鼠空间认知功能的影响Fig 1水迷宫实验结果发现,注射WT+GFX后,大鼠寻找平台的潜伏期与对照组相比均明显延长(P<0.01),表明该AD模型大鼠空间学习记忆力明显被抑制。而预先给予低、中、高剂量TTM可明显改善AD模型大鼠空间学习认知障碍(P<0.05),其逃避潜伏期明显缩短,并具有剂量依赖性(Fig 1A)。同时,TTM各治疗组大鼠其搜寻策略均明显改善,游泳轨迹接近直线(Fig 1B)。上述结果表明,不管是低、中剂量的TTM,还是高剂量的TTM均能有效改善WT+GFX激活GSK-3β活性所诱导的大鼠空间学习记忆障碍。
2.2TTM对AD模型大鼠脑海马组织中GSK-3β活性的影响Western blot结果显示(Fig 2A、2B),AD模型鼠脑海马中表示非活性状态的GSK-3β(GSK-3β第9位丝氨酸被磷酸化,即S9-GSK-3β)表达比对照组降低,其与总GSK-3β表达量的比值明显下降,差异具有统计学意义(P<0.05),表明造模成功。对比模型组,TTM低、中、高治疗组的S9-GSK-3β表达水平升高,其与总GSK-3β表达量的比值也升高,并差异具统计学意义(P<0.01)。结果表明,低、中、高剂量的TTM均能有效降低GSK-3β活性,且有剂量依赖性。同时检测了PKC、PI3K、Akt等的表达情况及其磷酸化水平,结果发现,TTM组的p-PKC、p-Akt磷酸化水平比模型组高,说明用药组PKC和Akt活性升高(Fig 2C、2D),这一结果提示,TTM能通过上调PKC和Akt活性,抑制下游GSK-3β的活性。
Fig 1 TTM prevents rats from WT+GFX induced spatial
A: TTM shortened the escape latency of WT+GFX injected SD rats in a dose-dependent manner; B: TTM improved the swimming pathway which was recorded 24 h after the injection of WT+GFX (after).**P<0.01vscontrol;##P<0.01vsbefore WT+GFX injection;ΔP<0.05vsafter WT+GFX injection.
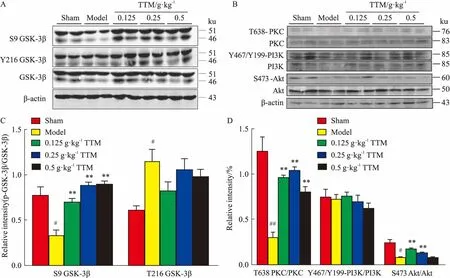
Fig 2 Effects of TTM on WT+GFX induced overactivation of
A: Western blot results showed the activity of GSK-3β in AD model group increased compared with blank group and TTM inhibited the high activity of GSK-3β induced by WT+GFX; B: TTM up-regulated the level of S9 GSK-3β phosphorylation and the results had statistical significance; C: Western blot results showed the activity of PKC and Akt in AD model group decreased compared with blank group and TTM increased the high activity of PKC and Akt induced by WT+GFX; D: TTM up-regulated the level of T636 PKC phosphorylation and S473 Akt phosphorylation and the results had statistical significance.#P<0.05,##P<0.01vscontrol(DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
2.3TTM对AD模型大鼠脑海马Tau蛋白磷酸化的影响为了研究TTM对海马Tau蛋白磷酸化的影响,分别进行WB和IHC实验。WB结果证明,AD模型组Tau蛋白pT205、pT231、pS356、pS396、pS404等5个位点磷酸化水平高于对照组,且差异有统计学意义(P<0.01,P<0.05)。TTM预处理后,Tau蛋白多个位点磷酸化水平下降,如pT205、pT231、pS356、pS396、pS404位点均下降,且差异有统计学意义(P<0.01和P<0.05),见Fig 3A、3B。结果表明,TTM对AD大鼠脑海马Tau蛋白磷酸化水平有明显下调作用。IHC主要观察各组海马区Tau蛋白第404丝氨酸位点磷酸化水平。结果发现,模型大鼠海马CA3和CA1区其Tau蛋白第404丝氨酸磷酸化水平明显高于阴性对照组。而TTM低、中剂量组,CA3和CA1区Tau蛋白404丝氨酸位点磷酸化水平明显改善(P<0.01,P<0.05)。这一结果和WB结果一致,见Fig 3C、3D。
2.4TTM对AD大鼠脑海马突触蛋白表达的影响Western blot结果发现,低、中、高剂量TTM均能有效促进AD大鼠的Synapsin-1、Synaptophysin、GluR-1等突触蛋白的表达,其中3个用药组Synapsin-1表达量均高于模型组(P<0.05),Synaptophysin的表达增多明显(P<0.01),二者具有剂量依赖性。3个用药组GluR-1表达量也明显增多(P<0.01),上述结果差异均具有统计学意义,见Fig 4A、4B。提示不同剂量的TTM可通过增加AD大鼠突触蛋白的表达,达到改善认知功能障碍的目的。
2.5尼氏染色法结果尼氏小体是显示神经细胞功能活性的一个重要指标,在神经元受到损害时,尼氏小体会从核周向外缓慢溶解,发展至完全消失,但该病变可逆。本实验结果发现,模型组脑海马CA1和CA3区神经元数量减少,着色较浅,胞体萎缩并呈空泡状,尼氏小体明显减少。但TTM中、高剂量组大鼠脑海马的CA1和CA3区尼氏小体数量增多,胞体饱满,着色较深,细胞核大圆,呈剂量依赖性。提示中、高剂量的TTM有助于修复AD大鼠神经元活性,促进神经发育(Fig 5A、5B)。
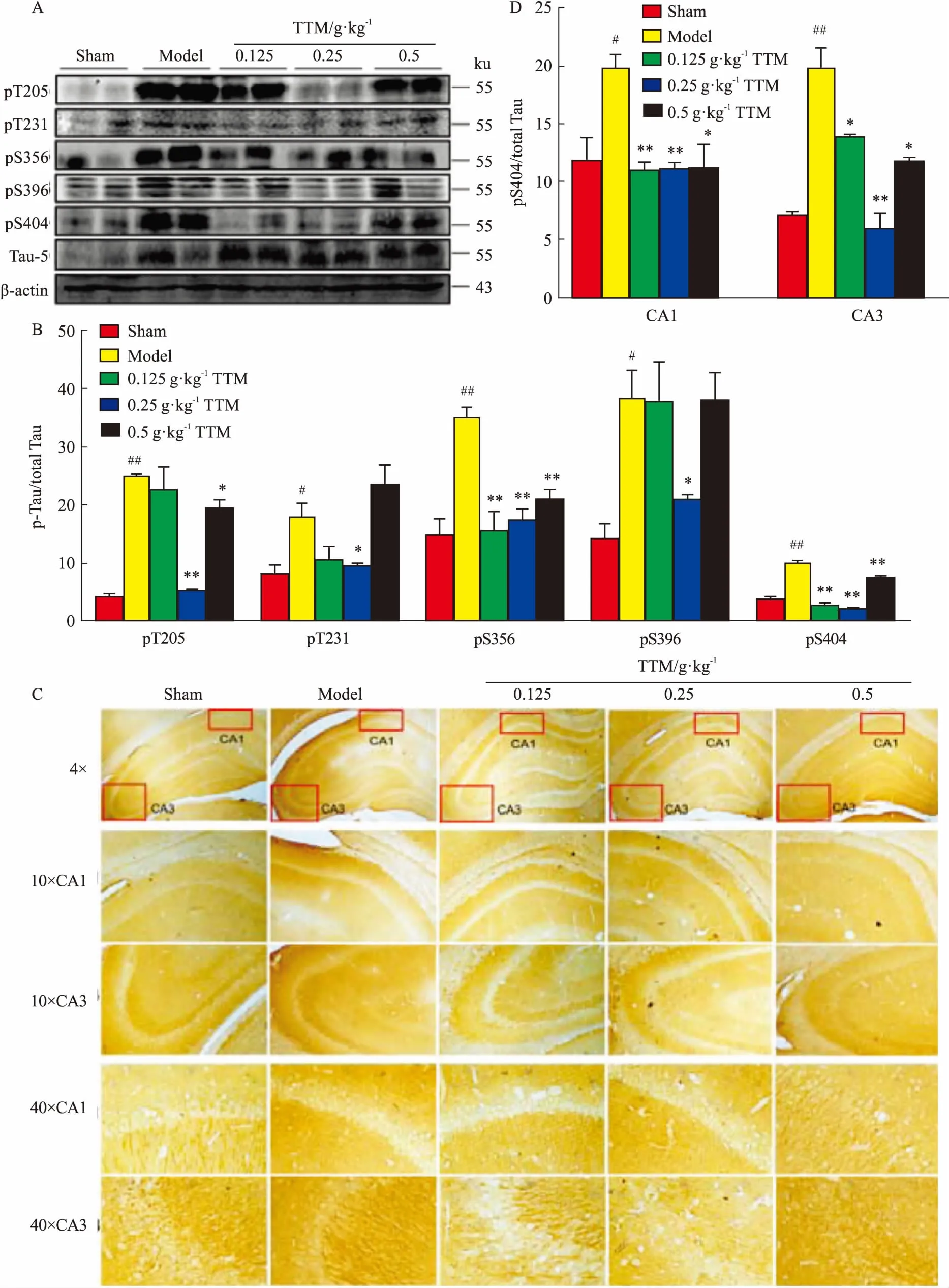
Fig 3 Effects of TTM on WT+GFX induced Tau hyperphosphorylation in SD rat
A: Western blot results showed the level of multiple phosphorylation sites of Tau in AD model group rat hippocampus was observably up-regulated than control group, which could be down-regualted by TTM; B: Western blot results of multiple phosphorylation sites of Tau had statistical significance; C: Immunohistochemistry results showed the level of Tau S404 phosphorylation in AD model group observably increased compared with control group in the area of CA1 and CA3, which could be decreased by TTM; D: The immunohistochemistry results of Tau S404 phosphorylation had statistical significance.#P<0.05,##P<0.01vscontrol (DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
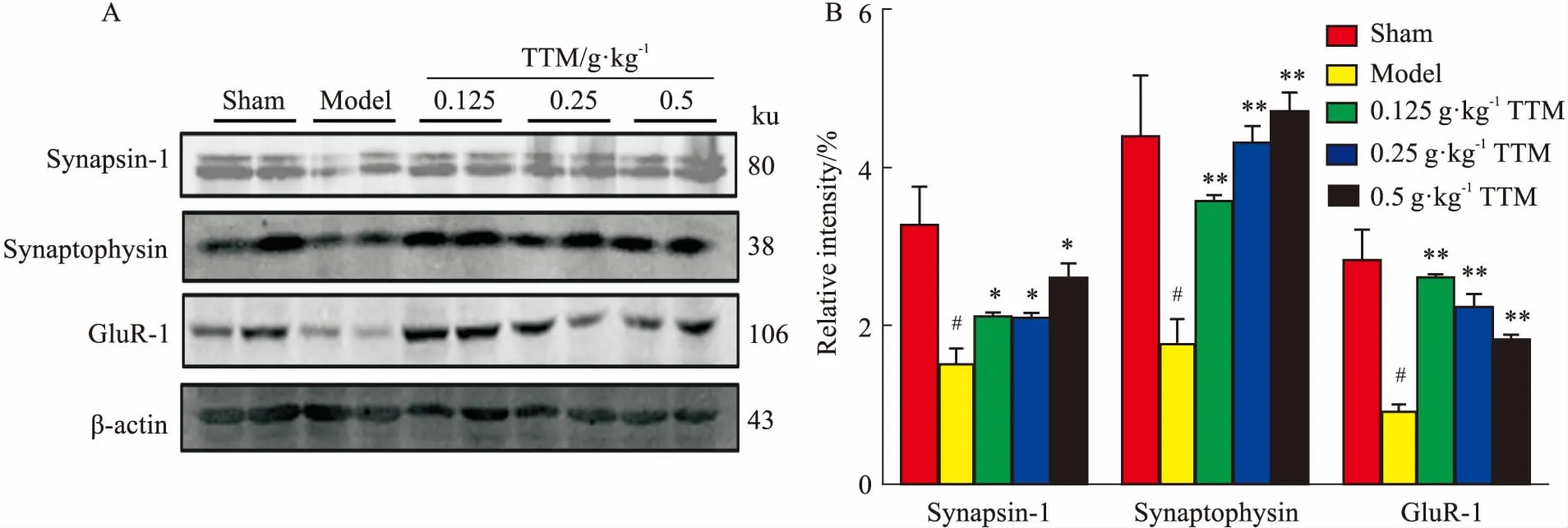
Fig 4 Effects of TTM on WT+GFX induced expression of
A: Western blot research showed the level of synapsin-1, synaptophysin and gluR-1 in AD model group rat hippocampas was down-regulated compared with blank group. Compared with AD model group, TTM up-regulated the level of synapsin-1, synaptophysin and gluR-1; B: TTM up-regulated the level of synapsin-1, synaptophysin and gluR-1 and results had statistical significance.#P<0.05vscontrol (DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
2.6TTM对AD大鼠海马神经元树突的影响与模型组相比,高尔基染色结果显示,TTM中、高剂量组CA1区锥体细胞的顶树突和基树突的分支数增多,差异有统计学意义(P<0.01),见Fig 6A、6B。而低、中、高剂量组DG区颗粒细胞中轴突长度明显增长,且树突分支数明显增多(P<0.01),见Fig 6C、6D。以上结果表明,中、高剂量TTM能明显增加AD大鼠脑海马CA1和DG区树突复杂性。另外,TTM中、高剂量组CA1区锥体细胞顶树突三级分支的树突棘密度明显增加(P<0.01),见Fig 6E;而在DG区颗粒细胞中3个用药组蘑菇型树突棘(Fig 6F、6G)密度明显高于模型组,且呈剂量依赖性(P<0.01),瘦长型小棘在中、高剂量组增加(P<0.01),见Fig 6H。结果表明,中、高剂量TTM明显改善AD大鼠海马区CA1和DG区树突棘密度,中剂量TTM促进瘦长型小棘发育,高剂量TTM对蘑菇型小棘和瘦长型小棘均有明显促进发育作用。
3 讨论
TTM作为土家族特色药材,具有镇静安神、活血化瘀等功效[5],对新生大鼠缺血/缺氧脑损伤具有保护作用[9]。本课题组前期研究发现,TTM对冈田酸 (okadaic acid, OA) 诱导的AD大鼠脑海马具有抗氧化作用[6],说明该药对AD防治具有潜在研究价值,有必要深入研究。同时很多文献证实,GSK-3β活性升高是产生NFT和SP的重要原因[6]。因此,有理由认为通过降低GSK-3β活性可成为治疗AD希望所在[10],但目前尚无特效药物,部分中药却有此作用[11],有必要在更广范围内寻找有效药物。因此,我们构建了过度激活GSK-3β的AD大鼠模型,利用PI3K特异性阻断剂Wortmannin和蛋白激酶C (PKC) 特异性抑制剂 (GF-109203X, GFX)行侧脑室注射,激活GSK-3β,并引起Tau蛋白异常过度磷酸化[8],然后探讨TTM能否通过这一途径治疗AD。
首先,水迷宫结果发现,注射WT+GFX导致大鼠空间认知功能下降,记忆力减退,而该模型大鼠运用低、中、高剂量TTM后,明显改善了其空间认知功能障碍和定向航行能力,此效应具有剂量依赖性。该结果表明,TTM在行为学方面能有效改善AD大鼠认知功能障碍。如前所述,GSK-3β活性升高是导致NFT和SP产生的重要原因,因此,我们首先通过WB检测了GSK-3β活性情况,结果发现,模型组大鼠脑海马内GSK-3β的S9位点磷酸化水平(S9-GSK-3β)下调,而该位点磷酸化水平代表GSK-3β非活性状态[6],TTM逆转了模型大鼠海马内GSK-3β的S9位点磷酸化水平。这一结果表明TTM能下调GSK-3β的活性。在GSK-3β信号通路中,其活性变化是由其上游激酶PKC、Akt和PI3K进行负性调节。因此,我们又检测了TTM用药后该3个激酶活性,结果显示,不同剂量的TTM均能上调注射了WT+GFX的大鼠脑海马组织中PKC 和Akt活性。这一结果提示TTM是通过上调PKC和Akt活性,进而抑制下游GSK-3β活性。由于Tau蛋白过度磷酸化在AD中是导致认知功能障碍的重要因素,而过度磷酸化的Tau蛋白对NTFs数量和分布影响及认知功能缺陷呈正相关[4-5]。因此,我们又研究了TTM能否通过改变GSK-3β活性,进而下调模型鼠脑海马Tau蛋白磷酸化水平。WB和IHC结果显示,预先给予低、中、高剂量TTM后,即使侧脑室注射WT+GFX,也能在脑海马的Tau蛋白多个磷酸化位点不同程度地抑制其磷酸化水平,说明TTM对Tau蛋白磷酸化具有防治作用。
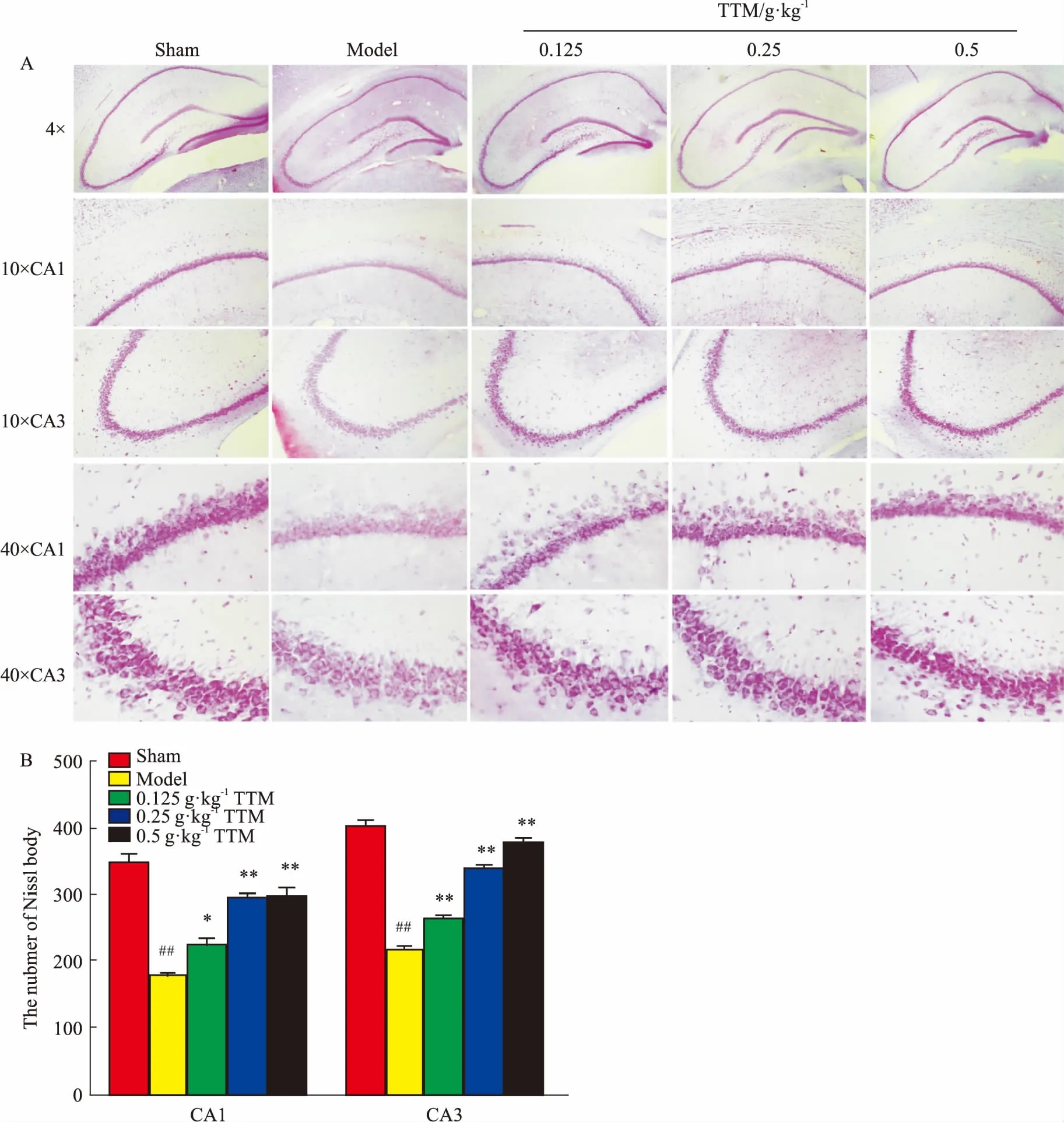
Fig5EffectsofTTMonWT+GFXinducedNisslbodiesdecreasedinSDrat
A:Nissl’s staining results showed the number of Nissl’s bodies in neuron cells of hippocampus on hippocampal CA1 and CA3 was obviously fewer than those in control group, which could be markedly increased by TTM; B: Nissl’s staining results of the number of Nissl’s bodies had statistical significance.##P<0.01vscontrol (DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
突触是传递信息的重要组织结构,突触互相交叉形成大脑信息网络,突触蛋白的表达对学习记忆有密切联系。有研究表明,AD患者脑海马中突触相关蛋白明显减少[12]。本实验结果发现,模型组大鼠脑海马突触相关蛋白Synapsin-1、Synaptophysin和GluR-1表达明显减少,而TTM用药组的Synapsin-1、Synaptophysin和GluR-1蛋白表达比模型组明显增加,提示TTM能恢复或保护突触结构与功能从而改善学习记忆能力。
在细胞质中有特别的细胞器—尼氏小体。尼氏小体又称核蛋白体,是合成蛋白质的场所。当神经元受损时,尼氏小体会减少甚至消失,这种病理改变是可逆的[13]。本实验结果发现,各剂量TTM均能恢复或保护尼氏小体,其中又以中、高剂量组为甚,提示TTM能通过作用于尼氏小体来修复或改善大鼠海马受损的神经元。
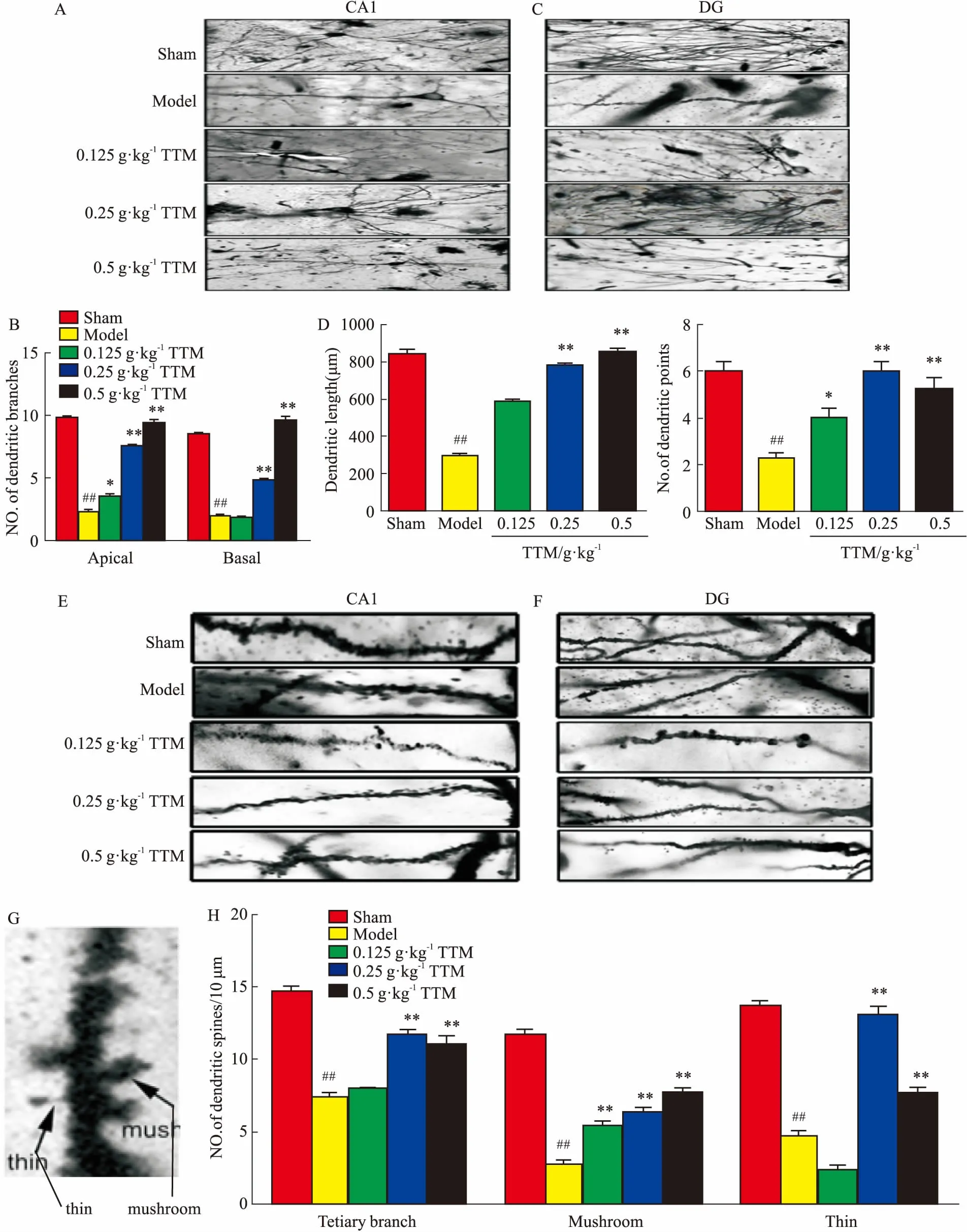
Fig 6 Effects of TTM on WT+GFX induced dendritic spines decreased in SD rat
A: Golgi staining results showed that the number of apical dendrites and radical dendrites on hippocampal CA1 and DG was obviously less than that in blank group, which could be markedly increased by TTM; B: Golgi staining results of the number of apical dendrites and radical dendrites had statistical significance; C: Golgi staining results showed the length axons and dendritic branches on hippocampal DG was obviously shorter and less than that in blank group, and TTM markedly lengthed axons and increased dendritic branch; D: Golgi staining results of the length axons and dendritic branches had statistical significance; E, F and G: Golgi staining results showed the dendritic spine density in hippocampus on hippocampal CA1 was apparently less than in blank group, the mushroom and slender (thin) dendritic spines density on hippocampus CA1 and DG was apparently less than in blank group, which could be dramatically increased by TTM; H: Golgi staining results of the dendritic spines density and the mushroom and slender (thin) dendritic spines density had statistical significance;##P<0.01vscontrol(DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
树突是由胞体发出,由一支发叉分出多支,表面伸出许多小突起称为小棘,在AD患者大脑海马中树突分支和树突棘均减少,导致接受刺激减少,引起学习记忆功能障碍[14]。在本实验中我们发现,AD大鼠海马中CA1和DG区运用中、高剂量TTM后,其树突复杂性明显增高,说明TTM能促进树突发育。小棘又分成很多类型,有瘦长型、蘑菇型、豆芽型等,一般把蘑菇型称为记忆性小棘,瘦长型称为学习型小棘[15],目前广泛认为蘑菇型小棘对学习记忆有较大的促进作用,有研究发现,瘦长型小棘对学习记忆的促进作用比蘑菇型更有效、更稳定[15]。本实验Golgi染色结果显示中、高剂量TTM明显增加CA1和DG区树突棘数量,中剂量组瘦长型树突小棘增加更明显,而高剂量组蘑菇型增加更明显,可能不同剂量的药物对不同类型的小棘影响各异,但均能改善树突可塑性。
综上所述,本实验众多结果提示,TTM对GSK-3β诱导的AD模型大鼠脑海马组织中Tau蛋白磷酸化、神经发育及突触相关蛋白表达等方面均有明显的防治作用,同时还可促进海马组织内树突发育的复杂性和尼氏体修复,最终达到改善AD模型大鼠学习记忆功能。这些发现为AD治疗提供一种新的药物选择,也可为TTM的开发利用提供实验依据和基础资料。
[1] Hottman D A, Li L. Protein prenylation and synaptic plasticity: implications for Alzheimer's disease[J].MolNeurobiol, 2014,50(1):177-85.
[2] Revett T J, Baker G B, Jhamandas J, et al. Glutamate system, amyloid β peptides and Tau protein: functional interrelationships and relevance to Alzheimer disease pathology[J].JPsychiatryNeurosci, 2013,38(1):6-23.
[3] Khan S S, Bloom G S. Tau: the center of a signaling nexus in Alzheimer's disease[J].FrontNeurosci, 2016,10(1):31.
[4] Takashima A. GSK-3 is essential in the pathogenesis of Alzheimer’s disease [J].JAlzheimersDis, 2006,9(3 Suppl): 309-17.
[5] 方志先,赵 晖,赵敬华. 土家族药物志“上册”[M]. 北京:中国医药科技出版社, 2007:371-2.
[5] Fang X Z, Zhao H, Zhao J H. Tujia Nationality Medicine Record, 1st volume[M]. Beijing: The Medicine Science and Technology Press of China, 2007:371-2.
[6] 黄丽亚,罗洪斌,张 宏. 头顶一颗珠对岗田酸致阿尔茨海默病大鼠脑组织抗氧化酶和过氧化脂质的影响[J]. 中国老年学杂志,2008,28(18):1771-2.
[6] Huang L Y, Luo H B, Zhang H, et a1. The effect of' TTM on anti-oxidase and lipase peroxide in brain tissues of Alzheimer disease rats induced by okadiac acid[J].ChinJGerontol, 2008,28(18): 1771-2.
[7] 姜 霞,王建枝. L-肉毒碱在Alzheimer样Tau蛋白过度磷酸化和空间记忆障碍中的保护作用[D]. 武汉:华中科技大学,2008.
[7] Jiang X. Effect of L-carnitine on Alzheimer-like Tau hyperphosphorylation and spatial memory retention deficits[D]. Wuhan: Huazhong University of Science and Technology(HUST),2008.
[8] 王建枝. 一种早老性痴呆大鼠动物模型的构建方法[P]. 2005-07-13.
[8] Wang J Z. The method for constructing rat model of Alzheimer's disease[P]. July 13, 2005.
[9] 邱 勇,李人鹏,刘 粟,等. 头顶一颗珠醇提物对新生大鼠缺血/缺氧性脑损伤的保护作用[J]. 中国药理学通报, 2016,32(11):1548-52.
[9] Qiu Y, Li R P, Liu S, et al. The protective effects of ethanol extract of Trillium tschonoskii Maxim. On hypoxia-ischemia brain damage in neonatal rats[J].ChinPharmacolBull, 2016,32(11):1548-52.
[10] King M K, Pardo M, Cheng Y, et al. Glycogen synthase kinase-3 inhibitors: rescuers of cognitive impairments[J].PharmacolTher, 2014,141(1): 1-12.
[11] 罗洪斌,刘翔宇,牟南樵,等. 板桥党参对激活GSK-3β诱导的AD模型大鼠认知功能障碍的保护作用及其机制[J]. 中国药理学通报, 2017,33(8):1060-7.
[11] Luo H B,Liu X Y,Mou N Q. Banqiao Codonopisis Pilosula improving cognitive dysfunction induced by high GSK-3β activity and its possible mechanism [J].ChinPharmacolBull, 2017,33(8): 1060-7.
[12] Salgado-Puga K, Rodriguez-Colorado J, Prado-Alcala R A, et al. Subclinical doses of ATP-sensitive potassium channel modulators prevent alterations in memory and synaptic plasticity induced by amyloid-β[J].JAlzheimersDis, 2017,57(1): 205-26.
[13] Roof R L, Schielke G P, Ren X, et al. A comparison of long-term functional outcome after 2 middle cerebral artery occlusion models in rats[J].Stroke, 2001,32(11): 2648-57.
[14] Tronel S, Fabre A, Charrier V, et al. Spatial learning sculpts the dendritic arbor of adult-born hippocampal neurons[J].ProcNatlAcadSciUSA, 2010,107(17): 7963-8.
[15] Spacek J, Harris K M. Three-dimensional organization of smooth endoplasmic reticulum in hippocampal CA1 dendrites and dendritic spines of the immature and mature rat[J].JNeurosci, 1997,17(1):190-203.

