黄芩素对大鼠胰岛素分泌的作用及机制研究
郭阳艳,刘萌萌,杨晓华,任乐乐,刘志宏,刘云峰,章 毅
(山西医科大学 1. 基础医学院药理学教研室、2. 第一医院内分泌科,山西 太原 030001)
糖尿病是多种病因引起的以慢性、渐进性血糖升高为主要特征的代谢性、内分泌疾病。除了血糖升高,糖尿病引起各种营养物质的代谢紊乱,随着疾病发展引起全身慢性并发症[1]。各种治疗糖尿病的方法与药物层出不穷,但截止目前糖尿病依然不可治愈,如何更好地治疗依然是科研界与临床的难题。
黄芩为唇形科植物黄芩的干燥根,是我国的传统中药。黄芩素(baicalein)是黄芩中含量最高的黄酮类化合物之一,也是发挥药效的主要活性成分[2],可以特异性抑制12-脂氧合酶[3]。黄芩素具有抗炎[4]、抗病毒、抗肿瘤[5]、护肝[6]、清除自由基、保护神经等广泛作用。近年来,随着国内外学者对黄芩素研究的逐渐深入,已经证实黄芩素通过清除自由基和抗氧化[7]、降低血压及血脂、抑制蛋白激酶C的激活、抑制α-葡萄糖苷酶活性[8]、调节炎症细胞因子[9]、保护β细胞功能[10]等,发挥降低血糖及抗糖尿病作用,但关于离子通道的研究甚少。本研究旨在通过胰岛素分泌实验、钙成像技术、膜片钳技术,探讨黄芩素促进大鼠胰岛素分泌的离子通道机制。
1 材料与方法
1.1材料
1.1.1实验动物 Wistar大鼠,♂,体质量180~250 g,由中国人民解放军军事医学科学院实验动物中心提供。生产许可证号:SCXK-(军)2012-0004。
1.1.2试剂 黄芩素(批号:491-67-8)、Histopaque 1077(批号:RNBF1783),均购自美国Sigma公司;胶原酶P(瑞士Roche,批号:11104222); RPMI 1640 培养基(批号: C518FA0002)、胎牛血清(批号:B326FA0092),均购自上海生工;D-葡萄糖(批号:405A0918)、BSA(批号:83100513)均购自北京索莱宝;Dispase II (美国Amresco, 批号:10888700);胰岛素检测试剂盒(北京北方生物技术研究所,批号:20160320)。
1.1.3仪器 体式显微镜(上海中恒,型号:SM262);细胞培养箱(北京博奥恒信生物科技,型号:HF100);倒置显微镜(日本Olympus,型号:AE-2000);台式离心机(长沙湘仪,型号:SC-3610);MODEL电极拉制仪(日本Narishige,型号PP-830);MIRO FORGE抛光仪(日本Narishige,型号:MF-200);EPC10 全自动膜片钳(德国HEKA,型号:MP-285);钙成像(北京MDE,型号:LAMBDA 10-B)。
1.2方法
1.2.1获取Wistar大鼠的胰岛及胰岛β细胞 快速处死大鼠,无菌条件下剖开腹腔,从胆总管逆行注入1 g·L-1胶原酶,完整剥取大鼠的胰腺组织,38℃水浴消化11 min,加入Histopaque 1077分离液梯度离心后,体式显微镜下手工挑取边缘整齐、透光率小,直径大小在100~300 μm的单个胰岛,并将其放入37℃、5% CO2的孵箱中培育[11]。用3 g·L-1的Dispase II 溶液消化培育状态好的大鼠胰岛,孵箱内消化5 min后,取出加入RPMI 1640培养基(含胎牛血清),离心2 min后弃去上清液,将沉淀混匀后,滴在用细胞黏附剂处理过的5 mm×5 mm玻片上,将玻片置于RPMI 1640培养基(含胎牛血清)中,放入37℃、5% CO2的孵箱中培育。
1.2.2胰岛素分泌实验 实验分为5组,分别为2.8 mmol·L-1葡萄糖(低糖)、16.7 mmol·L-1葡萄糖(高糖)、16.7 mmol·L-1葡萄糖+20 μmol·L-1黄芩素、16.7 mmol·L-1葡萄糖+50 μmol·L-1黄芩素、16.7 mmol·L-1葡萄糖+100 μmol·L-1黄芩素,每组7个EP管,35个EP管内各加入含2.8 mmol·L-1葡萄糖的KRBH孵育液800 μL,每个EP管内挑取5个胰岛,于37℃、5% CO2的孵箱中孵育30 min。KRBH孵育液各成分浓度(mmol·L-1):128.8 NaCl、4.8 KCl、1.2 KH2PO4、1.2 MgSO4、2.5 CaCl2·2H2O、10 HEPES、5 NaHCO3,pH 7.4。每100 mL KRBH中加入2 g BSA。30 min后取出所有EP管,弃去上清液,每组分别加入500 μL的2.8 mmol·L-1葡萄糖、16.7 mmol·L-1葡萄糖及含不同浓度黄芩素(20、50、100 μmol·L-1)的高糖KRBH,继续于孵箱中孵育30 min后取出,取上清液,用放免法检测胰岛素含量。
1.2.3钙成像实验 将细胞置于含2 μmol·L-1Fura-2AM(Ca2+荧光探针,也称染液)和2.8 mmol·L-1葡萄糖的KRBH孵育液中,37℃、5% CO2孵箱中避光孵育30 min后取出,用含2.8 mmol·L-1葡萄糖的KRBH洗去染液,将载有细胞的玻片置于激光共聚焦显微镜上,用8通道给药系统持续分别给予16.7 mmol·L-1葡萄糖、含50 μmol·L-1黄芩素的高糖KRBH及60 mmol·L-1KCl。设定激发光340 nm和380 nnm,发射光510 nm,得到F340/F380,此比值反映细胞内Ca2+浓度变化。
1.2.4膜片钳实验 配制电极内、外液。电极外液各成分浓度(mmol·L-1):138 NaCl、5.6 KCl、1.2 MgCl2·6H2O、2.6 CaCl2、5 HEPES,pH 7.4。电极内液各成分浓度(mmol·L-1):140 KCl、1 MgCl2·6H2O、0.05 EGTA、10 NaCl、10 HEPES、0.3 Mg-ATP,pH 7.4。PP-830电极拉制仪拉制玻璃电极,充灌电极内液后电阻大小为4~7 MΩ,将孵育好的细胞浸在含11.1 mmol·L-1葡萄糖及含11.1 mmol·L-1葡萄糖和不同药物浓度的电极外液中。选取细胞膜电容>7PF的细胞(视为β细胞[12]),电极尖端与细胞膜片之间形成高阻封接(电阻≥GΩ)后,将电压钳制在-70 mV,给予-70~80 mV的电压刺激400 ms,负压破膜,全细胞记录模式下记录Kv电流。
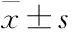
2 结果
2.1黄芩素对大鼠胰岛素分泌的影响实验分组如下:2.8 mmol·L-1葡萄糖(2.8G)、16.7 mmol·L-1葡萄糖(16.7G)作为对照、在16.7G前提下加入不同浓度的黄芩素。如Fig 1所示,20、50 μmol·L-1黄芩素呈浓度梯度性促进胰岛素分泌,100 μmol·L-1的黄芩素没有进一步促进分泌。实验表明,黄芩素可以促进胰岛素的分泌,其体外促进大鼠胰岛素分泌的最佳药物浓度是50 μmol·L-1。
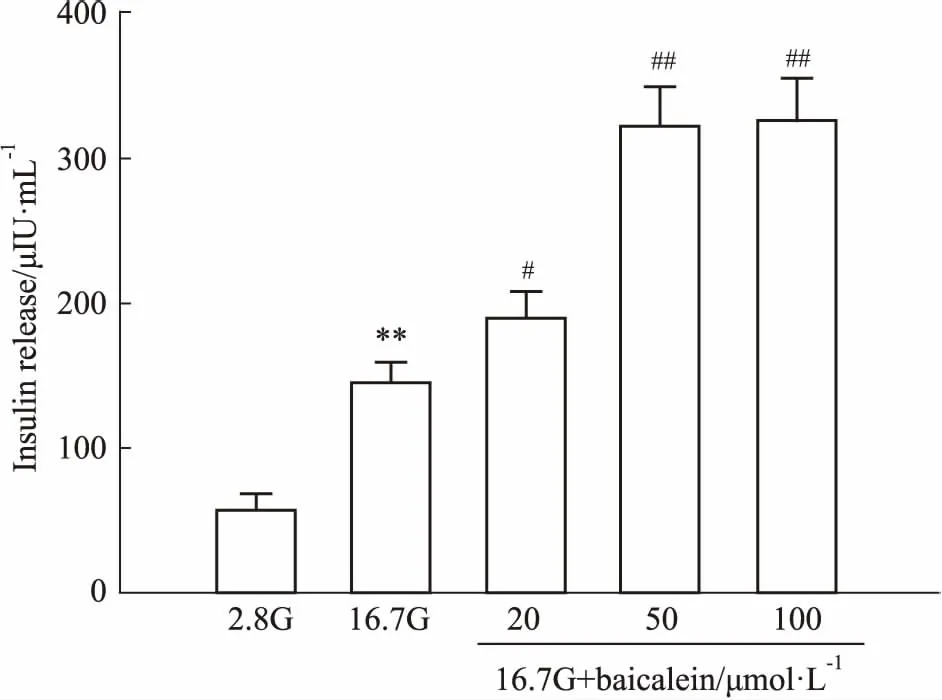
Fig 1 Effects of baicalein on insulin secretion of rat islets(n=7)
Rat islets were incubated in KRB buffer with 2.8 mmol·L-1glucose or 16.7 mmol·L-1glucose or different concentrations of baicalein for 30 min. Insulin secreted into supernatant was measured by ELISA.**P<0.01vs2.8G;#P<0.05,##P<0.01vs16.7G.
2.2黄芩素对细胞内Ca2+浓度([Ca2+]i)影响选取最佳促进胰岛素分泌浓度,分别用16.7 mmol·L-1葡萄糖、50 μmol·L-1黄芩素、60 mmol·L-1氯化钾干预胰岛β细胞,F340/F380反映细胞内[Ca2+]i。Fig 2结果表明,50 μmol·L-1黄芩素干预细胞后,细胞内[Ca2+]i较16.7 mmol·L-1葡萄糖干预时升高,差异且具有统计学意义(P<0.01)。结果表明,黄芩素可以提高细胞内[Ca2+]i。
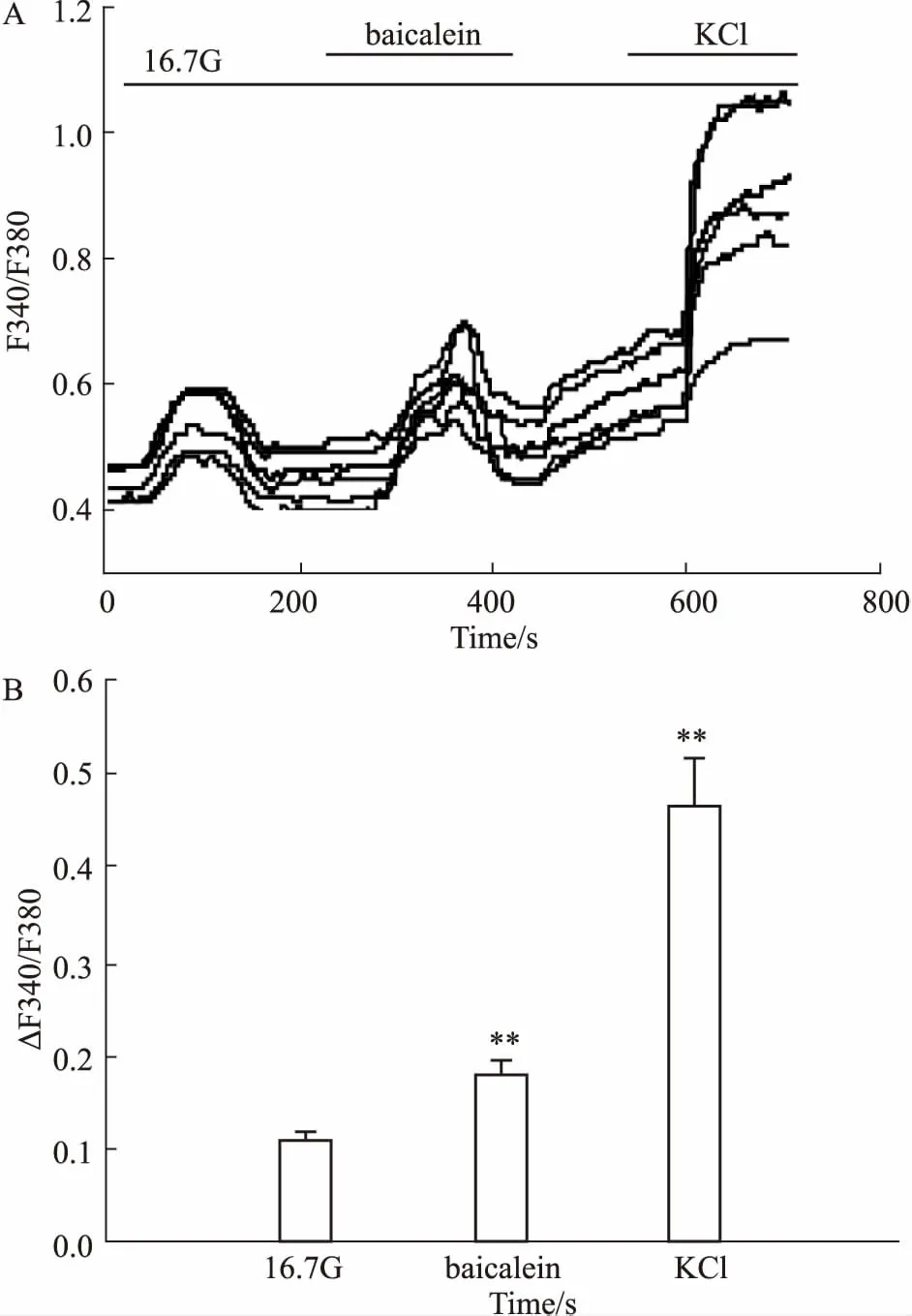
Fig 2 Effect of baicalein on intracellular [Ca2+]i levels(n=6)
A: The radio of F340/F380 reflected intracellular [Ca2+]ilevels. β-cells were treated with 16.7 mmol·L-1glucose or 50 μmol·L-1baicalein or 60 mmol·L-1KCl intervention, 60 mmol·L-1KCl intervention was treated as positive control; B: Bar graph using the mean of the radio of ΔF340/F380.**P<0.01vs16.7G.
2.3黄芩素对β细胞Kv通道的影响分别用含11.1 mmol·L-1葡萄糖的电极外液及不同药物浓度的电极外液干预细胞,含11.1 mmol·L-1葡萄糖的电极外液干预的细胞作为对照组,分别经过高阻封接、钳制电压、破膜后,全细胞模式下记录Kv电流。Fig 3结果表明,与对照组相比,20 μmol·L-1黄芩素抑制了Kv电流,50 μmol·L-1黄芩素进一步抑制β细胞Kv。实验表明,黄芩素可以浓度梯度性抑制β细胞Kv电流。
3 讨论
糖尿病的主要特征是胰岛β细胞功能缺陷和胰岛素发挥作用障碍[1],因此,促进胰岛β细胞分泌功能、改善胰岛素抵抗可以有效治疗糖尿病。黄芩素是从传统中药黄芩的干燥根里提取的黄酮类化合物,近年来由于其广泛的药理学作用而受到大量关注。国内外研究证实,黄芩素具有抗糖尿病及改善糖尿病并发症预后的作用。黄芩素可以通过减轻INS-1细胞炎症损伤促进胰岛素分泌[7],通过PI3K/Akt/GSK3β信号通路改善糖尿病大鼠相关的认知障碍,通过减轻新陈代谢紊乱[13]治疗糖尿病等,但黄芩素抗糖尿病的离子通道机制尚不清楚。
现有的研究证实,胰岛素是人体内唯一可以降低血糖的激素,由胰岛β细胞分泌。胰岛β细胞是可兴奋细胞,刺激后分泌的胰岛素与其细胞膜上离子通道的活动密切相关。胰岛β细胞上主要的离子通道包括ATP敏感性钾通道(KATP)、电压依赖性钾通道(Kv)和电压门控性钙通道(voltage-gated calcium channel,VDCC)。葡萄糖是刺激胰岛素分泌的主要因素,其进入细胞经过糖酵解和氧化磷酸化生成ATP,细胞内ATP/ADP比例升高使KATP通道关闭,细胞动作电位去极化。当动作电位去极化到一定程度时,电压门控性钙通道开放,细胞外Ca2+内流,使细胞内Ca2+浓度升高,促发胰岛素囊泡的运动、与细胞膜融合释放胰岛素。当细胞膜电位去极化到一定程度后,Kv开放,细胞内K+外流,细胞动作电位复极化,分泌活动停止[14]。
在本研究中,关于胰岛素分泌功能的实验证实,高糖情况下,黄芩素呈浓度梯度依赖性的方式促进胰岛素分泌,其体外实验最佳药物浓度为50 μmol·L-1。β细胞分泌功能与细胞内钙离子浓度成正比[14],我们通过钙成像实验得到细胞内Ca2+浓度变化,研究黄芩素促进分泌的作用与细胞内钙离子浓度的关系。本实验钙成像结果显示,用黄芩素50 μmol·L-1干预胰岛β细胞,细胞内Ca2+浓度上升,且差异具有统计学意义。因此推断,黄芩素促进分泌的作用是通过升高细胞内钙离子浓度产生的。参与β细胞分泌活动的离子通道Kv参与β细胞动作电位的复极化,抑制Kv通道可以减少细胞内K+外流,延长动作电位,使β细胞动作电位复极化过程减慢,从而延长分泌活动的时间,促进分泌。我们运用全细胞膜片钳技术研究不同浓度黄芩素(20、50 μmol·L-1)的促进分泌作用与Kv通道的关系。实验结果表明,黄芩素呈浓度梯度依赖性的方式抑制Kv电流。因此,黄芩素可以通过抑制Kv通道,延长动作电位促进分泌。
综上所述,本实验通过胰岛素分泌实验、钙成像技术、膜片钳技术,从不同的角度阐明了黄芩素可以促进大鼠胰岛素分泌功能,即通过抑制胰岛β细胞Kv通道,增加细胞内钙离子的浓度,从而进一步增加胰岛素的分泌。胰岛素分泌过程中KATP通道的关闭也是其中一个重要环节[14],黄芩素是否对KATP通道和VDCC通道有作用,以及各离子通道之间的联系尚有待进一步的研究。
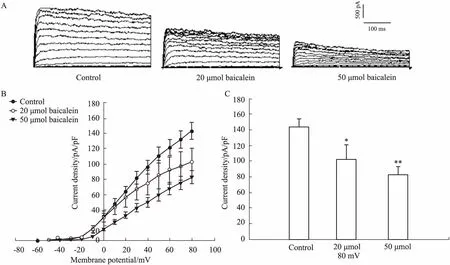
Fig 3 Effects of baicalein on Kv channels(n=6)
A: Representative Kv current traces under different concentrations of baicalein; B: Current-voltage relationship curves of different concentrations of baicalein on Kv channels from rat β cells; C: Bar graph using summary of the mean current density of Kv channels recorder at 80mV depolarization.*P<0.05,**P<0.01vscontrol.
[1] 周庆峰. 细胞因子类抗糖尿病药物研究进展[J]. 中国药理学通报, 2016,32(6):760-3.
[1] Zhou Q F. Research progress in anti-diabetic drugs of cytokine[J].ChinPharmacolBull, 2016,32(6):760-3.
[2] 田 硕, 洪 涛, 张 多, 等. 黄芩素的药理作用及分子机制的最新研究进展[J]. 黑龙江医药, 2015,28(6):1195-9.
[2] Tian S, Hong T, Zhang D, et al. Recent advances in pharmacological effects and molecular mechanisms of baicalein[J].HeilongjiangMedPharm, 2015,28(6):1195-9.
[3] Deschamps J D, Kenyon V A, Holman T R. Baicalein is a potentinvitroinhibitor against both reticulocyte 15-human and platelet 12-human lipoxygenases[J].BioorgMedChem, 2006,14(12):4295-301.
[4] Zhao Q, Chen X, Martin C. Scutellaria baicalensis, the golden herb from the garden of Chinese medicinal plants[J].SciBull(Beijing), 2016,61(18):1391-8.
[5] Yu M L, Qi B Q, Wu X X, et al. Baicalein increases cisplatin sensitivity of A549 lung adenocarcinoma cells via PI3K/Akt/NF-κB pathway[J].BiomedPharmacother, 2017,90:677-85.
[6] Huang H, Wang Y, Zhang Q, et al. Hepatoprotective effects of baicalein against CCl4-induced acute liver injury in mice[J].WorldJGastroenterol, 2012,18(45):6605-13.
[7] Kwak H J, Yang D, Hwang Y, et al. Baicalein protects rat insulinoma INS-1 cells from palmitate-induced lipotoxicity by inducing HO-1[J].PLoSOne, 2017,12(4):e0176432.
[8] Yang J R, Luo J G, Kong L Y. Determination of α-glucosidase inhibitors from Scutellaria baicalensis using liquid chromatography with quadrupole time of flight tandem mass spectrometry coupled with centrifugal ultrafiltration[J].ChinJNatMed, 2015,13(3):208-14.
[9] Chen M, Yang Z D, Smith K M, et al. Activation of 12-lipoxygenase in proinflammatory cytokine-mediated beta cell toxicity[J].Diabetologia, 2005,48(3):486-95.
[10] Fu Y, Luo J, Jia Z, et al. Baicalein protects against type 2 diabetes via promoting islet β-cell function in obese diabetic mice[J].IntJEndocrinol, 2014,2014:846742.
[11] 李小东, 郭 庆, 高璟英, 等. 原代大鼠胰岛的分离纯化及功能鉴定[J]. 中西医结合心脑血管病杂志, 2014,12(3):345-6.
[11] Li X D, Guo Q, Gao J Y, et al. Separation purification and functional identification of pancreatic islets in the original rats [J].CardiovascDisJIntegrTraditChinWestMed, 2014,12(3):345-6.
[12] Zhang Y, Ding Y Y, Zhong X Y, et al. Geniposide acutely stimulates insulin secretion in pancreatic β-cells by regulating GLP-1 receptor/cAMP signaling and ion channels[J].MolCellEndocrinol, 2016,430:89-96.
[13] Pu P, Wang X A, Salim M, et al. Baicalein, a natural product, selectively activating AMPKα(2) and ameliorates metabolic disorder in diet-induced mice[J].MolCellEndocrinol, 2012,362(1-2):128-38.
[14] 娄雪林, 徐 涛, 周 专. 胰腺β细胞的离子通道和胰岛素分泌[J]. 生命的学, 2001,21(2):150-2.
[14] Lou X L, Xu T, Zhou Z. The ion channels and insulin secretion of beta cells of pancreatic beta cells[J].ChemistryLife, 2001,21(2): 150-2.

