虫草素对MPTP诱导的小鼠多巴胺能神经元损伤的保护作用及其机制
樊逸云,唐培宸,顾欣霞,张 鑫,孙 莹,余伯成,张晓燕,葛晓群
(1. 扬州大学医学院药理学教研室,江苏 扬州 225001;2. 上海国宝企业发展中心,上海 201203)
帕金森病(Parkinson’s disease,PD)是一种中枢神经系统退行性疾病,其主要特征是中脑黑质致密部(substantia nigra pars compacta,SNpc)多巴胺(dopamine,DA)能神经元变性死亡,最终导致DA含量降低[1]。其发病机制十分复杂,与细胞凋亡关系密切[2]。目前,临床治疗的药物主要缓解患者症状,难以从根本上抑制DA能神经元的渐进性丢失[3],因此,寻找能够阻止PD病程的神经保护剂意义重大。
虫草素(cordycepin,Cor)是从蛹虫草中分离的一种核苷类化合物,具有广泛的药理活性,然而,其对PD的影响报道甚少。Olatunji等[4]和本课题组[5-6]前期研究发现,Cor可抑制PD模型PC12细胞的损伤和凋亡。然而,Cor是通过何种信号转导通路介导了这一效应,以及能否在动物体内发挥对DA能神经元的保护作用,目前尚未见该方面的研究报道。
多条信号转导通路参与介导了PD黑质DA能神经元的凋亡[7],其中,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号转导通路发挥了重要作用。体外研究发现,激活JNK通路可引起DA神经元凋亡[8],在PD患者脑组织中亦发现p38通路明显活化[9],中脑黑质部有p-ERK1/2的积聚[10]。为此,本研究利用1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)制备PD小鼠模型,观察Cor对中脑黑质DA能神经元及MAPK信号通路的影响,以进一步探讨其神经保护作用及机制,为探索PD治疗新靶点提供依据,为Cor作为神经保护剂的临床应用提供实验基础。
1 材料
1.1实验动物50只C57BL/6小鼠,♂,体质量(20±2)g,购于扬州大学实验动物中心,实验动物生产许可证:SCXK(苏)2012-0004,使用许可证号:SYXK(苏)2012-0029。小鼠饲养于温度为(20±2)℃、相对湿度(60±10)% 的动物房,自由进食水,12 h/12 h光照周期。
1.2药物与试剂虫草素(纯度99%,上海国宝企业发展中心);MPTP(东京化成工业株式会社);DA、二羟苯乙酸(DOPAC)和 高香草酸(HVA)标准品(美国Sigma公司);TUNEL法细胞凋亡检测试剂盒、HRP标记的二抗(博士德生物工程有限公司);抗TH、p-p38、p-ERK1/2抗体(美国Abcam公司);抗JNK1/2和p-JNK1/2抗体(上海生工生物工程有限公司);抗Bax、Bcl-2、Cleaved caspase-3、p38、ERK1/2、GAPDH抗体(万类生物科技有限公司);β-actin抗体(北京博奥森生物技术科技有限公司)。
1.3仪器大小鼠转棒疲劳测试仪、旷场实验箱、Super Maze+高通量动物行为实验分析系统(上海欣软信息科技有限公司);Nikon80i正置显微镜(日本Nikon公司);Multiskan FC型酶标仪(美国Thermo公司);5415R型冷冻离心机(德国Eppendorf公司);电泳仪(美国Bio-Rad公司);Tanon 5200全自动化学发光成像系统(上海天能科技有限公司)。
2 方法
2.1实验分组及给药50只小鼠,随机分为5组,每组10只。分别为:正常对照组、模型组(MPTP组)、Cor低、中、高剂量组(2.5、5.0、10.0 mg·kg-1)。Cor用生理盐水溶解,给药剂量由预实验确定,灌胃给药。MPTP(30 mg·kg-1)溶于生理盐水,腹腔注射给药[11]。对照组d 1~15灌胃生理盐水,d 4~8注射生理盐水;模型组d 1~15灌胃生理盐水,d 4~8注射MPTP;Cor组d 1~15分别灌胃不同浓度Cor,d 4~8注射MPTP。末次给药结束后,d 2进行小鼠行为学检测。
2.2行为学检测
2.2.1旷场实验 实验前2 h,将小鼠从动物饲养室移至行为学检测实验室,让其适应实验室环境。实验开始时,将动物放于50 cm×50 cm × 25 cm的旷场内,让其自由活动10 min,记录小鼠的运动轨迹和运动距离。
2.2.2转棒实验 小鼠实验前训练3 d,疲劳转棒仪直径为3 cm,每只小鼠每天训练300 s。正式实验时转速设定300 s内,由4 r·min-1逐渐加速到40 r·min-1,记录小鼠从转轴上跌落的潜伏期。每只重复3次,每次间隔30 min,取平均值。
2.2.3爬杆实验 木杆长50 cm,直径1 cm,顶端固定有直径2.5 cm的木球,木杆缠纱布以防打滑,记录小鼠在球上停留的时间(T1),以及小鼠从小球底端爬到杆的底部所需要的时间(T2)。每只重复3次,每次间隔3 min,取平均值。
2.3HPLC-ECD法检测纹状体DA及其代谢产物含量行为学测定结束后,每组取6只小鼠,断头取脑,在冰上迅速取出同一侧纹状体称重,每1 mg组织加10 μL匀浆液,超声匀浆。于4℃、20 000 r·min-1离心20 min,取上清液,-80℃保存备用。HPLC-ECD检测纹状体组织中DA、DOPAC、HVA的含量。
2.4免疫组织化学法检测TH阳性细胞行为学测定结束后,每组取3只小鼠,麻醉后用4%多聚甲醛心脏灌流,断头取脑,放入4%的多聚甲醛中继续固定,之后常规石蜡包埋。根据小鼠脑立体定位图谱进行冠状连续切片,片厚4 μm,切片分组收集。采用免疫组化SABC法,在光镜下对SNpc区域观察并拍照,每只小鼠重复观察3张切片,用Image plus 6.0图像分析软件,选择有清晰细胞轮廓带有明显核仁的神经元进行计数,定量分析SNpc区域TH阳性细胞。
2.5TUNEL法检测细胞凋亡采用TUNEL法,按试剂盒方法操作。光镜下观察SNpc区域,每只小鼠重复观察3张切片,计数每张切片SNpc区5个高倍视野的阳性细胞,每只小鼠3张切片阳性细胞数的平均值为该只小鼠凋亡细胞数。
2.6Westernblot法检测相关蛋白的表达6只小鼠取出纹状体后,分离黑质组织,取其中3只小鼠的黑质组织,按比例加入新鲜配制的RIPA裂解液进行匀浆,4℃、10 000 r·min-1离心15 min,收集上清于-80℃保存备用。BCA法进行蛋白含量测定。以30 μg蛋白进行SDS-PAGE凝胶电泳,转印,封闭,加入一抗(Bcl-2、Bax、Cleaved caspase-3、p38、p-p38、ERK 1/2、p-ERK 1/2、JNK 1/2、p-JNK 1/2)4℃过夜。TBST洗膜后,加入二抗4℃孵育4 h,洗膜后用ECL法显影,使用Image J软件进行灰度分析。
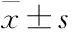
3 结果
3.1Cor对PD小鼠运动功能的影响
3.1.1旷场实验 旷场实验是目前评价小鼠运动功能和精神状态最常用的方法之一。与对照组相比,模型组小鼠的运动总路程明显减少(P<0.01);与模型组相比,除低剂量外,中、高剂量Cor预处理后,小鼠的运动总路程均明显增加(P<0.01),自发活动能力得以改善(Fig 1A)。
3.1.2转棒实验 转棒实验主要用来观察小鼠的肌张力和平衡协调能力。与对照组相比,模型组小鼠在滚筒上滞留的时间明显缩短(P<0.01),且出现肌肉无力、不喜运动等现象,说明小鼠运动平衡功能受损严重;与模型组相比,Cor组小鼠的滞留时间有延长的趋势,中、高剂量Cor组效果明显(P<0.01),一定程度提高了小鼠的肌张力及运动平衡能力(Fig 1B)。
3.1.3爬杆实验 爬杆实验是常用的评价MPTP模型小鼠动作迟缓的方法,爬杆动作需要姿势调整及平衡协调能力的共同参与。模型组小鼠在球上停留的时间(T1)和爬完全杆的时间(T2)均较对照组明显延长(P<0.01)。与模型组相比,不同剂量Cor干预后,T1均明显缩短(P<0.01),T2与T1结果趋势相似,除Cor低剂量组差异无显著性,其余组均明显缩短(P<0.05,P<0.01),改善了小鼠运动迟缓,提高了身体协调性(Fig 1C)。
Fig 1 Effects of cordycepin on motor functions of
A: The movement distance of mice in the open-field; B: The retention time of mice on the rotating rod; C: Pole test of mice.**P<0.01vscontrol;#P<0.05,##P<0.01vsMPTP
3.2Cor对PD小鼠纹状体DA及其代谢产物含量的影响与对照组比较,模型组小鼠纹状体内DA含量明显降低(P<0.01),其代谢产物DOPAC、HVA含量也出现明显下降(P<0.01)。与模型组比较,各Cor组小鼠纹状体内DA、DOPAC、HVA含量均明显升高(P<0.05,P<0.01),见Tab 1。
Tab 1 Effects of cordycepin on DA and its metabolitesin striatum of MPTP-induced mice n=6)
**P<0.01vscontrol;#P<0.05,##P<0.01vsMPTP.
3.3Cor对PD小鼠黑质TH阳性细胞数的影响对照组小鼠SNpc区可见大量排列整齐的TH免疫阳性神经元,细胞饱满,呈梭形或锥体形,轴突和树突交织的网状结构清晰完整。与对照组相比,模型组小鼠SNpc区TH免疫阳性细胞明显减少(P<0.01),神经元胞体皱缩,轴突和树突丢失严重;与模型组相比,Cor低、中、高剂量组小鼠SNpc区TH免疫阳性细胞丢失程度均明显减轻(P<0.01),其中Cor低剂量组神经元皱缩情况有所改善,但轴突和树突丢失依然明显,Cor中、高剂量组神经元胞体较为饱满,轴突和树突的网状结构损伤不明显,以Cor高剂量组最为清晰完整(Fig 2、Tab 2)。

Tab 2 Effects of cordycepin on TH-immunoreactivecells and TUNEL-immunoreactive cells in SNpc of
**P<0.01vscontrol;##P<0.01vsMPTP
3.4Cor对PD小鼠黑质DA神经元凋亡的影响对照组仅见极少量的TUNEL染色阳性细胞,而模型组可见大量棕黄色TUNEL染色阳性细胞,细胞核皱缩,形态不规则。Cor干预后,各组TUNEL染色阳性细胞较模型组均明显减少(P<0.01),见Fig 3、Tab 2。
3.5Cor对凋亡相关蛋白表达的影响如Fig 4所示,与对照组相比,MPTP模型小鼠SN中Bax和Cleaved caspase-3蛋白表达明显增加,Bcl-2蛋白表达和Bcl-2/Bax比值明显降低,且差异均具有显著性(P<0.01);Cor干预后可以逆转上述现象,Bax和Cleaved caspase-3蛋白表达降低,Bcl-2蛋白表达和Bcl-2/Bax比值均升高,其中Cor中、高剂量组作用明显(P<0.01)。

Fig 2 Effects of cordycepin on TH-immunoreactive cells in SNpc of MPTP-induced mice (×100)
A: Control group; B: 30 mg·kg-1MPTP group; C: 2.5 mg·kg-1Cor+MPTP group; D: 5.0 mg·kg-1Cor +MPTP group; E: 10.0 mg·kg-1Cor+MPTP group.
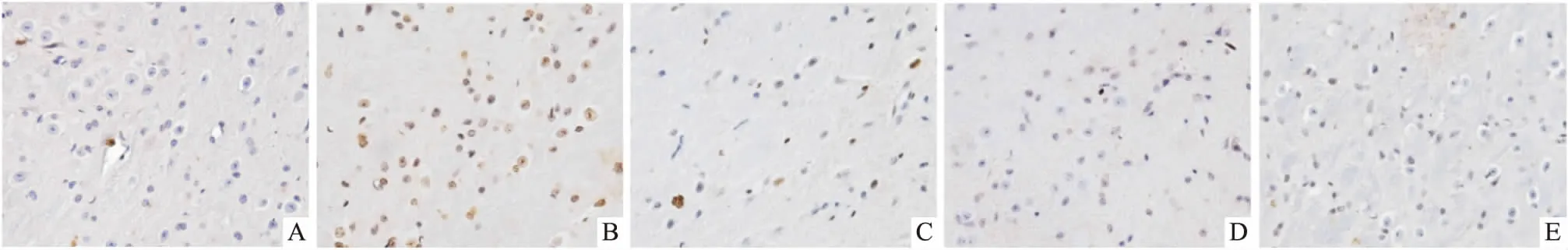
Fig 3 Effects of cordycepin on apoptosis in SNpc of MPTP-induced mice (×400)
A: Control group; B: 30 mg·kg-1MPTP group; C: 2.5 mg·kg-1Cor +MPTP group; D: 5.0 mg·kg-1Cor +MPTP group; E: 10.0 mg·kg-1Cor+MPTP group.
3.6Cor对MAPK通路蛋白表达的影响如Fig 5所示,各组间p38、ERK1/2、JNK1/2蛋白表达均无明显变化。与对照组相比,模型组小鼠黑质中p-p38、p-ERK1/2及p-JNK1/2蛋白表达均明显增加(P<0.01);与模型组相比,除Cor低剂量组p-p38和p-JNK表达无明显差异外,其他各组p-p38、p-ERK1/2、p-JNK1/2蛋白表达均明显减少(P<0.05,P<0.01)。
4 讨论
PD患者的临床症状以运动功能障碍为主,其原因是中脑SNpc区DA能神经元变性死亡,导致纹状体DA含量下降所致。本研究应用MPTP成功地模拟了上述变化,并观察到Cor能改善模型小鼠自主活动减少、运动迟缓和平衡协调能力下降的现象。同时,检测到小鼠SNpc区TH免疫阳性神经元丢失程度明显减轻,纹状体DA、DOPAC、HVA含量明显升高。有研究发现,爬杆实验结果与小鼠纹状体DA浓度高度相关[12],这在本实验中也得到证实。上述结果表明Cor能够抑制MPTP-PD小鼠DA能神经元损伤,显示了较好的神经保护作用。这一结果目前尚未见文献报道。
PD的发病与细胞凋亡关系密切。在我们前期的体外实验中,通过Hoechst 33258核染色、Annexin V-FITC/PI双染和电镜实验发现,Cor可以抑制鱼藤酮(rotenone,Rot)诱导的PC12细胞凋亡[5]。本实验显示,模型组小鼠黑质区出现大量TUNEL染色阳性细胞,Cor可以明显减少其阳性细胞数量,提示Cor在体内、体外均可抑制DA能神经元凋亡。细胞凋亡过程受到一系列凋亡蛋白的控制,其中Bcl-2家族和caspase家族最具代表性。Bcl-2家族中抗凋亡蛋白Bcl-2和促凋亡蛋白Bax是细胞凋亡的主要作用蛋白,Bcl-2/Bax比率直接决定了细胞的存亡。caspase-3是caspase家族中最重要的凋亡执行者之一,它的活化能够启动凋亡级联反应。本实验显示,Cor可以逆转MPTP引起的Bcl-2表达降低,Bax表达增加和caspase-3的活化,提高Bcl-2/Bax比值,发挥抗凋亡作用。
在哺乳动物体内,MAPK信号转导通路参与了细胞增殖、分化、凋亡和应激等病理生理过程,主要包括由p38、ERK、JNK介导的3条途径。本研究发现,MPTP可以使小鼠黑质中p-p38、p-ERK1/2、p-JNK1/2蛋白表达明显增加。Cor预处理后抑制了MPTP导致的p38、ERK1/2、JNK1/2蛋白的磷酸化,使其表达明显减少。既往研究表明,JNK信号通路参与了线粒体介导的细胞凋亡,促进线粒体释放细胞色素C到胞质,激活caspase级联反应[8],诱导DA能神经元凋亡。另一方面,p38活化后能通过Fas受体途径介导凋亡[13]。我们在Rot诱导的PC12细胞中发现,Cor能够明显提高线粒体膜电位,减少细胞色素C向胞质的释放,并能下调Fas蛋白的表达[13],推测Cor可能是通过抑制p38和JNK1/2的磷酸化,经内源性和外源性途径抑制细胞凋亡的。自由基能够激活ERK1/2,诱发下游细胞信号分子Bax的表达[14],并且可以启动caspase-3活化,导致DA能神经元变性丢失[15]。体外研究发现,Cor能提高PD细胞内超氧化物歧化酶、谷胱甘肽过氧化物酶等抗氧化酶活性,降低细胞内活性氧和丙二醛水平[4,6],据此推测Cor可能通过清除自由基,减弱氧化应激反应而抑制ERK1/2的激活,最终减少DA能神经元凋亡。当然,本研究只是初步结果,还有待进一步实验证实。氧化应激诱导神经细胞凋亡的分子机制十分复杂,其调控途径还包括NF-κB通路、p53通路、PI3K/Akt通路、Nrf2通路等信号通路,Cor是否参与了这些信号通路的调控,还有待进一步研究。
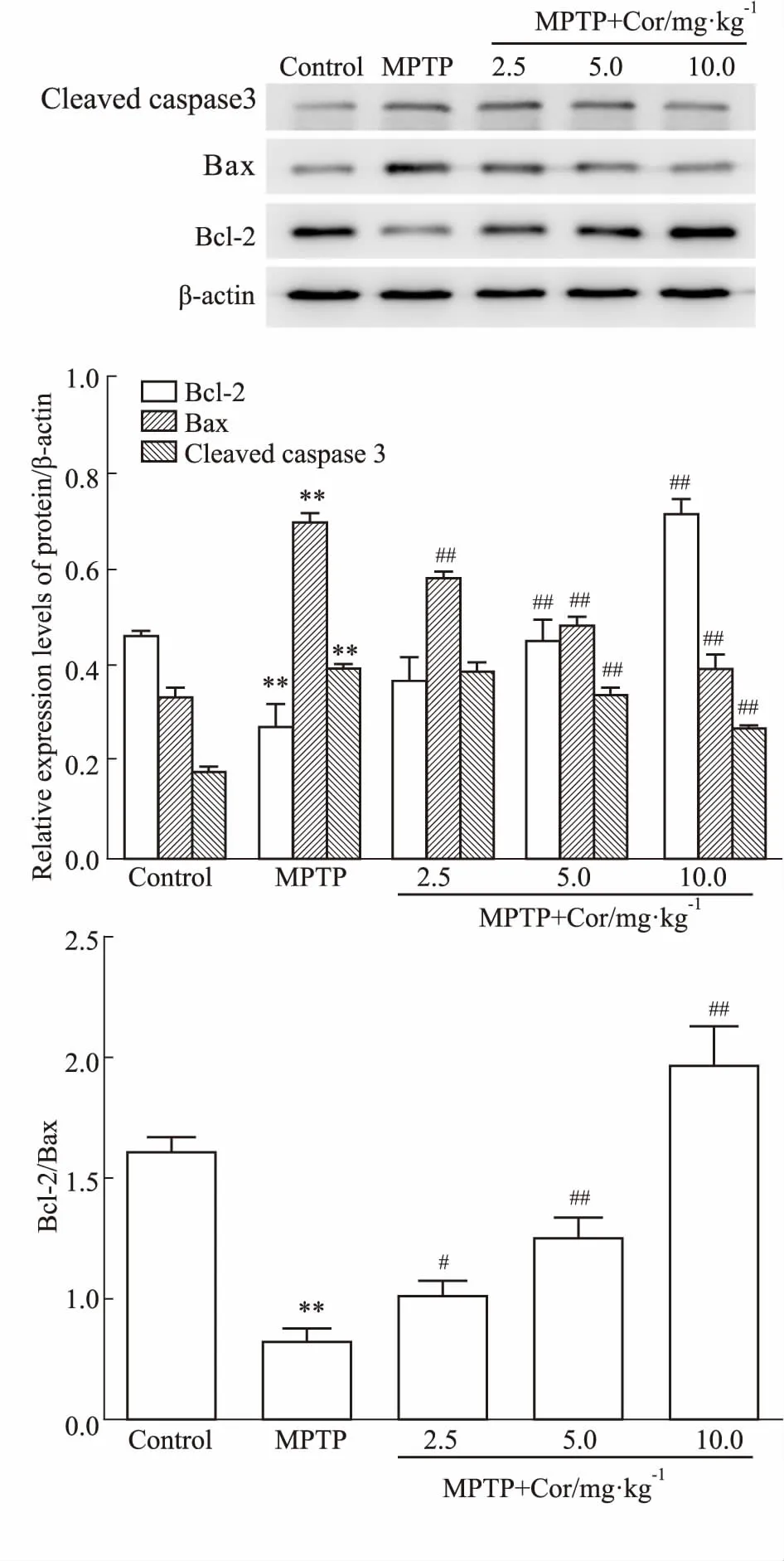
Fig 4 Effects of cordycepin on protein expressions of apoptosisrelated proteins in SN of MPTP-induced n=3)
**P<0.01vscontrol;#P<0.05,##P<0.01vsMPTP
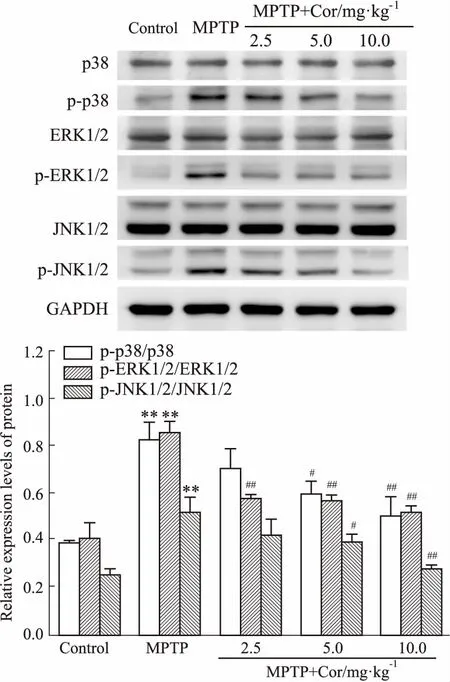
Fig 5 Effects of cordycepin on protein expressions ofMAPK signal in SN of MPTP-induced mice n=3)
**P<0.01vscontrol;#P<0.05,##P<0.01vsMPTP
综上所述,Cor对MPTP诱导的小鼠DA能神经元损伤具有保护作用,其机制可能是通过抑制MAPK的磷酸化水平,下调Bax表达,上调Bcl-2表达,以及抑制caspase-3活化,最终抑制DA能神经元凋亡。
(致谢:本实验在扬州大学医学院大型实验仪器平台和药学实验中心完成,感谢课题组全体老师和同学给予的指导和帮助,同时也感谢南京医科大学江苏省神经退行性疾病重点实验室为DA含量测定提供的帮助和支持)
[1] Mosley R L, Benner E J, Kadiu I, et al. Neuroinflammation, oxidative stress and the pathogenesis of Parkinson's disease [J].ClinNeurosciRes, 2006,6(5): 261-81.
[2] Hirsch E C, Jenner P, Przedborski S. Pathogenesis of Parkinson's disease [J].MovDisord, 2013,28(1): 24-30.
[3] 袁惠丽, 汪 璇, 张丽娟, 等. 中药在防治帕金森病中的作用及研究进展 [J]. 中国药理学通报, 2010,26(7): 850-4.
[3] Yuan H L, Wang X, Zhang L J, et al. Mechanism and research progress of Chinese traditional medicine in the prevention and treatment of Parkinson's disease [J].ChinPhamacolBull, 2010,26(7): 850 - 4.
[4] Olatunji O J, Feng Y, Olatunji O O, et al. Cordycepin protects PC12 cells against 6-hydroxydopamine induced neurotoxicity via its antioxidant properties [J].BiomedPharmacother, 2016,81: 7-14.
[5] 陈 琴, 姜 新, 顾欣霞, 等. 虫草素对鱼藤酮诱导PC12细胞凋亡的保护作用 [J]. 中国新药杂志, 2016,25(8): 938 - 43.
[5] Chen Q, Jiang X, Gu X X, et al. Protective effect of cordycepin against PC12 cell apoptosis induced by rotenone [J].ChinJNewDrugs, 2016,25(8): 938 - 43.
[6] 姜 新, 张 鑫, 顾欣霞, 等. 虫草素抑制帕金森病细胞凋亡的caspase激活途径研究 [J]. 沈阳药科大学学报, 2017,34(10): 899 - 904.
[6] Jiang X, Zhang X, Gu X X, et al. Caspase activation pathway related to the anti-apoptosis effects on PD cells by cordycepin [J].JShenyangPharmUniv, 2017,34(10): 899 - 904.
[7] 徐圆圆, 梁小凤, 朱雯婷, 等. 5-羟基-1-氢-吲唑对SH-SY5Y细胞的保护作用及其机制研究 [J]. 中国药理学通报, 2016,32(3):378 - 84.
[7] Xu Y Y, Liang X F, Zhu W T, et al. The protective action and its mechanism of 5-hydroxy-1H-indazole in SH-SY5Y cells [J].ChinPhamacolBull, 2016,32(3):378 - 84.
[8] Huang Q, Du X, He X, et al. JNK-mediated activation of ATF2 contributes todopaminergic neurodegeneration in the MPTP mousemodel of Parkinson’s disease [J].ExpNeurol, 2016,277: 296-304.
[9] Corti O, Hampe C, Koutnikova H, et al. The p38 subunit of the aminoacyl-tRNA synthetase complex is a Parkin substrate: linking protein biosynthesis and neurodegeneration [J].HumMolGenet, 2003,12(12):1427-37.
[10] Zhu J H, Kulich S M, Oury T D, Chu C T. Cytoplasmic aggregates of phosphorylated extracellular signal regulated protein kinases in Lewy body diseases [J].AmJPathol, 2002,161(6):2087-98.
[11] 刘树民, 张 琳, 丛树园, 于海龙. MPTP对小鼠帕金森病造模条件探讨 [J]. 中国实验动物学报, 2007,15(2): 146- 50.
[11] Liu S M, Zhang L, Cong S Y, Yu H L. Exploration on the conditions of establishment of MPTP-Induced mouce model of Parkinson’s disease [J].ActaLabAnimSciSin, 2007,15(2):146-50.
[12] Matsuura K, Kabuto H, Makino H, Ogawa N. Pole test is a useful method for evaluating the mouse movement disorder caused by striatal dopamine depletion [J].JNeurosciMethods, 1997,73(1):45-8.
[13] 王 茜, 张 辉, 张作凤, 等. p38MAPK对帕金森病MPTP模型小鼠NF-κB和COX-2调控的研究 [J]. 中国现代医学杂志, 2012,22(28):15-20.
[13] Wang Q, Zhang H, Zhang Z F, et al. Role of p38 MAPK in regulating expression of NF-κB and COX-2 in substantia-nigra of MPTP Parkinson's disease mice model [J].ChinJModMed, 2012,22(28): 15-20.
[14] Sawe N, Steinberg G, Zhao H. Dual roles of the MAPK/ERK1/2 cell signaling pathway after stroke [J].JNeurosciRes, 2008,86(8):1659-69.
[15] 石 冲, 张国彬, 张宇新, 张作凤. 磷酸化ERK1/2对帕金森病模型小鼠黑质半胱氨酸蛋白酶-3表达的影响 [J]. 中国老年学杂志, 2015,35(24): 7046 - 8.
[15] Shi C, Zhang G B, Zhang Y X, Zhang Z F. Effect of p-ERK1/2 on the expression of caspase-3 in Parkinson's disease mice model [J].ChinJGerontol, 2015,35(24): 7046-8.

