依托泊苷的高载药量纳米化制备及其体外血脑屏障穿透性
孟凡荣,王甲朋,范丽雪,刘梅梅,李万华,刘大伟,隋 昕,骆 媛,杨 军,王永安
(1.军事科学院军事医学研究院毒物药物研究所,北京 100850;2.济南军区疾病预防控制中心,山东济南 250014;3.中国人民解放军第32104部队,内蒙古阿拉善 735400;4.山东省昌邑市妇幼保健院,山东昌邑 261300)
近年来,纳米技术得到了突飞猛进的发展,在光电子领域和生物领域由于其优异的物理、化学性能和极大的潜在应用前景而引起了人们广泛关注[1-6]。纳米材料研究的范围,由最初的量子点等0维材料,延伸至了一维材料(纳米竿)和三维立体空间结构,研究的领域也由最初的无机材料(硅线等)扩展到了有机小分子和高分子领域。现阶段已经有大量成熟的纳米材料制备手段[7],能做到对纳米材料形貌和尺寸的精密控制及大量制备。在生物领域,纳米材料因其特殊的优异的性能,在纳米药物载体,新型药剂等方面,正得到大规模的研究和应用[1-2,8-11]。
鬼臼毒类化合物是作用于癌细胞DNA拓扑异构酶Ⅱ的非嵌入型抗肿瘤药物,其衍生物依托泊苷(etoposide,VP-16)由于具有良好的广谱抗肿瘤活性和低毒性而应用于临床,对于小细胞肺癌有良好的疗效[12-14]。此外,VP-16还对恶性淋巴瘤、恶性生殖细胞瘤、白血病、神经母细胞瘤、横纹肌肉瘤、卵巢癌、非小细胞肺癌、胃癌和食管癌等有一定疗效。VP-16为中性亲酯类药物,脂溶性高,在使用时存在着水溶性差的问题,限制了其应用[15]。在实际应用过程中,通常会加入增溶性辅助物质改善其溶解性[16]。但增溶性添加物往往会引起低血压和高过敏性的症状。为了改善其水溶性,传统的做法是从药物分子的角度入手,在分子水平上通过化学反应接入水溶性基团增加其溶解性[17-19],这样使合成步骤复杂,周期长,产量低,且药物分子改构后对其药效产生不可预知的影响。
本研究旨在通过纳米技术,将低水溶性药物VP-16制备为140 nm尺寸的纳米颗粒(nanoparti⁃cles,NP)悬浊液(VP-16 NP),鉴定其形貌和尺寸等物理表征、检测其释药率和对肿瘤细胞的抑制率,考察其纳米化后对药效的影响。同时,构建体外血脑屏障(blood-brain barrier,BBB)模型,评价VP-16 NP的BBB穿透性,为以后该药物治疗如脑胶质瘤等脑部肿瘤提供实验依据。
1 材料与方法
1.1 动物、细胞、试剂和仪器
新生2周的SD大鼠7~10只,雌雄不限,购自北京斯贝福实验动物技术有限公司,许可证号SCXK(京)2016-0011。KB口腔上皮癌细胞购自中国科学院细胞库。VP-16购于北京凯森莱公司;RPMI1640培养液购于美国Gibco公司;四甲基偶氮唑蓝(MTT)购于美国Sigma公司;曲拉通(Trixon X100)购自国药集团化学试剂有限公司;DMEM-HG、胎牛血清、磷酸盐缓冲液、Ⅱ型胶原酶购自美国Gibco公司;胶原酶/分散酶购自瑞士Roche公司;纤维粘连蛋白(fibronectin,FN)、ECM专用培养液购自美国ScienceCell公司;D-Hank′s液购自上海捷瑞生物工程有限公司;大鼠内皮细胞分离液购自天津市灏洋生物制品科技有限公司。荧光素钠(flu⁃orescein disodium salt,FLU)购自美国 ACROS公司;牛血清白蛋白(bovine serum albumin,BSA)购自美国Amresco公司;Transwell 6孔板(0.4 μm)、96孔板均购自美国Corning公司;三氯甲烷和四氢呋喃(THF)等试剂均为分析纯,使用前未经过纯化处理,购自国药集团化学试剂有限公司。
BI-9000AT动态散光仪,美国Brookhaven公司;BI-200SM光度计,美国Coherent公司;S4300扫描电子显微镜,日本日立公司;UV-Vis 2550紫外分光光度计,岛津公司;Millicell®ERS-2,美国Milli⁃pore公司;CO2培养箱,日本Sanyo公司;细胞计数仪、550型酶标仪,美国Bio-Rad公司;H-7650透射电镜,日本日立公司。
1.2 VP-16 NP的制备与表征观察
配制含VP-165 mmol·L-1的三氯甲烷溶液,用微量注射器取300 μL注入5 mL浓度为2%曲拉通水溶液中,匀速搅拌形成乳白色乳浊液,敞口搅拌使三氯甲烷缓慢挥发至溶液变澄清为止。离心3次(850×g,10 min)除去表面活性剂曲拉通。然后将NP分散于去离子水中,超声30 min后得分散良好的悬浊液;进一步将其滴于清洁硅片上,待水干后将硅片粘于样品台上,用扫描电子显微镜观测其形态;最后,再将该悬浊液滴于铜网上,待水干后将铜网放置于样品竿上,用透射电镜观测其内部结构;吸取部分悬浊液采用0.22 μm膜过滤后,用动态散光仪测粒径。
1.3 VP-16粉末及VP-16 NP释放曲线的测定[20]
VP-16标准曲线的建立:精密称取6.4 mg VP-16,用H2O∶THF(1∶1)配制成0.128 g ·L-1的溶液50 mL,分别取0.2,0.5,0.8,1.1,1.4,1.7,2.0,3.0 mL置于10 mL容量瓶中,用H2O∶THF(1∶1)稀释,得到一系列标准溶液,测285 nm吸光度值,做出其标准曲线。
VP-16 NP浓度的测定:将VP-16 NP超声,振荡均匀后,取1 mL溶液,加入1 mL THF,密封超声1 h后,测285 nm处吸光度值,代入标准曲线,计算出浓度。以生理盐水为释放介质,体积200 mL,将待测物装入透析袋中后置于释放介质中。每隔一定时间取3 mL溶液,然后补充3 mL相应缓冲溶液,保证透析袋外溶液体积恒定。测定溶液在285 nm处的吸光度值,通过VP-16的标准曲线计算出累积药物释放率。VP-16粉末浓度的测定方法同VP-16 NP。
1.4 MTT比色法[21-23]检测KB细胞存活
将细胞密度调整为每孔1×104细胞,接种于96孔培养板中,每孔100 μL。实验组每组重复4孔,加入测试药物分别为VP-16饱和水溶液、VP-16 DMSO溶液、VP-16 NP和VP-16粉末,初始浓度分别为0.5 g·L-1,加样时稀释成梯度浓度1~48 μg·L-1。以只加培养液的细胞孔作为对照组,另设完全只加培养液无细胞的组为调零组,在37oC,5%CO2培养箱中培养48 h后,每孔加入MTT(1g·L-1)10 μL,继续培养4 h后吸出每孔培养液,加入150 μL DMSO,用酶联免疫检测570 nm处吸光度值(A570nm),计算细胞存活率和半数抑制浓度(IC50)。细胞存活率(%)=(实验组A570nm-调零组A570nm)/对照组A570nm-调零组A570nm×100%。
1.5 VP-16 NP的BBB穿透性评价
1.5.1 脑微血管内皮细胞的分离、提取和培养
取新生2周龄的SD大鼠10只,颈椎脱臼处死后75%乙醇消毒1~2 min后迅速断头,置冰块上盛有冷D-Hank′s液的培养皿中,剪开头皮与颅骨取出鼠脑,去除软脑膜、脑干和海马等,只留取脑皮质用冷D-Hank′s液清洗3次后剪碎致1 mm3大小,再将其转移到15 mL离心管,加入0.1%浓度Ⅱ型胶原酶(含DNaseⅠ)放置到37℃水浴锅消化,1.5 h后离心(100×g,8 min,室温),弃上清。加入20%BSA重悬后离心(1000×g,20 min,4℃),留取底部沉淀。再加入0.1%浓度的胶原酶/分散酶(含DNaseⅠ)消化1 h后离心(100×g,8 min,室温),弃上清[24]。加入大鼠内皮细胞分离液制成梯度界面,离心(1000×g,10 min,4℃)。吸取环状乳白色层的细胞,将细胞清洗后加入内皮细胞专用培养液重悬,接种到FN包被的25 cm2培养瓶中,放入37℃,5%CO2培养箱孵育,16 h后换全液,以后2~3 d换液。待细胞长满瓶底约70%时,每天换1次培养液直至细胞长满培养瓶。
1.5.2 体外BBB模型的建立及评价
将第1~2代原代脑微血管内皮细胞以每孔1.0×106个的密度接种到Transwell 6孔板上室,待生长2~4 d后细胞融合[25],通过4 h渗漏实验、TEER实验和FLU穿透性实验评价BBB模型,确认符合后续实验要求。
1.5.2.1 4 h渗漏实验
在Transwell的上室和下室分别加入一定体积的细胞培养液,使之形成>0.5 cm明显的液面差,4 h后观察是否还能维持>0.5 cm明显的液面差。
1.5.2.2 TEER实验
使用Millicell®ERS-2对模型进行跨内皮电阻值测量。按照其说明书进行操作,计算出有效电阻值(Ω·cm2)=(细胞孔电阻值-空白孔电阻值)×膜面积(cm2)[26]。
1.5.2.3 FLU穿透性实验
使用酶标仪测定浓度分别为0,0.1,1,10和100 mg ·L-1的FLU的荧光强度,每个样品设4个复孔,然后绘制标准曲线。上室加入FLU,按15,30和60 min采集下室液体。根据文献记载的方法,测定并计算FLU穿透脑微血管内皮细胞的单层量。根据公式V清(mL)=(CA×VA)/C初,CA为下室液体浓度;VA为下室液体体积;C初为上室液体初使浓度。以清除体积对时间作图,斜率表示清除率(mL·min-1),清除率=P×S,P为穿透性,S为穿透膜的面积。按本实验分组的设定,Pt为空白无细胞的穿透系数,Pf为体外BBB模型组的穿透系数,Pe为最终待测药物的穿透系数,S为细胞培养室的膜面积,本实验的S为4.67cm2。根据公式1/PeS=1/PtS-1/PfS推导出PeS=PfS×PtS/PfS-PtS,最终计算出穿透系数Pe[27]。
1.5.3 VP-16 NP的BBB穿透性测试
将VP-16 NP充分分散后加入Transwell上室1 mL(浓度10 mg ·L-1),下室加入2 mL D-Hank′s液,按30 min时间点采集,从下室采集200 μL,同时补给200 μL D-Hank′s液。按上述FLU穿透系数的计算方法,计算出VP-16 NP跨体外BBB的穿透系数。此外,将样品用PBS离心清洗后,滴于清洁硅片上,小心放入铜网,待水干后用于透射电镜观察。
1.6 统计学分析
实验结果数据以±s表示,采用GraphPad Prism5软件对数据进行分析,组间比较采用t检验。浓度效应曲线采用Sigmoidal dose-response(variable slope)方程Y=Bottom+(Top-Bottom)/{1+10〔^(LogIC50-X)×HillSlope〕}拟合。
2 结果
2.1 制备的VP-16 NP表征
用高浓度表面活性剂可得到粒径分布均匀的VP-16 NP。随三氯甲烷的全部挥发,体系由乳白色乳浊液变澄清,即可获得大量VP-16 NP。得到的VP-16 NP能在水溶液中良好分散,形成较为稳定的悬浊液。扫描电子显微镜显示,VP-16 NP近球形(图1);透射电镜可见其内部结构为实心结构(图2);经动态光散射向仪测其粒子直径为140 nm(图3)。

Fig.1 Image of etoposide nanoparticles(VP-16 NP)by scanning electron microscope.

Fig.2 Image of VP-16 NP by transmission electron mi⁃croscope.

Fig.3 Image of VP-16 NP by dynamic light scattering.
2.2 VP-16粉末和NP悬浊液释放率
在H2O∶THF溶剂中,VP-16的标准曲线为A=6.51353c-2.83685×10-4,A为285 nm处吸收峰值,c为浓度(g ·L-1),r=0.999。利用该标准曲线测试药物的累计释放率(图4),VP-16 NP的累计释放率为VP-16粉末状药物的3倍。因为VP-16 NP直径为140 nm,尺寸的减小使得颗粒的比表面积增大,处于表面的分子数增多。
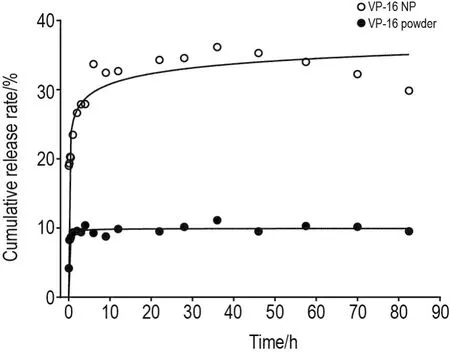
Fig.4 Cumulative release rate of VP-16 powder and VP-16 NP.The VP-16 standard curve determined the absor⁃bance of VP-16 NP and VP-16 powder at 285 nm in UV,and the concentration was brought into the standard curve to calcu⁃late the cumulative release rate of the drug.This was the result of one experiment.
2.3 VP-16 NP对KB细胞存活的影响
MTT结果显示(图5),VP-16粉末对KB细胞存活无明显抑制作用,而VP-16 NP对KB细胞存活的抑制率远远高于同浓度的VP-16粉末和溶解分散状态的VP-16溶液(P<0.01)。并且随着时间的延长,VP-16 NP对KB细胞存活的抑制率增强,其半数抑制浓度(IC50)明显降低。在不加入增(助)溶剂的情况下,VP-16 NP能有效抑制KB细胞存活。
2.4 VP-16 NP的体外BBB模型穿透性
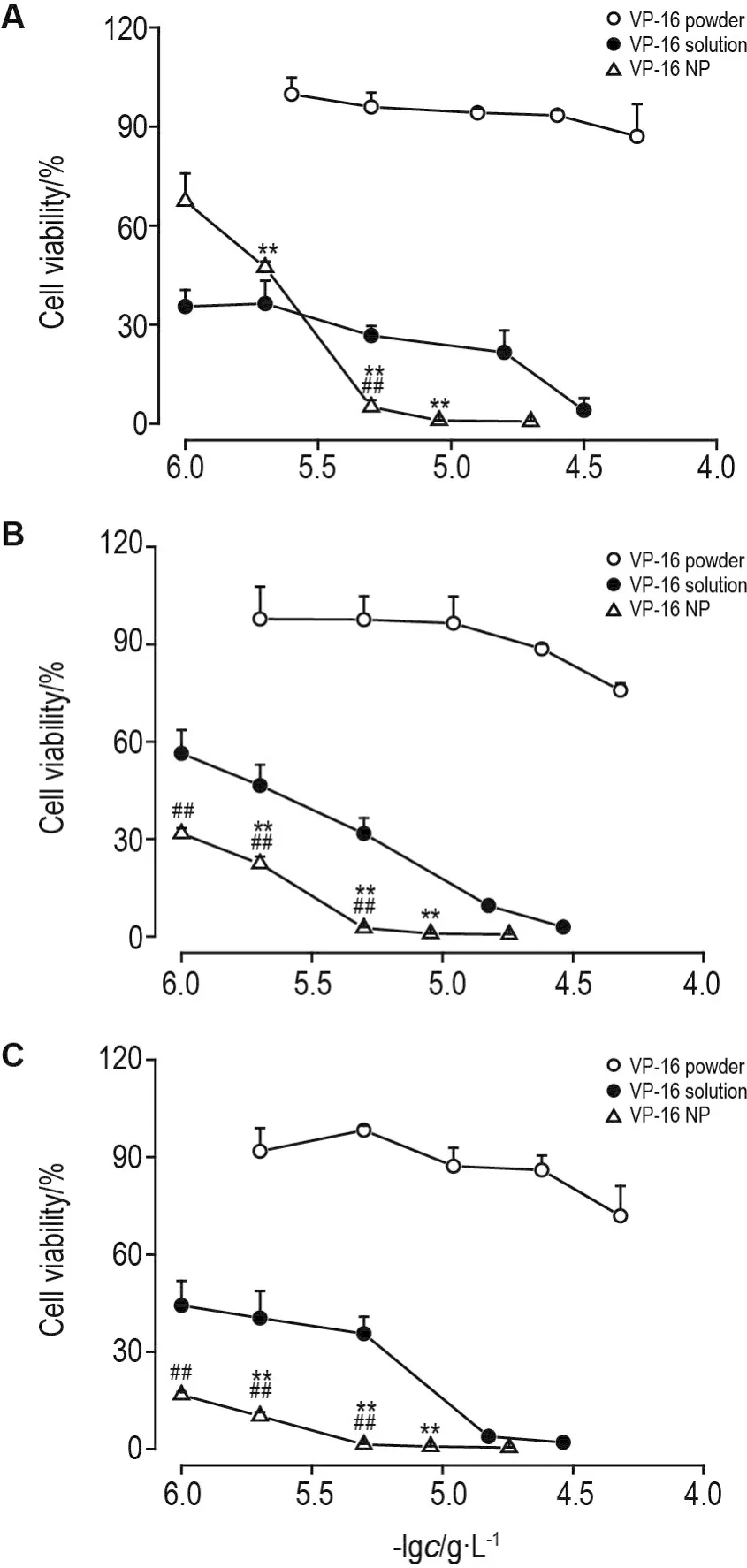
Fig.5 Effects of VP-16 solution,VP-16 NP and VP-16 powder on survival of KB cells in 24 h(A),48 h(B)and 72 h(C).VP-16 solution,VP-16 NP,and VP-16 powder concentration(1-48 μg·L-1)were added to the cells.±s,n=4.**P<0.01,compared with VP-16 powder group;##P<0.01,com⁃pared with VP-16 solution group.
脑微血管内皮细胞以每孔1×106个密度接种到Transwell上室,在培养至2~4 d时,4 h渗漏实验观察Transwell上室与下室能够维持>0.5 cm的液面差;TEER有效电阻值可达到223 Ω·cm2;FLU穿透性实验可得知,在15,30和60 min时,穿透系数分别为(0.33±0.04)×10-3,(0.42±0.07)×10-3和(0.52±0.06)×10-3cm·min-1,与文献报道的范围接近[27]。VP-16 NP在30 min时穿透系数为(1.87±0.03)×10-3cm·min-1,较相同时间点的FLU显示出较高的穿透性(P<0.01)。TEM可清晰地观察到VP-16 NP,说明VP-16 NP能够穿透体外BBB模型(图6)。
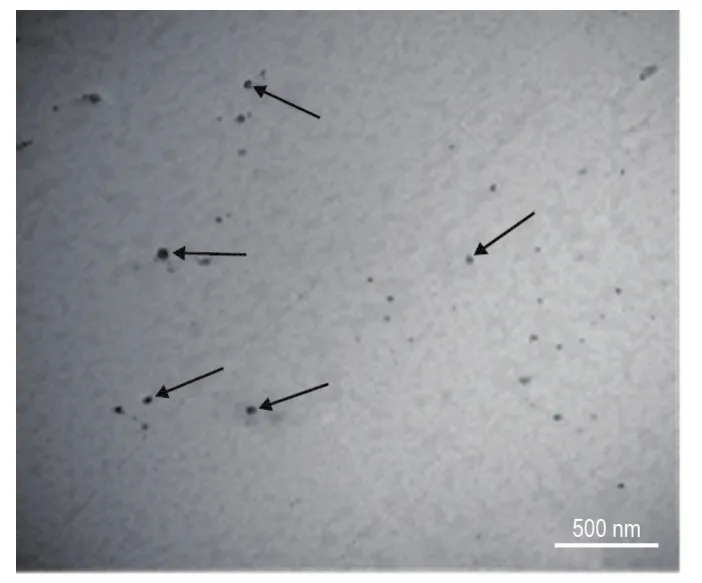
Fig.6 Images of VP-16 NP penetrating blood-brain barrier model in vitro by transmission electron microscope.Arrows show the penetration of VP-16 NP to BBB.
本研究通过乳液溶剂交换法[28-29],制备得到了大量140 nm粒径,粒径分布均匀、呈典型球形的VP-16 NP,其制备工艺简便易行。经以上实验数据研究显示,①VP-16 NP的药物释放率高于其粉末形态。相对于VP-16粉末,VP-16 NP由于其处于纳米尺度,体积小,比表面积大,能与溶液有更多的接触,固体的溶解量与溶解速度都比常规尺寸下的粉末高,所以其药物释放效率更高。并且在相同的体积下,VP-16 NP能与水有更大的有效接触面积,使得颗粒的溶解速率和溶解量都大大增加,很快达到药物的饱和浓度。而且药物在体内是一个不断消耗的过程,VP-16 NP相比普通的粉末,能迅速溶解释放出药物分子,并持续维持药物的饱和浓度。②VP-16 NP对癌细胞的抑制效果优于其粉末形态和在DMSO中的溶解分散状态。抗癌药物一般是以分子的形式进入细胞,然后杀灭细胞或阻断细胞有丝分裂。当药物分子被消耗,溶液变成未饱合状态,VP-16 NP较高的溶解速率能保证体系迅速恢复至饱和浓度,维持药物的高浓度状态,提供充足的药物分子杀伤癌细胞。大量的文献也已证明,由于纳米材料具有合适的尺寸,能作为优秀的药物载体[30]。VP-16 NP尺寸为140 nm,小于细胞膜孔道(200 nm),又由于其亲脂性高,粒径小,能直接通过细胞膜上的孔道进入细胞,在细胞内释放出药物分子杀死癌细胞,从而使其细胞杀伤率高于溶解状态的药物分子。
此外,通过原代培养脑微血管内皮细胞,经Transwell构建体外BBB模型,采用经典的4 h的渗漏实验、TEER实验及FLU穿透性实验对模型进行验证。在建模成功的基础上,评价VP-16 NP穿透体
3 结论
外BBB模型的穿透性。经计算,30min时,VP-16 NP的穿透系数为(1.87±0.03)×10-3cm·min-1,相对于穿透系数为(0.42±0.07)×10-3cm·min-1的FLU,显示出很好的穿透性。由此可见,经过纳米技术的处理,大大地拓展了传统化疗药物的应用范围和疗效,尤其针对因水溶性极差而限制其应用的抗癌药物具有良好的应用前景。
[1] Min Y,Caster JM,Eblan MJ,Wang AZ.Clinical translation of nanomedicine [J].ChemRev,2015,115(19):11147-11190.
[2] Shi J,Kantoff PW,Wooster R,Farokhzad OC.Cancer nanomedicine:progress,challenges and opportunities[J].Nat Rev Cancer,2017,17(1):20-37.
[3] Klimov VI,Mikhailovsky AA,Xu S,Malko A,Hollingsworth JA,Leatherdale CA,et al.Optical gain and stimulated emission in nanocrystal quan⁃tum dots[J].Science,2000,290(5490):314-317.
[4] Lao YH,Phua KK,Leong KW.Aptamer nanomedi⁃cine for cancer therapeutics:barriers and potential for translation[J].ACS Nano,2015,9(3):2235-2254.
[5] Huang MH,Mao S,Feick H,Yan H,Wu Y,Kind H,et al.Room-temperature ultraviolet nanowire nano⁃lasers[J].Science,2001,292(5523):1897-1899.
[6] Yao S,Zhu Y.Nanomaterial-enabled stretchable conductors:strategies,materials and devices[J].Adv Mater,2015,27(9):1480-1511.
[7] Nalwa HS.HandbookofNanostructured Materials and Nanotechnology[M].San Diego:Elsevier,2000:631-639.
[8] Ajima K,Yudasaka M,Murakami T,Maigné A,Shiba K,Iijima S.Carbon nanohorns as anticancer drug carriers[J].Mol Pharm,2005,2(6):475-480.
[9] Orive G,Hernández RM,Gascón AR,Pedraz JL.Micro and nano drug delivery systems in cancer therapy[J].Therapy,2005,3:131-138.
[10] Portney NG,Ozkan M.Nano-oncology:drug delivery,imaging,and sensing[J].Anal Bioanal Chem,2006,384(3):620-630.
[11] Dahlman JE, Barnes C, Khan O, Thiriot A,Jhunjunwala S,Shaw TE,et al.In vivoendothelial siRNA delivery using polymeric nanoparticles with low molecular weight[J].Nat Nanotechnol,2014,9(8):648-655.
[12] Danks MK,Yalowich JC,Beck WT.Atypical multiple drug resistance in a human leukemic cell line selected for resistance to teniposide(VM-26)[J].Cancer Res,1987,47(5):1297-1301.
[13] Bugg BY, Danks MK, Beck WT, Suttle DP.Expression of a mutant DNA topoisomerase Ⅱ in CCRF-CEM human leukemic cells selected for resistance to teniposide[J].Proc Natl Acad Sci USA,1991,88(17):7654-7658.
[14] Giaccone G,Splinter TA,Debruyne C,Kho GS,Lianes P,van Zandwijk N,et al.Randomized study of paclitaxel-cisplatinversuscisplatin-tenipo⁃side in patients with advanced non-small-cell lung cancer.The European Organization for Research and Treatment of Cancer Lung Cancer Cooperative Group[J].J Clin Oncol,1998,16(6):2133-2141.
[15] Kuo YC,Chen YC.Targeting delivery of etoposide to inhibit the growth of human glioblastoma multi⁃forme using lactoferrin-and folic acid-grafted poly(lactide-co-glycolide)nanoparticles[J].Int J Pharm,2015,479(1):138-149.
[16] Yokoyama M,Satoh A,Sakurai Y,Okano T,Matsumura Y,Kakizoe T,et al.Incorporation of water-insoluble anticancer drug into polymeric micelles and control of their particle size[J].J Control Release,1998,55(2-3):219-229.
[17] Senter PD, Saulnier MG, Schreiber GJ,Hirschberg DL,Brown JP,Hellström I,et al.Antitumor effects of antibody-alkaline phosphatase conjugates in combination with etoposide phos⁃phate[J].Proc Natl Acad Sci USA,1988,85(13):4842-4846.
[18] Budman DR, Igwemezie LN, Kaul S, Behr J,Lichtman S,Schulman P,et al.Phase I evaluation of a water-soluble etoposide prodrug,etoposide phosphate,given as a 5-minute infusion on days 1,3,and 5 in patients with solid tumors[J].J Clin Oncol,1994,12(9):1902-1909.
[19] Beig A,Miller JM,Lindley D,Carr RA,Zocharski P,Agbaria R,et al.Head-to-head comparison of different solubility-enabling formulations of etopo⁃side and their consequent solubility-permeability interplay[J].J Pharm Sci,2015,104(9):2941-2947.
[20] Ritger,PL,Peppas NA.A simple equation for description of solute release Ⅱ.Fickian and anoma⁃lous release from swellable devices[J].J Control Release,1987,5(1):37-42.
[21] Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1-2):55-63.
[22] Gerlier D,Thomasset N.Use of MTT colorimetric assay to measure cell activation[J].J Immunol Methods,1986,94(1-2):57-63.
[23] Twentyman PR,Luscombe M.A study of some variables in a tetrazolium dye(MTT)based assay for cell growth and chemosensitivity[J].Br J Cancer,1987,56(3):279-285.
[24] Xu XF,Li RP,Li Q,Liu WW,Lian QL,Liu Y,et al.Isolation and primary culture of rat cerebral micro⁃vascular endothelial cells[J].Chin J Cell Biol(细胞生物学杂志),2005,27:84-88.
[25] Gao XH.Overcoming the blood-brain barrier for delivering drugs into the brain(跨血脑屏障脑部递药策略的研究)[D].Shanghai:Fudan University(复旦大学),2014.
[26] Wu F.Establishment of anin vitro modelof the blood-brain barrier(离体血脑屏障模型的建立)[D].Hangzhou:Zhejiang University of Technology(浙江工业大学),2007.
[27] Zhang SH,Ji LF,Ma J.Transendothelial electric resistance and permeability ofin vitromodel of no-contact co-culture blood-brain barrier[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(6):882-887.
[28] Lianos P,Lang J,Strazielle C,Zana R.Fluores⁃cence probe study of oil-in-water microemulsions.1.Effect of pentanol and dodecane or toluene on some properties of sodium dodecyl sulfate micelles[J].J Phys Chem,1982,86(6):1019-1025.
[29] Shikata T,Hirata H,Kotaka T.Micelle formation of detergent molecules in aqueous media.2.Role of free salicylate ions on viscoelastic properties of aqueous cetyltrimethylammonium bromide-sodium salicylate solutions[J].Langmuir,1988,4(2):354-359.
[30] Kang B,Chang S,Dai Y,Yu D,Chen D.Cell response to carbon nanotubes:size-dependent intra⁃cellular uptake mechanism and subcellular fate[J].Small,2010,6(21):2362-2366.

