ZnO纳米颗粒水凝胶高分子材料的合成及梭曼体内外染毒洗消性能的评价
王甲朋,孟凡荣,范丽雪,李万华,隋 昕,骆 媛,田 萌,全东琴,王永安,张有志,杨 军
(1.军事科学院军事医学研究院毒物药物研究所,北京 100850;2.中国人民解放军第32104部队,内蒙古阿拉善 735400;3.原济南军区疾病预防控制中心,山东济南 250014;4.天津市河北区光复道街社区卫生服务中心,天津 300143)
神经性毒剂是经典化学战剂中毒性最强的致死性、速杀性毒剂,可经呼吸道和皮肤等多种途径中毒,极短时间引发中毒甚至死亡,最有效的清除毒剂的方法是对其进行快速高效的洗消[1]。近年来,金属氧化物洗消因其独特的广谱、稳定等优势,引起了许多国家的关注。常见金属氧化物有ZnO,TiO2,Al2O3和MgO等。金属氧化物洗消原理是利用其表面有酸/碱性位点吸附神经性毒剂[2],其半导体性质可使其价带的电子迁移到导带,留下强氧化性的空穴,可有效分解毒剂[3]。金属氧化物主要通过自身的金属离子的活性来催化分解毒剂[4]。其优点是毒剂分解范围广谱;本身稳定性高[5],不易被破坏[6],适用于多种较复杂环境下的洗消;其在分解毒剂过程中担负催化剂的角色,自身不被破坏,可持续洗消;该材料无明显刺激性和腐蚀性,可用于设备和人体的清洗;其纳米颗粒有一定的吸附能力,可实现吸附毒剂而后进行快速分解的洗消。但其仍存在一些缺陷,如溶解度极低,难以均匀分散在溶液中;难以快速大量全方位地进行洗消;其纳米颗粒的吸附能力仍然有限。上述这些缺点导致其在实际洗消过程中对毒剂洗消速率仍较慢、效率较低。ZnO作为化妆品的成分,本身对皮肤和设备无刺激无腐蚀,而对神经性毒剂等有一定的洗消效果。本研究选取目前最为常见和报道的ZnO作为洗消材料进行研究。
为了解决ZnO纳米颗粒(ZnO nanoparticle,ZnO NP)洗消速率慢、洗消率低等问题,本实验采用一种稳定无毒的纳米凝胶[7]对其进行修饰和改进,合成出了ZnO NP水凝胶(ZnO NP-gel)高分子材料,评价了其物理学特性,重点考察其用于神经性毒剂梭曼的洗消效率和洗消速率。
1 材料与方法
甲基丙烯酸-2(N,N-二甲基)乙酯购自日本东京化成工业株式会社;N,N’-亚甲基双丙烯酰胺和N,N,N′,N′-四甲基二乙胺购自美国Alfa Aesar;过硫酸钾K2S2O8购自天津大茂化学试剂厂;联苯胺购自美国Adamas Reagent;4-戊烯酸购自美国Sigma公司。氯化锌(ZnCl2)、聚乙烯醇(polyving alcohol,PVA)、丙酮、甲苯和过硼酸钠等均购自北京国药集团化学试剂有限公司。
3-18K型台式冷冻离心机(美国Sigma公司);S-3400N扫描电子显微镜与H-7650型透射电子显微镜(日本日立公司);Zeta Sizer Nano-ZS90型zeta粒径分布仪(英国马尔文公司);UV-4802紫外分光光度计(上海尤尼科仪器有限公司);550型酶标仪(美国Bio-Rad公司);三用水箱(北京长风公司);隔水式恒温培养箱(上海一恒科技有限公司);电热鼓风干燥箱(上海一恒科技有限公司)。
1.1 药品、试剂和主要仪器
1.2 实验动物
昆明种小鼠,雄性,SPF级,体质量22~23 g,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2016-0006。
1.3 ZnO NP及ZnO NP-gel的制备
1.3.1 ZnO NP的制备
采用化学沉淀法制备ZnO NP。主要原理是将金属可溶性盐溶液分散于水中,加入强碱后生成不可溶的金属氢氧化物,随后自身水解成ZnO NP[8-10]。制备过程:将2 mL ZnCl2(n水∶nZnCl2=1388.9∶1,n为摩尔数)滴入500 mL PVA(V水∶VPVA=100∶1)的体系中搅拌分散,随后滴加NaOH(n水∶nNaOH=926∶1)水溶液,搅拌2 h后,离心收集ZnO NP初产品,于电热鼓风干燥箱干燥过夜后,在马弗炉中500°C高温煅烧8 h,收集ZnO NP,得产品1.6 g。
1.3.2 ZnO NP-戊烯酸的制备
ZnO NP表面进行基团活化[11-12],目的是在颗粒表面引入活性基团,以便参与下一步水凝高分子聚合反应。称取ZnO NP 1.6 g加入到120 mL甲苯中,超声0.5 h后搅拌分散ZnO NP。随后加入4-戊烯酸2.4 mL,于50°C水浴环境中避光800×g搅拌4 h。离心除掉未反应的4-戊烯酸,收集沉淀,得到ZnO-戊烯酸前体化合物。
1.3.3 ZnO NP-gel的制备
将含烯键的ZnO-戊烯酸前体化合物加入到95%乙醇200 mL中,超声10 min并充分搅拌分散样品。随后依次加入1.6 mL甲基丙烯酸-2(-N,N-二甲氨基)乙酯、1.12 g N,N′亚甲基双丙烯酰胺,290 μL N,N,N′,N′-四甲基二乙胺,1.12 g过硫酸钾,于70 °C水浴避光反应10 h。产物过滤收集,得灰白色沉淀1.7833 g。
1.4 ZnO NP-gel的物理学性质检测
取微量ZnO NP及ZnO NP-gel混悬液将其滴于清洁硅片上,待水干后将硅片置于样品台上,用扫描电子显微镜观测其形态;随后再将该悬浊液滴于铜网上,待水干后将铜网放置于样品竿上,用透射电子显微镜观测其内部结构;吸取部分悬浊液采用0.22 μm膜过滤后,用粒度分布仪测试其zeta电位;吸取适量样本滴于2 cm×2 cm载玻片上,重复滴加多次,待干燥后,将样品置于X射线衍射仪器下观察;最后取其少量干粉(5~10 mg)进行红外光谱检测,得到红外光谱结果。
1.5 包封率和载药率测定
记录ZnO NP投入量为M1,称量最终产物量为M2,取200 mg ZnO NP-gel在500°C下煅烧,去除合成的水凝胶等有机组分,得到残余ZnO NP的量为M3,计算包封率和载药率。载药率(%)=M3/200×100%;包封率(%)=M2×(M3/200)/M1×100%
1.6 ZnO NP-gel体外对梭曼的洗消效果评价
1.6.1 梭曼的联苯胺反应标准曲线实验
配制洗消反应的溶液试剂:饱和联苯胺水溶液;0.25%过硼酸钠水溶液;丙酮-PBS 0.01 mol·L-1溶液(200 mL丙酮和90 mL PBS水溶液混匀);取90%纯度的梭曼稀释1000倍,标定为母液(浓度为1.0443 g ·L-1),于冰块中储存。
通过联苯胺显色反应[13]测得梭曼的联苯胺反应标准曲线方程为y=1.4184x+0.0525,R2=0.9992(式1),式中y为吸光度值,x为梭曼浓度(g ·L-1)。梭曼浓度在0~0.1 g ·L-1范围内,其吸光度值在该线性范围内。通过该线性关系可以测定残余梭曼的含量。
1.6.2 检测不同浓度ZnO NP和ZnO NP-gel对梭曼洗消效率
取90%纯度的梭曼稀释至52.2 mg ·L-1。取ZnO NP及ZnO NP-gel分别配成0,0.1,0.5,2和10 g·L-1,取150 μL加入到1.5 mL EP管,每组重复3次,各组均加入梭曼50 μL,随后放入三用水箱中水浴(37°C,20 min)。随后依次加入600 μL丙酮-PBS溶液,饱和联苯胺溶液300 μL,0.25%过硼酸钠溶液300 μL,混匀,而后放入37°C隔水式恒温培养箱(静置5 min),而后离心吸取上清,加入96孔板,每孔200 μL,放入酶标仪中,测定在414 nm波长下的吸光度值。
根据式(1)可得出对梭曼的洗消效率的计算公式:x=(y-0.05232)/1.418×50(式2),式中x为梭曼浓度,y为吸光度值。
洗消率(%)=(x0-x1)/x0×100%,x1为不同浓度洗消剂的梭曼浓度,x0为不加洗消剂的梭曼浓度。
1.6.3 测定不同时间ZnO NP及ZnO NP-gel对梭曼洗消速率
取90%纯度的梭曼稀释至52.2 mg ·L-1。配ZnO NP及ZnO NP-gel 2 g ·L-1,分别取3.75 mL加入到10 mL EP管中,而后加入梭曼1.25 mL,充分混匀,放入三用水箱中水浴(37°C)。每隔一定时间点从该EP管中取200 μL,随后的联苯胺显色反应操作步骤同1.6.2。
1.7 梭曼ZnO NP-gel洗消液染毒小鼠毒性评价
选取24只体质量为22~23 g的雄性昆明小鼠,分为ZnO NP-gel洗消组、ZnO NP洗消组、梭曼对照组和正常对照组,每组6只受试动物。配10 mL梭曼52.2 mg ·L-1,ZnO NP-gel 1 g·L-1,ZnO NP 1 g ·L-1。ZnO NP-gel洗消组、ZnO NP洗消组和梭曼对照组(无菌注射用水)分别按3∶1(V∶V)体积比加入洗消剂(正常对照组为无菌注射用水)和梭曼,正常对照组按3∶1(V∶V)体积比加入无菌注射用水;4组均于37°C水浴中静置30 min,而后搅拌30 s,随后分别用0.22 μm的过滤器过滤去除沉淀,收集滤出液。sc给予小鼠滤出液40 μL·g-1,观察惊厥和死亡情况。
1.8 统计学分析
计量资料采用±s形式表示,采用Graphpad Prism5进行统计学分析。组间资料两两比较采用Dunnettt检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 ZnO NP-gel物理表征
扫描电镜观察发现,ZnO NP为一维棒状结构,尺寸约为300 nm×100 nm(图1A和B);ZnO NP-gel为块状结构,尺寸约为400 nm×250 nm,大量粘连成块(图1C和D)。
透射电镜(图2)下,ZnO NP为不规则的棒状实心结构(图2A和B);ZnO NP-gel则为块状结构,通过内外衬度的差异可看出,外层包裹上了一层高分子层(图2C和D)。
ZnO NP-gel zeta电位为(-7.89±0.04)mv,ZnO NP为(-0.0628±0.0095)mV。水凝胶修饰后其zeta电位绝对值增加,说明分散性更好。

Fig.1Images of zinc oxide nanoparticles(ZnO NP)(A,B)and zinc oxide nanoparticles hydrogels(ZnO NP-gel)(C,D)by scanning electron microscope.

Fig.2 Images of ZnO NP(A,B)and ZnO NP-gel by transmission electron microscope.
图3为ZnO NP和ZnO NP-gel的x射线衍射数据处理的结果。合成的ZnO NP-gel高分子材料,在2θ=8.06738°可见明显尖峰(红色),为修饰后高分子的晶体衍射峰,而ZnO NP仅出现ZnO的晶体特征衍射峰(绿色)。通过两衍射峰对比可知,水凝胶成功修饰到ZnO NP上。

Fig.3 Data processing results of X-ray diffraction of ZnO NP(green)and ZnO NP-gel(red).
图4分别为ZnO NP(图4A)和ZnO NP-gel(图4B)的红外光谱结果。两者对比发现很多峰值的变化,相比于ZnO NP的图谱,ZnO NP-gel的波数在754和618 cm-1处出现较强吸收峰,来源于高分子结构中亚甲基面内摇摆振动,该表征数据进一步证明ZnO水凝胶合成成功。
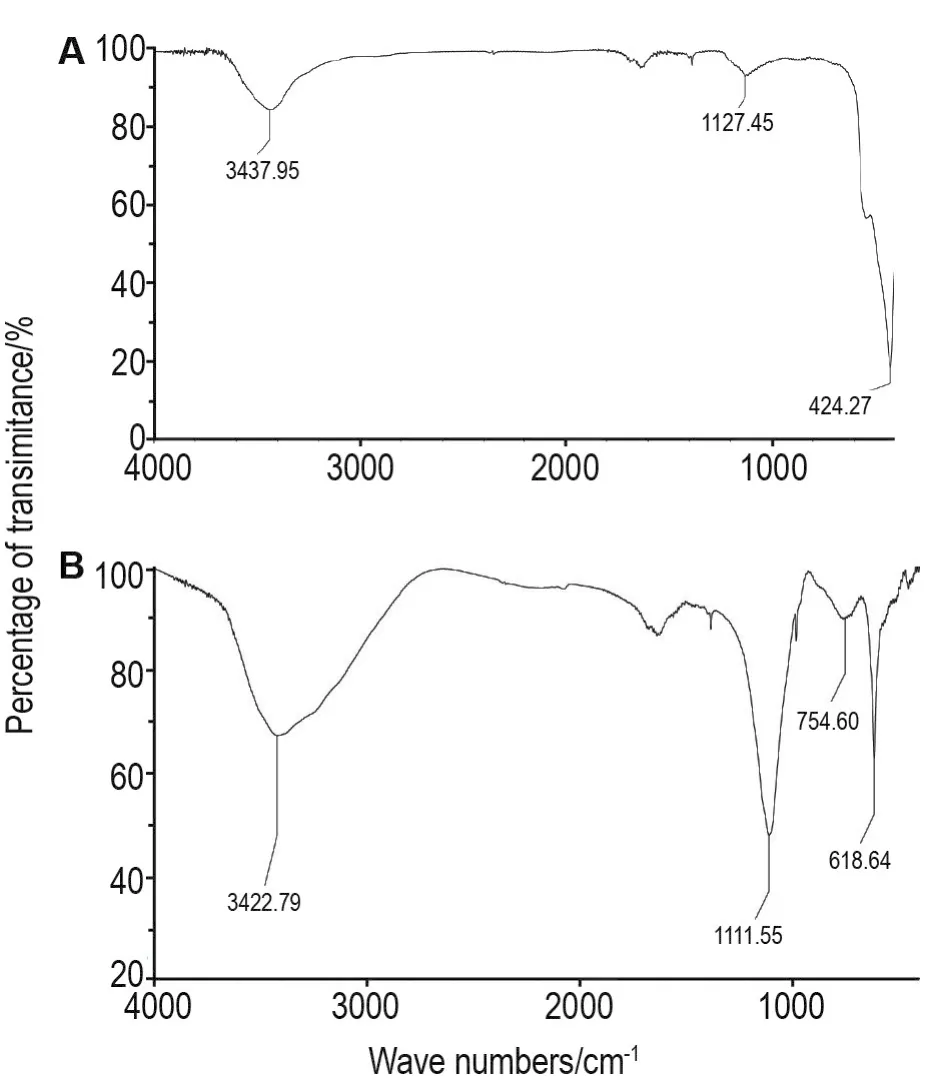
Fig.4 Infra-red spectrum of ZnO NP(A)and ZnO NP-gel(B).
2.2 ZnO NP-gel载药率和包封率
ZnO NP投入量M1为1.6 g,称量最终产物M2为1.7833 g,取0.2 g ZnO NP-gel在500℃下煅烧,去除合成的水凝胶等有机组分,得到残余ZnO NP M3为0.1529 g,通过公式计算载药率为76.45%,包封率为85.22%。
2.3 ZnO NP-gel对梭曼的体外洗消能力的评价
不同浓度洗消剂的洗消效率结果如图5A所示,两组材料洗消效率均随着浓度增加而增加;ZnO NP-gel组明显高于ZnO NP组;在相同浓度下,ZnO NP-gel洗消效率始终高于未修饰的ZnO NP(n=3,P<0.05,P<0.01)。选取浓度为2 g·L-1测定不同时间的洗消效率,结果如图5B所示,在整个洗消过程中,ZnO NP-gel的洗消率始终高于ZnO NP;ZnO NP-gel在20 min时达到50%的洗消率,而ZnO NP约80 min才能达到50%洗消率,前者较后者洗消一半毒剂的时间缩短了4倍;约120 min后ZnO NP-gel洗消效率趋于平缓,而ZnO NP洗消效率仍在增加;约420 min后,两者接近,洗消率均趋于100%。
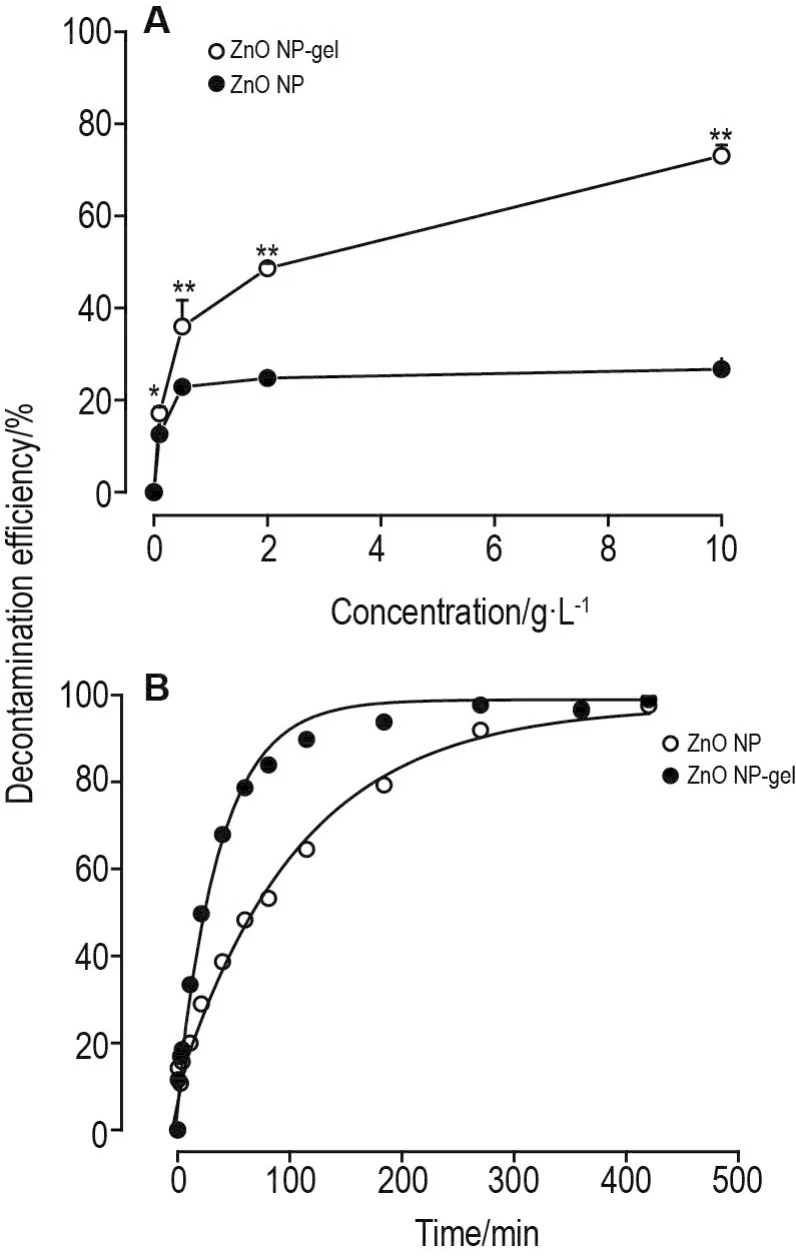
Fig.5 Decontamination efficiency of ZnO NP and ZnO NP-gel under different concentrations(A)and at different time points(B)in vitro.B was the result of one experiment.±s,n=3.*P<0.05,**P<0.01,compared with ZnO NP.
2.4 ZnO NP-gel的梭曼减毒作用
表1结果显示,给予梭曼ZnO NP-gel洗消液的小鼠未出现惊厥症状,且全部存活;而给予ZnO NP洗消梭曼的小鼠全部出现惊厥症状,死亡1只;未进行洗消的梭曼组全部惊厥且死亡。
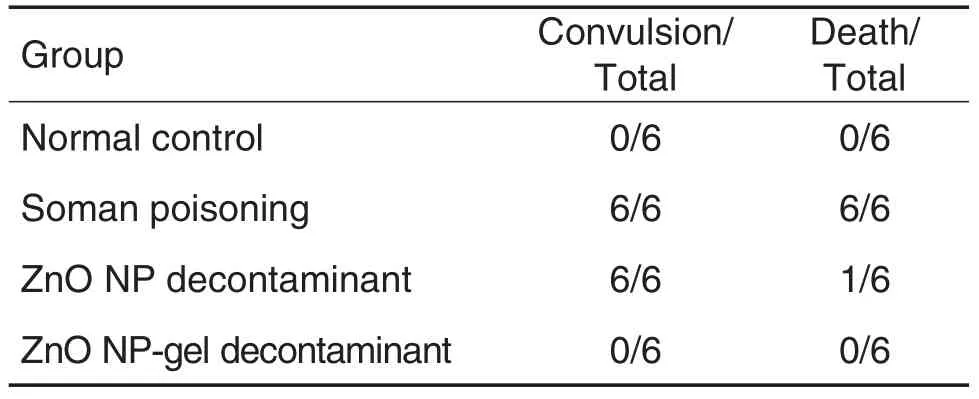
Tab.1 Detoxicative effect of ZnO NP-gel on soman exposued mice
3 讨论
ZnO NP-gel材料的合成中,在ZnO NP表面添加不饱和双键基团制备为ZnO NP-戊烯酸,目的是使其不饱和基团参与单体甲基丙烯酸-2(N,N-二甲基)乙酯的自由基聚合反应,以N,N,N′,N′-四甲基二乙胺维持稳定的弱碱性反应环境,在过硫酸钾的引发作用下促进反应生成,同时加入交联剂N′,N′-亚甲基双丙烯酰胺保证合成的材料更加稳定。
在上述反应的基础上,成功合成ZnO NP-gel后,经红外光谱、X射线衍射、扫描电子显微镜和透射电子显微镜等测试,证明前述的反应能够将高分子完全修饰在ZnO的外层;经计算,载药率为76.45%;包封率为85.22%;zeta电位负值增加证明其在溶液中分散性更好。
通过对梭曼的联苯胺反应,测定所合成ZnO NP-gel的洗消效率。经不同浓度洗消剂洗消效率对比可知,高分子修饰后的复合材料洗消效率明显提高,证明外层高分子材料的修饰,可以增加其洗消能力。分析相同洗消剂浓度下不同时间点洗消效率可得知,ZnO NP-gel洗消一半梭曼的时间较ZnO NP缩短了4倍,该高效性考虑主要源于高分子材料对梭曼的快速吸附作用。水凝胶作为一种具有吸附作用的材料,溶解后的高分子链在水溶液中溶胀扩散开,能迅速的捕获分散在体系中的毒剂分子并牢牢吸附住,实现了对梭曼无死角的快速吸附和收集,使ZnO NP可以迅速广泛接触梭曼。同时,修饰高分子材料并没有影响到内核的ZnO NP自身催化活性,实现了ZnO NP的催化分解和外层高分子材料的强力吸附的复合洗消。这种迅速吸附和催化共同发挥作用的洗消效果更有利于洗消快速高效进行;且修饰后的材料有着更好的溶液分散性,克服了ZnO NP分散性差的问题。
在该材料洗消梭曼的过滤液染毒小鼠的实验中,相较于ZnO NP组小鼠全部惊厥,ZnO NP-gel组的小鼠均未出现梭曼中毒症状,说明该材料能够高效的洗消梭曼。同时,该材料可以用于神经毒剂污染水源的清洁。在实战环境下中,用ZnO NP-gel洗消染毒的水源,而后过滤,可以实现水源净化,减少环境的污染。
神经性毒剂洗消的目标是追求快速、彻底的洗消且无二次污染。基于此应用需求,我们提出了修饰了高分子的金属氧化物纳米复合洗消材料:外层高分子发挥吸附毒剂作用的同时内核发挥催化分解毒剂的能力。该新型材料比对应的金属氧化物洗消一半梭曼的时间缩短了4倍。该类型材料的构建和合成方法,为新型洗消剂的研究提供了一个新的思路,同时更快速、高效的洗消剂的研究正在进行中。
[1] Cheng TC,Rastogi VK,DeFrank JJ,Sawiris GP.G-type nerve agent decontamination by alteromonas prolidase[J].Ann N Y Acad Sci,1998,864(1):253-258.
[2] Mahato TH, Prasad GK,Singh B,Acharya J,Srivastava AR,Vijayaraghavan R.Nanocrystalline zinc oxide for the decontamination of sarin[J].J Hazard Mater,2009,165(1-3):928-932.
[3] Chen YD,Yan KP.Green decontamination technolo⁃gy for chemical warfare agents[J].Chem Ind Eng Prog(化工进展),2012,31(10):2313-2318.
[4] Wagner GW,Procell LR,O′Connor RJ,Munavalli S,Carnes CL,Kapoor PN,et al.Reactions of VX,GB,GD,and HD with nanosize Al2O3formation of aluminophosphonates[J].J Am Chem Soc,2001,123(8):1636-1644.
[5] Zhang Y,Chen Y,Westerhoff P,Hristovski K,Crittenden JC.Stability of commercial metal oxide nanoparticles in water[J].Water Res,2008,42(8-9):2204-2212.
[6] Keller AA,Wang H,Zhou D,Lenihan HS,Cherr G,Cardinale BJ,et al.Stability and aggregation of metal oxide nanoparticles in natural aqueous matrices[J].Environ Sci Technol,2010,44(6):1962-1967.
[7] Zhu Q.Development and Application of Organo⁃phosphorus Hydrolase Nanogel Biomaterials(有机磷水解酶纳米凝胶生物材料的研制与应用)[D].Shanghai:Shanghai Jiao Tong University(上海交通大学),2011.
[8] Guo L,Yang SH,Yang CL,Yu P,Wang JN,Ge WK,et al.Synthesis and characterization of poly(vinylpyrrolidone)-modified zinc oxide nanoparti⁃cles[J].Chem Mater,2000,12(8):2268-2274.
[9] Norberg NS,Gamelin DR.Influence of surface modification on the luminescence of colloidal ZnO nanocrystals[J].J Phys Chem B,2005,109(44):20810-20816.
[10] Cai H,Chen Y,Xie SJ.Preparation and surface modification of nano-sized ZnO[J].Inorg Chem Ind(无机盐工业),2010,42(6):24-26.
[11] Wu YL,Tok AIY,Boey FYC,Zeng XT,Zhang XH.Surface modification of ZnO nanocrystals[J].Appl Surface Sci,2007,253(12):5473-5479.
[12]Hong RY,Pan TT,Qian JZ,Li HZ.Synthesis and surface modification of ZnO nanoparticles[J].Special Petrochem(精细石油化工),2006,119(2-3):71-81.
[13] Wang QD,Sun MJ,Huang PT.Micro-colorimetric determination and properties of soman-hydrolyzing enzyme in human liver[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),1995,9(4):245-249.

