piggyBac转座子介导HepG2细胞不同亚型药物代谢酶稳定共表达方法比较
庞士慧,钟国瑞,谢水林,李浩健,邹淑香,贾 英,戴仁科,黄黎珍,2
(华南理工大学1.生物科学与工程学院,2.发酵和酶工程重点实验室,广东广州 510006)
原代肝细胞被认为是体外药物代谢及药物肝毒性研究的金标准模型。然而,目前供体肝组织来源有限,且不同供体存在差异,原代肝细胞传代次数有限且细胞内药物代谢酶表达不稳定,这些都限制了原代肝细胞的广泛应用。而肝源性的HepG2细胞因在体外稳定培养,操作简便,成为目前应用广泛的药物代谢及肝毒性体外细胞模型[1],但HepG2细胞内大部分药物代谢酶基因表达水平较低或不表达[2-3]。因此,提高HepG2细胞内多药物代谢酶的水平并使其稳定表达,将为药物代谢及代谢致肝毒性研究提供较理想的细胞模型。
目前,在细胞水平介导药物代谢酶高效稳定表达研究常用的方法一般为病毒载体法(慢病毒或逆转录病毒等)。Xuan等[4]利用慢病毒载体系统结合药物筛选,构建了一系列单个药物代谢酶稳定表达的HepG2细胞系。但是慢病毒或逆转录病毒载体系统存在操作复杂、插入片段长度有限等缺陷[5],导致其在多基因稳定表达领域的应用受限。而piggy⁃Bac(PB)转座子是一种高效稳定表达体系,其在转座酶的作用下将靶基因特异性地插入宿主基因组内高频“TTAA”位点[6]。同时,大量研究表明,PB转座子整合位点偏好于基因组转录活跃区域,且不插入基因表达框内,更有利于插入基因的长期稳定表达[7-8]。此外,与病毒载体相比较,PB转座子还具有操作简便、负载量大等优点[9],因此,PB转座子系统是大片段基因或多基因稳定转染的一种较理想工具。本实验室前期研究亦发现,采用PB转座子系统将细胞色素P4503A4(cytochrome P4503A4,CYP3A4)基因导入HepG2细胞,所获的肝细胞系中CYP3A4基因拷贝数达到每细胞(30.5±1.1)拷贝,并持续传代培养>2年仍能稳定表达[10]。
目前,多基因稳定共表达的策略主要有单启动子联合2A串联表达[11]和多个单基因病毒或载体共感染2种方案[12]。由此在PB转座子介导多基因稳定共表达研究中,通常采用多个单基因转座子共转染和2A介导多基因单转座子转染2种策略。Sato等[13]采用多个单基因转座子共转染策略将7个单基因转座子共转染猪胚胎成纤维细胞,经多个药物同时筛选后,获得的抗性单克隆细胞中可实现7个基因稳定共表达。但多种药物筛选过程可能会加重细胞毒性及增加筛选操作的复杂性。相比之下,基于2A串联单转座子介导多基因稳定转染时,2A具有结构短小、高剪切效率和上下游基因表达平衡等优点,且通过多个2A串联可方便实现大量基因串联共表达。如黄惠等[14]通过采用2A介导单转座子策略转染HEK293细胞,转座酶实现表达框2A串联的延伸因子1α(elongation factor1α,EF1α)促发的增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)和嘌呤霉素(puromycin,Puro)抗性(EF1ɑ-EGFP-2A-Puro)高效转座子,且2A可有效切割GFP-Puro融合蛋白,从而获得GFP和Puro稳定高表达的细胞株。应用相似的方法,Zhang等[15]将不同亚型2A及内部核糖体结合位点IRES分别串联2~5个基因,构建单启动子多基因共表达的转座子,转染小鼠细胞后各基因均稳定共表达。表明结合转座子负载量大及高效整合的优势,应用2A串联多基因单转座子策略亦可实现外源基因的稳定协调共表达。
为研究PB转座子介导不同亚型药物代谢酶稳定共表达的最优方案,本研究采用上述2种多基因共表达策略,分别构建2种体系的多基因表达PB转座子,一种是单启动子联合2A串联表达的转座子,另一种为多个单基因转座子混合物,通过细胞转染、稳定筛选和多次传代培养后,检测其获得的抗性单克隆细胞中药物代谢酶mRNA、蛋白质及酶活性水平,并比较分析其差异,获得PB转座子介导不同亚型药物代谢酶稳定共表达的较优实验方案,为建立体外药物代谢及其肝毒性研究细胞模型奠定基础。
1 材料与方法
1.1 细胞和主要试剂
HepG2细胞购自中国科学院典型培养物保藏委员会上海细胞库。N端标记EGFP质粒(N terminal attachment of EGFP plasmid,pEGFP-N2,4.7 kb)由中国科学院广州生物医药与健康研究院惠赠;2A串联的重组CYP3A4和2C19 PB转座子质粒(pPBCYP3A4-2A-2C19,10.2 kb)由本实验室先前保存;DMEM培养基、胎牛血清、胰酶、青霉素-链霉素溶液及磷酸盐缓冲液(PBS)均购自美国Gibco公司;Lipofectamine®LTX和Neon®Transfection System购自美国Invitrogen公司;GenJetTMIn VitroDNA Transfection(Ver.Ⅱ)购自美国SignaGen公司;MTT(四甲基偶氮唑盐)购自广州齐云生物技术有限公司;RT-PCR试剂盒和qRCR试剂盒购自日本TaKaRa公司;兔抗人CYP3A4单克隆抗体、兔抗人CYP2C19单克隆抗体、兔抗人CYP2C8单克隆抗体、兔抗人β肌动蛋白单克隆抗体和辣根过氧化物标记山羊抗兔IgG二抗均购自英国Abcam公司。
1.2 质粒构建
PB转座子系统由PB供体质粒和辅助质粒构成(图1)。PB供体质粒(图1A,美国SBI公司)的CMV启动子下游存在多克隆位点,用于插入目的基因;EF1α启动子启动筛选标记GFP和Puro表达。人 CYP3A4 cDNA(Gene ID:1576),CYP2C19 cDNA(Gene ID:1557),CYP2C8 cDNA(Gene ID:1558),CYP2A6 cDNA(Gene ID:1548)和OATP1B1 cDNA(Gene ID:10599)分别扩增纯化回收,经NheI和NotI双酶切后克隆至PB供体质粒,获得重组转座子质粒〔pPB-CYP3A4,pPBCYP2C8,pPB-CYP2A6,有机阴离子转运多肽1B1的PB转座子(organic anion transporting polpeptide 1B1 PB transposon plasmid,pPB-OATP1B1)〕。辅助质粒表达转座酶super PB转座酶(即pPB-转座酶,图1B,美国SBI公司)。
1.3 piggyBac转座子高效转染HepG2细胞方法的建立
1.3.1 3种方法介导细胞转染和细胞分组
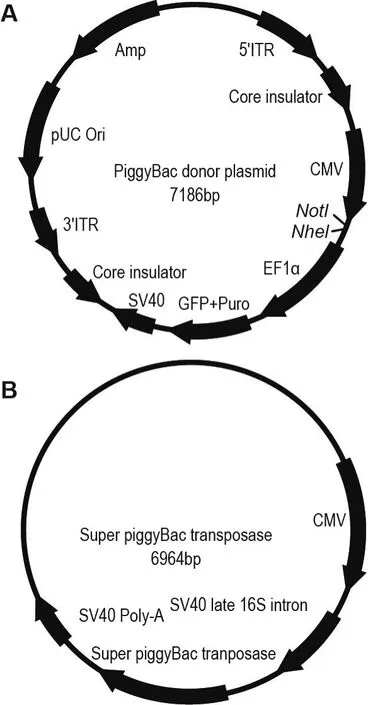
Fig.1 PiggyBac(PB)transposon system-piggy Bac donor plasmid(A)and helper plasmid(B).Amp:ampicillin;ITR:interted terminal repeat;CMV:cytomegalovirus;PUC Ori:PUC origin;EF1α:elongation factor 1alpha;GFP:green fluores⁃cent protein;Puro:puromycin;SV40:simian virus40.
Lipofectamine®LTX和GenJetTMIn VitroDNA Transfection Reagent(Ver.Ⅱ)介导转染:将1×105个细胞铺板至24孔培养板,24 h后细胞密度达80%~90%时准备转染。取1 μg质粒(pEGFP-N2、pPB-CYP3A4-2A-2C19,分别与 2.5 μL Lipo LTX Reagent和3 μL GenJetTMReagent转染试剂混合,进行HepG2细胞转染〔详细步骤参见Lipofectamine®LTX和GenJetTMIn VitroDNA Transfection Reagent(Ver.Ⅱ)Protocol〕。
Neon®Transfection System 电转:取1 μg质粒(pEGFP-N2或pPB-CYP3A4-2A-2C19)分别加至10 μL缓冲液R重悬的HepG2细胞悬液,混匀后转移至电转杯中进行电转,参数为1230 V、20 ms、3次脉冲;电转后移至预热的含10%胎牛血清、无抗生素DMEM培养基的24孔板中培养(详细步骤参见Neon®Transfection System Protocol)。
将转染HepG2细胞分为6组:pEGFP-N2+GenJet组,pEGFP-N2+Lipo组,pEGFP-N2+Neon®组,pPBCYP3A4-2A-2C19+GenJet组,pPB-CYP3A4-2A-2C19+Lipo组和pPB-CYP3A4-2A-2C19+Neon®组。
1.3.2 转染效率检测
3种方法分别介导小片段质粒pEGFP-N2和大片段重组质粒pPB-CYP3A4-2A-2C19转染HepG2细胞48 h后,倒置荧光显微镜下观察绿色荧光表达情况,并通过流式细胞仪(Guava easy Cyte HT system;Millipore,Bedford,MA,美国)检测转染效率。
1.3.3 MTT法测定细胞存活率
将细胞接种于96孔板中,待汇合度达80%~90%后进行转染。设置实验处理组、无质粒转染对照组(无质粒DNA)、阴性对照组(无任何处理细胞组)及调零组(无细胞组),各设5个复孔(n=5)。转染48 h后检测细胞活性。检测前弃旧液,每孔加入10 μL MTT 5 g ·L-1溶液,37℃、5%CO2温箱孵育4 h后向每孔加入100 μL DMSO,37℃振荡5 min使沉淀物溶解,选用SpectraMax M5多功能酶标仪(美国Molecular Devices,Sunnyvale,加拿大)测定490 nm处吸光度值(A490nm)。细胞存活率(%)=(实验组A490nm-调零组A490nm)(/阴性对照组A490nm-调零组A490nm)×100%。
1.4 两种多药物代谢酶基因转座子策略的HepG2细胞转染
采用1.3所获得的高效低毒转染方法,进行2种多基因转座子转染策略的比较。转染前1 d以每孔0.6×106个细胞铺板至6孔培养板,待细胞汇合度达80%~90%时进行转染。分别进行3组细胞转染实验。第一组:单基因转座子转染(1.5 μg pPB-CYP3A4和0.5 μg pPB转座酶共转染);第二组:2A串联多基因转座子转染(1.5 μg pPB-CYP3A4-2A-2C19和0.5 μg pPB转座酶共转染);第三组:多个单基因转座子混合物共转染(0.4 μg pPB-CYP3A4,0.4 μg pPB-CYP2C8,0.4 μg pPB-CYP2A6,0.3 μg pPBOATP1B1和0.5 μg pPB转座酶共转染)。
转染48 h后,采用无限稀释法进行单克隆细胞的筛选。将转染后的细胞每皿20~30细胞接种至10 cm细胞培养皿;并用含Puro 8 mg·L-1的DMEM完全培养基进行药物筛选,隔天更换培养基。连续加药筛选2周后,单克隆细胞集落开始形成。通过荧光倒置显微镜(日本Olypus IX71)观察并挑取表达绿色荧光的细胞克隆,进行单克隆细胞扩大培养并将其传代培养30次,以进行下一步的分析检测。
1.5 实时荧光定量PCR检测稳定转染细胞内代谢酶基因mRNA水平
收集3组PB重组转座子转染HepG2细胞并传代培养多次的抗性单克隆细胞,均按照TaKaRa MiniBEST Universal RNA Extraction Kit说明书提取RNA,逆转录合成cDNA。根据CYP3A4,CYP2C19,CYP2C8,CYP2A6和OATP1B1序列,利用Primer 5.0设计引物,引物见表1。采用SYBR Premix Ex TAqTMⅡ两步法扩增,以GAPDH作为内参照,进行3次独立重复实验。采用Light Cycler®96(瑞士Roche)实时荧光定量PCR仪进行qRT-PCR反应,反应体系:2×One Step SYBR-Ex taq 10 μL,上游引物 0.8 μL,下游引物 0.8 μL,cDNA 1 μL和ddH2O 7.4 μL。反应条件:95℃ 30 s;95℃5 s,60℃ 30 s,40个循环;95℃ 10 s,65℃ 15 s,95℃ 1 s。反应结束后,采用Light Cycler96 soft⁃ware(version 1.0.0.1240)进行数据分析,以各目标基因2-ΔΔCt值表示各目标基因mRNA相对表达水平。
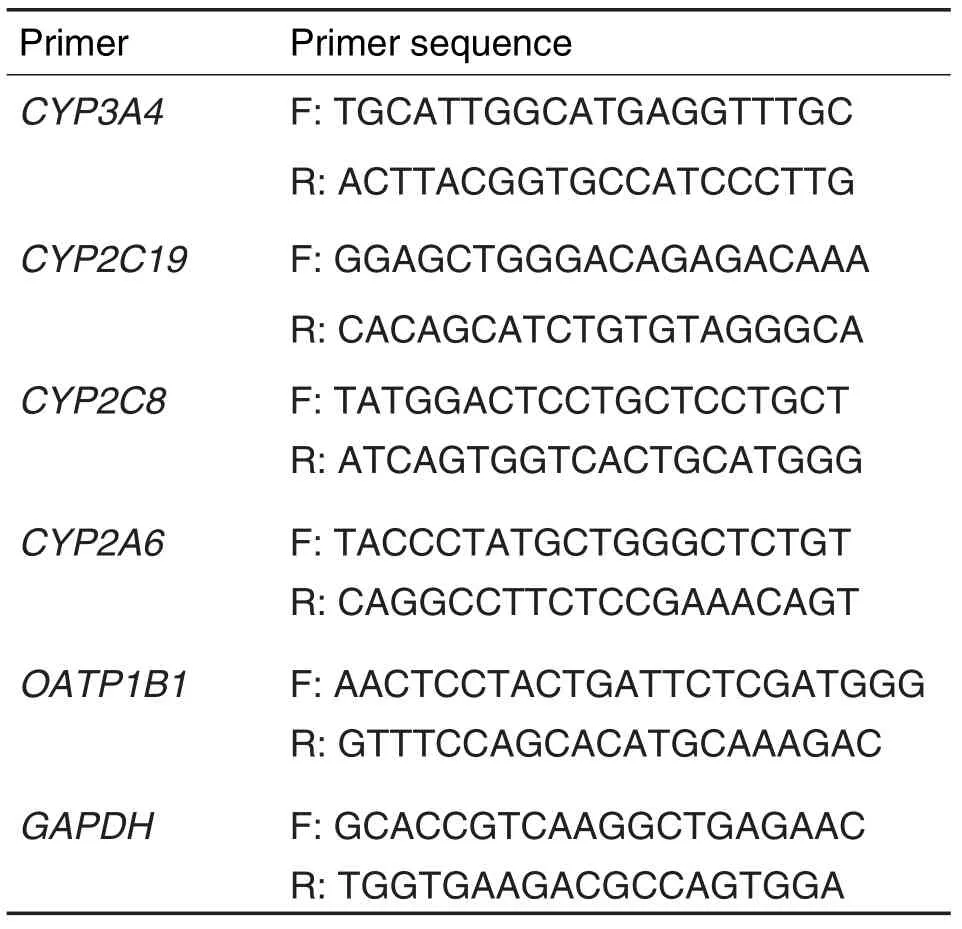
Tab.1 Primer sequence for real-time quantitative PCR
1.6 Western蛋白印迹法检测稳定转染细胞内代谢酶的表达
将3组PB重组转座子转染HepG2细胞并传代培养多次的抗性单克隆细胞弃去旧培养基,PBS清洗1次,RIPA裂解液裂解细胞提取总蛋白。经SDS-PAGE分离后转移至PVDF膜,以5%脱脂奶粉室温封闭2 h,TBST洗3次,每次10 min。分别加入相应兔抗CYP3A4,CYP2C19和CYP2C8单克隆抗体(1∶1000),4℃过夜,TBST洗3次,每次10 min。加入兔抗β肌动蛋白单克隆抗体(1∶1000),室温孵育90 min,TBST洗3次,每次10 min。然后加入辣根过氧化物酶标记山羊抗兔IgG二抗(1∶3000),室温孵育1 h,TBST洗3次,每次10 min。ECL显影,观察蛋白表达强度。用Image J分析软件对蛋白条带进行积分吸光度分析,以目标蛋白条带的积分吸光度值与对应的β肌动蛋白积分吸光度值的比值表示目标蛋白的相对表达水平。
1.7 LC-MS/MS检测稳定转染细胞内代谢酶活性
将3组PB重组转座子转染HepG2细胞并且传代30次的抗性单克隆细胞以每孔2×105接种到12孔,培养24 h后用PBS洗涤3次,分别加入100 μmol· L-1相应的药物工作液放置37℃温箱孵育1 h(睾酮检测CYP3A4,美芬妥因检测CYP2C19)。反应结束后,将细胞放入-80℃急冻10~20 min终止反应。快速解冻后将裂解液全部转移至1.5 mL离心管中,-80℃/37℃反复冻融3次,最后超声破碎20 min,充分裂解细胞。取小部分样品测定蛋白浓度,剩余样品全部通过LC-MS/MS测定对应代谢产物的量。将CYP3A4代谢产物6β-羟基睾酮、CYP2C19代谢产物4’-羟基美芬妥英和CYP2C8代谢产物N-脱乙基阿莫地喹分别经HPLC(NANO⁃SPACE 1312,日本)-MS/MS(加拿大Applied Bio⁃systems/MDS Sciex,Concord,ON)检测。流动相(A)为含0.1%甲酸的乙腈-水(体积比为5∶95),有机相(B)为含0.1%甲酸的乙腈-水(体积比为95∶5)。采用正离子扫描方式,多反应监测(MRM);质谱分析反应离子对分别为6β-羟基睾酮305.1/269.4,4’-羟基美芬妥英235.2/150.2,N-脱乙基阿莫地喹328.1/283.0和内标17α-羟基孕酮311.2/109.2。根据LC-MS/MS返回的数据,计算代谢产物的量(nmol),结合反应时间(min)和蛋白质总量(g)或细胞数(1×106细胞),计算代谢产物生成速率。
1.8 统计学分析
实验结果数据以±s表示,采用Origin7.5软件作图,以SPSS16.0统计软件进行分析,两组间比较采用t检验,多组间比较采用最小显著差异法(least-significant difference,LSD)检验,P<0.05认为差异具有统计学意义。
2.1.1 转染效率的比较
转染48 h流式细胞仪分析结果显示,介导pEGFP-N2转染HepG2细胞时,GenJetTM法获得的转染效率为(94.2±2.5)%,较Lipo®LTX法〔(84.1±1.3)%〕和Neon®电转法〔(81.4±1.0)%〕高(P<0.01)。介导pPB-CYP3A4-2A-2C19重组转座子质粒转染时,GenJetTM法转染效率为(89.3±3.3)%,显著高于Lipofectamine®LTX法〔(65.5±2.3)%〕和Neon®电转法〔(18.8±4.0)%〕的转染效率(P<0.01)(图2)。同时,荧光显微镜下观察细胞内绿色荧光表达情况也得到一致结果(图3)。
GenJetTM法转染大片段质粒pPB-CYP3A4-2A-2C19(10.1 kb)和小片段质粒pEGFP-N2(4.7 kb)至HepG2细胞的转染效率均可达90%左右,而Lipofectamine®LTX法和Neon®Transfection System电
2 结果
2.1 3种转染方法介导HepG2细胞基因转染的比较
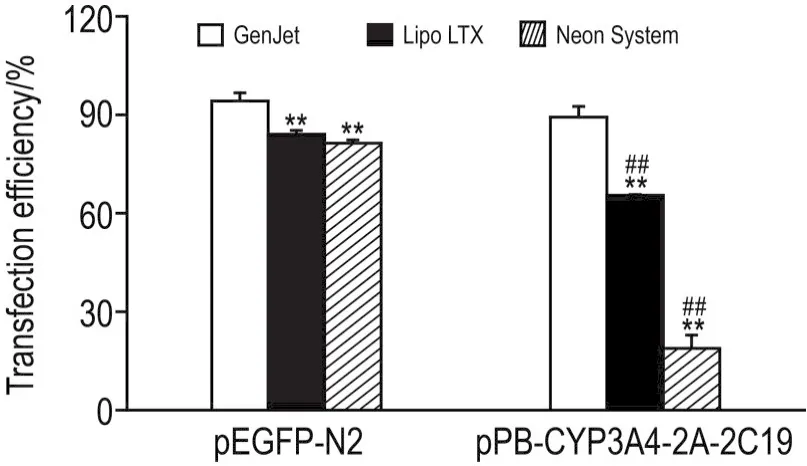
Fig.2 Transfection efficiency of HepG2 cells with different transfection methods.N-terminal attachment of enhanced GFP plasmid(pEGFP-N2)and 2A peptide linked recom⁃binant PB transponase plasmid containing dual-genes encoding drug metabolzing enzyme cytochrome P4503A4 (CYP3A4)and CYP2C19(pPB-CYP3A4-2A-2C19)were transfected into HepG2 cells respectively by Lipofectamine® LTX reagent(Lipo LTX),GenJetTM(Ver.Ⅱ)reagent and Neon® Transfection System(Neon System)reagent for 48 h.±s,n=3.**P<0.01,compared with GenJetTMgroup by LSD test;##P<0.01,compared with core⁃sponding treatment in pPEGFP-N2 group by t test.
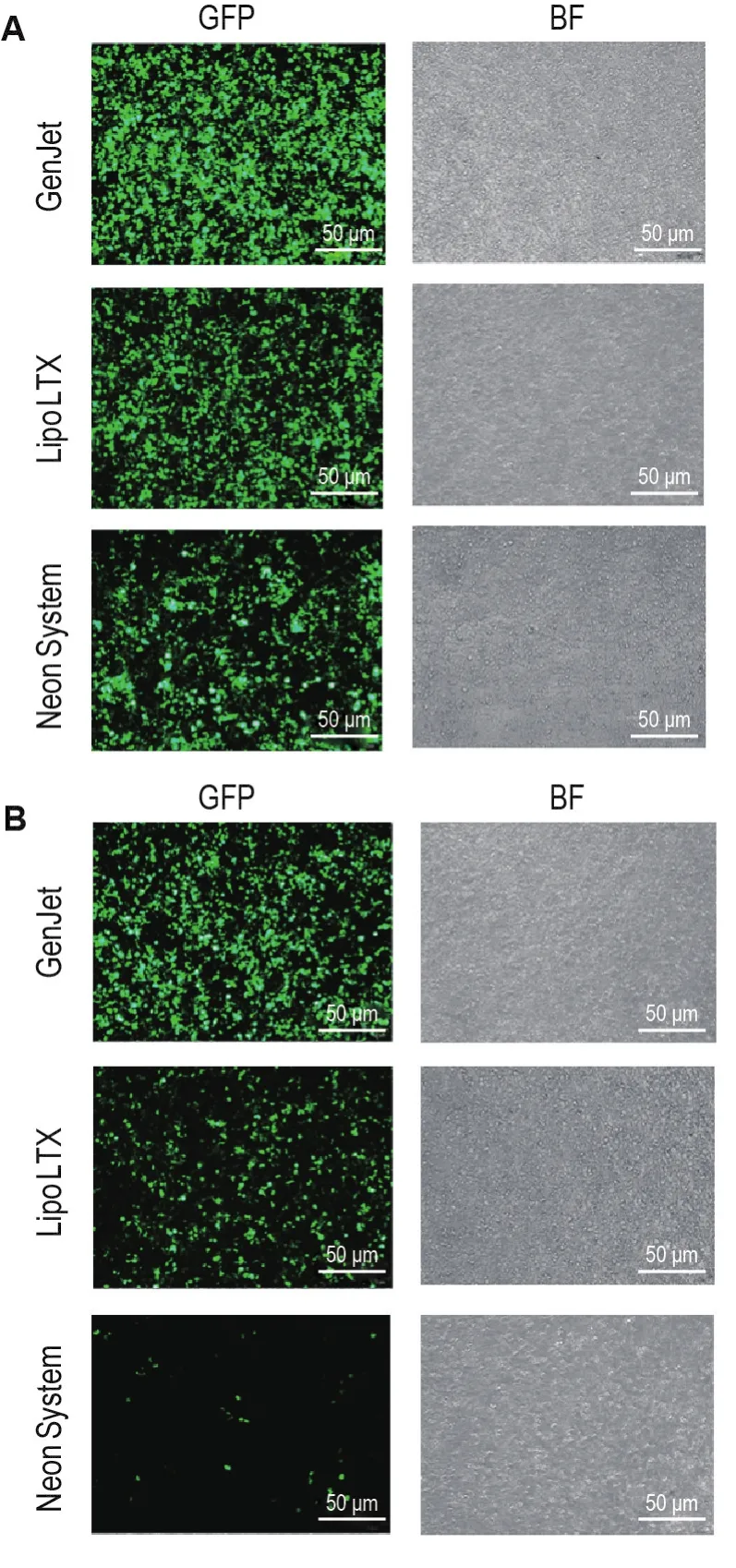
Fig.3 Fluorescent microscopy of HepG2 cells 48 h after transfection pEGFP-N2(A)and pPB-CYP3A4-2A-2C19(B).See Fig.2 for the treatment.BF:bright field.
转法介导大质粒pPB-CYP3A4-2A-2C19转染时转染效率均显著下降(P<0.01),且显著低于GenJetTM法(图2)。
2.1.2 细胞存活率的比较
MTT检测结果表明,介导pEGFP-N2质粒转染至HepG2细胞时,GenJetTM法细胞存活率显著高于Lipofectamine®LTX法(P<0.05),极显著高于Neon®Transfection System法(P<0.01);介导pPB-CYP3A4-2A-2C19重组转座子质粒转染至HepG2细胞时,GenJetTM法和Lipofectamine®LTX法细胞存活率无显著差异,但均高于Neon®Transfection System法(P<0.01)。无质粒转染组结果显示,Neon®Transfection System转染过程对细胞产生明显毒性(P<0.01)(图4)。
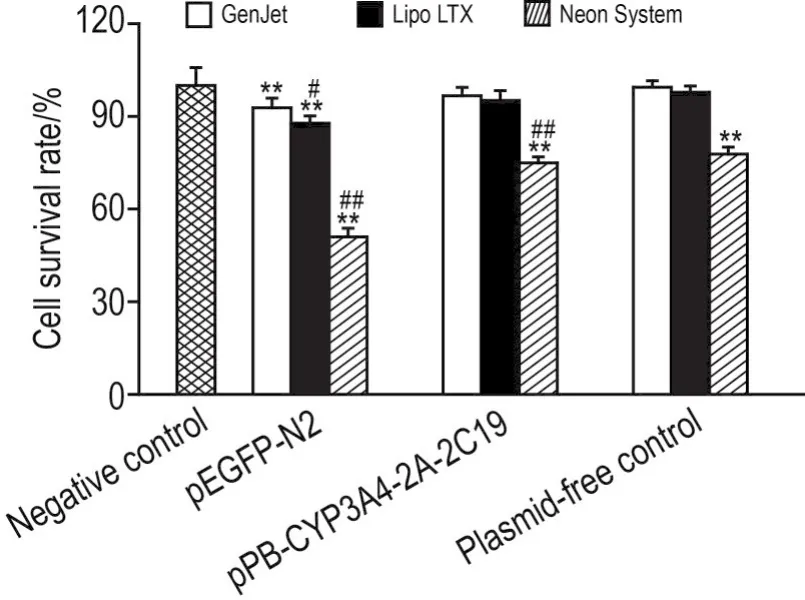
Fig.4 Viability of HepG2 cells with different transfec⁃tion methods.See Fig.2 for the treatment.±s,n=3.**P<0.01,compared with negative control group by t test;#P<0.05,##P<0.01,compared with GenJetTMgroup of each method by LSD test.
2.2 两种piggyBac转染方案介导药物细胞内代谢酶基因稳定表达的比较
2.2.1 不同转染方案对细胞内代谢酶mRNA表达的影响
qRT-PCR检测细胞中目的基因mRNA表达水平结果显示,与野生型HepG2细胞相比,单基因转座子组PB-CYP3A4转染获得的抗性单克隆细胞2号、3号和4号的CYP3A4水平均极显著升高(P<0.01)(图5A);2A串联多基因转座子组PB-CYP3A4-2A-2C19转染获得的抗性单克隆细胞19号、20号和21号的CYP3A4和CYP2C19 mRNA水平均明显增加(P<0.01)(图5B);多个单基因转座子混合物组(PB-CYP3A4,PB-CYP2C8,PB-CYP2A6和PB-OATP1B1)共转染获得的抗性单克隆细胞5号、7号和8号的CYP3A4和OATP1B1 mRNA水平均显著提高(P<0.01),7号和8号克隆CYP2C8 mRNA水平明显升高(P<0.01),5号、7号和8号克隆CYP2A6 mRNA水平均未升高(图5C)。
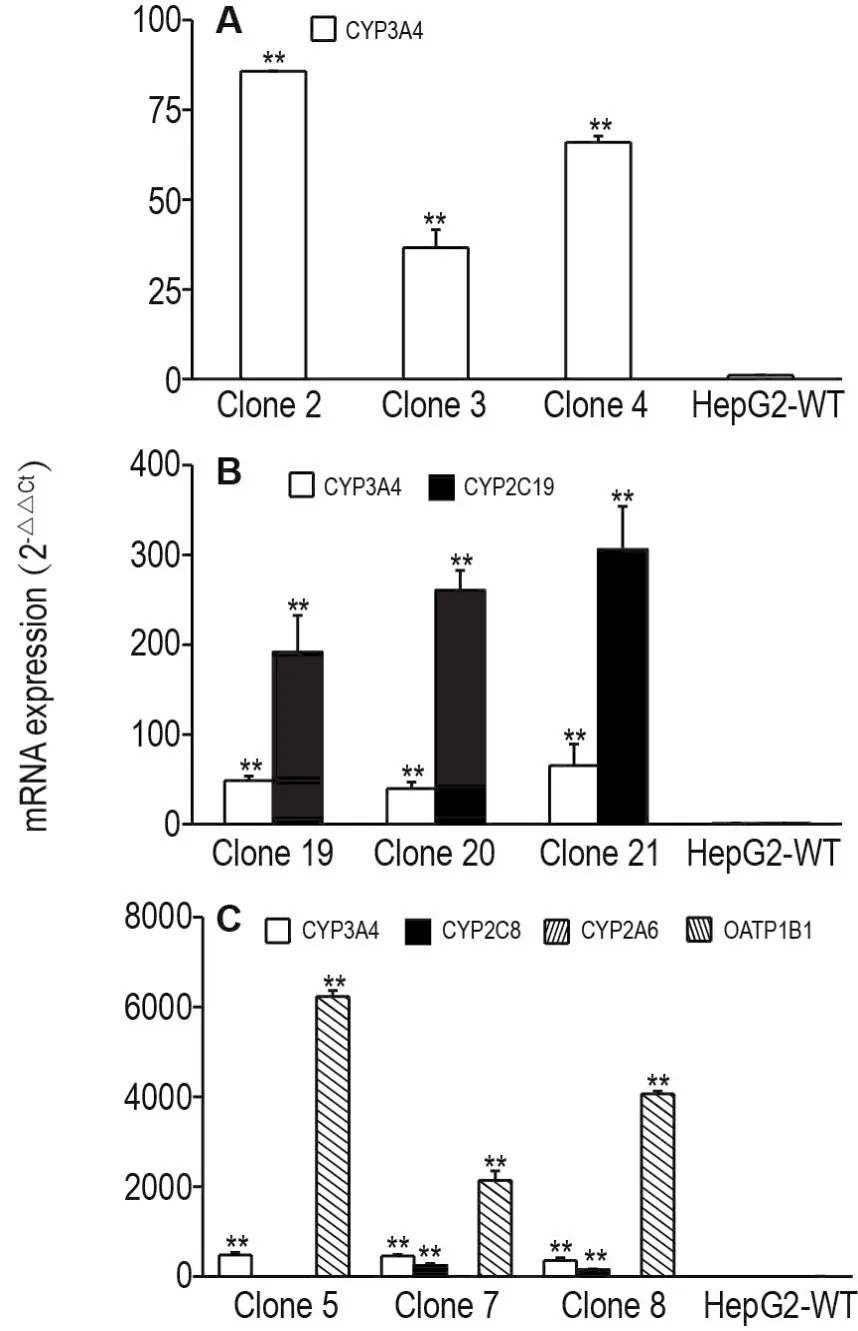
Fig.5 Relative expressions of drug-metabolizing enzyme genes mRNA CYP3A4,CYP2C19,CYP2A6,CYP2C8 and OATP1B1 in Puro-resistant cell clones by three piggy Bac(PB)recombinant transposons.A:single gene transposon(PB-CY3A4)transfection group;B:the 2A mediated multigene transposon(PB-CYP3A4-2A-2C19)transfection group;C:the mutiple single-gene transposon(PB-CYP3A4,PB-CYP2CB,PB-CYP2A6,PB-OATP1B1)transfection group.±s,n=3.**P<0.01,compared with HepG2-WT of each group by t test.
2.2.2 不同转染方案对细胞内代谢酶蛋白表达的影响
Western蛋白印迹结果显示,与HepG2野生型细胞相比,单基因转座子组PB-CYP3A4转染获得的抗性单克隆细胞2号、3号和4号CYP3A4蛋白表达显著升高(P<0.01)(图6A和6D);2A串联多基因转座子组PB-CYP3A4-P2A-CYP2C19转染获得的抗性单克隆细胞19号、20号和21号CYP3A4蛋白表达显著升高(P<0.01)(图6B1和6E),CYP2C19蛋白表达也明显增加(P<0.05,P<0.01)(图6B2和6E);多个单基因转座子混合物组PB-CYP3A4,PB-CYP2C8,PB-CYP2A6和PB-OATP1B1共转染获得的抗性单克隆细胞5号、7号和8号CYP3A4蛋白表达显著升高(P<0.01)(图6C1和6F),7号和8号细胞系CYP2C8蛋白表达显著升高(P<0.01)(图6C2和6F)。
2.2.3 不同转染方案中细胞内代谢酶活性的影响

Fig.6 Protein expressions of drug-metabolizing enzyme genes CYP3A4,CYP2C19,and CYP2C8 in Puro-resis⁃tant cell clones by three PB recombinant transposons.
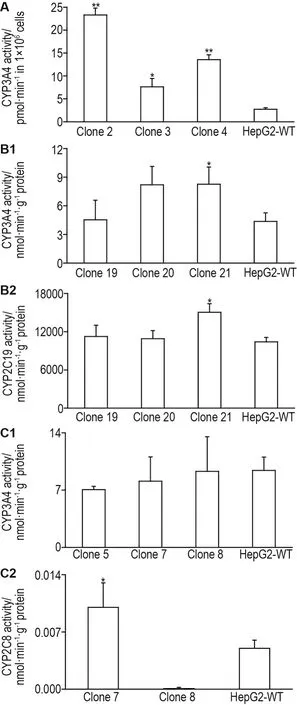
Fig.7 Metabolic rates of drug-metabolizing enzymes CYP3A4,CYP2C19 and CYP2C8 in Puro-resistant cell clones by three PB recombinant transposons.A:the single gene transposon(PB-CYP3A4)transfection group;B1 and B2:the 2A mediated multigene transposon(PB-CYP3A4-2A-2C19)transfection group;C1 and C2:the multiple single-gene transposon(PB-CYP3A4,PB-CYP2CB,PB-CYP2A6,PB-OATP1B1)transfection group.The activity of CYP3A4,CYP2C19 and CYP2C8 was showed by formation rate of 6β-hydroxytestosterone,4′-hydroxyme⁃phenytoin and N-desethylamodiaquine,respectively.±s,n=3.*P<0.05,**P<0.01,compared with HepG2-WT group by t test.
药物代谢酶代谢活性水平验证结果显示,单基因转座子组PB-CYP3A4转染获得的单克隆细胞的代谢产物6β-羟基睾酮生成速率均高于未转染细胞(P<0.05,P<0.01)(图7A);2A串联多基因转座子组PB-CYP3A4-2A-2C19转染获得的抗性单克隆细胞21号6β-羟基睾酮生成速率升高(P<0.05)(图7B1),而且4’-羟基美芬妥因生成速率也显著高于HepG2-WT细胞(P<0.05)(图7B2);多个单基因转座子混合物组(PB-CYP3A4,PB-CYP2C8,PBCYP2A6,PB-OATP1B1)共转染获得的抗性单克隆细胞5号、7号和8号6β-羟基睾酮生成速率与HepG2-WT细胞均无统计学差异(图7C1),7号N-脱乙基阿莫地喹生成速率高于HepG2-WT细胞(P<0.05)(图7C2)。
3 讨论
研究在前期成功获得PB转座子介导的单基因CYP3A4稳定高效表达HepG2细胞株基础上,本研究进一步探索PB转座子介导HepG2细胞不同亚型药物代谢酶稳定共表达的策略。由于多个基因共表达涉及到大片段DNA的细胞转染,与小片段DNA转染相比较,DNA片段增大时转染效率会显著下降。因此,为了获得较高的细胞转染效率,本研究首先针对HepG2细胞进行大片段DNA转染方法的比较。选取GenJetTM,Lipofectamine®LTX和Neon®Transfection System 3种转染方法将大小不同的质粒pEGFP-N2(4.7 kb)和重组转座子质粒pPB-CYP3A4-2A-2C19(10.2 kb)分别转染至HepG2细胞。转染效率检测显示,GenJetTM法介导小片段和大片段质粒转染时转染效率无统计学差异,分别高达(94.2±2.5)%和(89.3±3.3)%,其他2种方法介导大片段质粒转染时效率均明显下降;在细胞毒性方面,GenJetTM法毒性也较低。同时发现,本实验选取的3种方法转染pEGFP-N2质粒至HepG2细胞获得的转染效率均>80%,显著高于隋娟等[16]利用 Lipofectamine 2000 和电穿孔转染HepG2细胞的转染效率(分别为27.8%和51.5%)。因此,GenJetTM法可以成为PB转座子介导不同亚型药物代谢酶基因转染HepG2细胞的有效方法。
为探讨PB转座子介导HepG2细胞不同亚型药物代谢酶稳定共表达的策略。本研究采取2A串联多基因转座子以及多个单基因转座子共转染2种策略,分别将2A串联多基因转座子PB-CYP3A4-2A-2C19和多个单基因转座子混合物(PB-CYP3A4,PB-CYP2C8,PB-CYP2A6,PB-OATP1B1)转染至HepG2细胞,对2组获得的具有抗性且表达绿色荧光的单克隆细胞进行基因表达水平比较。结果显示,2A串联多基因转座子PB-CYP3A4-2A-2C19转染获得的阳性单克隆细胞中药物代谢酶基因CYP3A4和CYP2C19在mRNA和蛋白质水平均有显著增加且表达水平相当,表明2A能够有效切割上下游功能蛋白且对特征性底物具有代谢功能。相比之下,多个单基因转座子混合物(PB-CYP3A4,PBCYP2C8,PB-CYP2A6和PB-OATP1B1)共转染获得的抗性单克隆细胞中不同基因表达较随机,且不同基因产生共表达时其表达水平亦不一。Kahlig等[17]通过利用多个PB转座子共转染体外建立钠通道(SCN1A)细胞系时,也发现不同基因在蛋白表达水平不一。理论上可通过增加多种筛选标记提高多基因共表达,但多种药物会增加细胞毒性。如Balasubramanian等[18]研究发现,采用4个单基因转座子混合物共转染CHO细胞,进行多个药物筛选产生的细胞毒性明显高于单一药物筛选。因此,本研究表明2A串联多基因转座子的方案优于多个单基因转座子共转染。
本研究中,2A串联多基因单转座子组阳性单克隆细胞CYP3A4代谢产物生成速率(nmol· min-1·g-1蛋白,单克隆细胞20号:8.2±1.9;21号:8.3±1.8),低于单基因单转座子组的代谢速率。与其他类似质粒及病毒介导的代谢酶转基因肝细胞相比,代谢速率也较低[19]。而阳性克隆中CYP2C19的酶活性也稍低于其他方法介导的转基因肝细胞。但质粒及病毒介导的转基因研究大多为单基因表达或瞬时表达。同时,与已报道原代肝细胞CYP3A4的6β-羟基睾酮生产速率(0.22~7280 nmol·min-1·g-1蛋白,表达不稳定且个体差异较大)[20-21]相比较,本研究及其他方法介导转基因细胞中的代谢酶活性水平均较低。分析原因,可能在转基因细胞中尤其是多个基因稳定共表达的细胞中,单个细胞的总蛋白数量要远远高于未转染细胞,从而导致按照细胞总蛋白的量计算代谢产物的生产速率存在一定的误差。本实验前期研究也表明,用PB介导CYP3A4的细胞系中,药物代谢所引起的细胞毒性敏感性显著提高,可有效用于药物代谢肝毒性的相关评估研究[10]。
因此,在介导细胞内不同药物代谢酶基因稳定共表达研究中,转座子高效整合及负载量大的特点与2A串联的优势互补,可实现多个不同亚型药物代谢酶在细胞内的稳定协调共表达,将为药物代谢引起肝毒性的细胞水平研究及评估提供较理想的策略。
[1] Gómez-Lechón MJ,Tolosa L,Donato MT.Upgrading HepG2 cells with adenoviral vectors that encode drug-metabolizing enzymes:application for drug hepatotoxicity testing[J].Expert Opin Drug Metab Toxicol,2017,13(2):137-148.
[2] Nakamura K,Aizawa K,Aung KH,Yamauchi J,Tanoue A.Zebularine upregulates expression of CYP genes through inhibition of DNMT1 and PKR in HepG2 cells[J/OL].Sci Rep,2017,7:41093(2017-01-23).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5253741/
[3] Gómez-Lechón MJ,Tolosa L,Conde I,Donato MT.Competency of different cell models to predict human hepatotoxic drugs[J].Expert Opin Drug Metab Toxicol,2014,10(11):1553-1568.
[4] Xuan J,Chen S,Ning B,Tolleson WH,Guo L.Development of HepG2-derived cells expressing cytochrome P450s for assessing metabolism-asso⁃ciated drug-induced liver toxicity[J].Chem Biol Interact,2016,255:63-73.
[5] Zhang M,Sun XP,Song MJ.Research progress of using lentiviral vector to transgenic technology[J/CD].Chin J Clinicians(Ele Ed)〔中华临床医师杂志(电子版)〕,2014,8(10):1949-1953.
[6] Liu HH,Miao H,Ge MY,Wu CF.The activity of PB transposon in liver[J].J Sichuan Univ(Nat Sci Ed)〔四川大学学报(自然科学版)〕,2016,53(5):1130-1134.
[7] Du XH,Gao X,Zhang LP,Gao HJ,Li JY,Xu SZ.Integration sites and their characteristic analysis of PB transposon in cattle genome[J].Hereditas(遗传),2013,35(6):771-777.
[8] Bai DP,Fang K,Yang MM,Qu L,Chen YL.Inte⁃gration sites and their characteristic analysis of PB transposon in cashmere goat genome[J].Sci Agric Sin(中国农业科学),2012,45(5):958-965.
[9] Ding S,Wu X,Li G,Han M,Zhuang Y,Xu T.Efficient transposition of the PB(PB)transposon in mammalian cells and mice[J].Cell,2005,122(3):473-483.
[10] Huang L,Zou S,Deng J,Dai T,Jiang J,Jia Y,et al.Development of an optimized cytotoxicity assay system for CYP3A4-mediated metabolic activation via modified PB transposition[J].Toxicol In Vitro,2016,32:132-137.
[11] Wang Y,Wang F,Wang R,Zhao P,Xia Q.2A self-cleaving peptide-based multi-gene expression system in the silkwormBombyx mori[J/OL].Sci Rep,2015,5:16273(2015-11-05).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4633692/
[12] Liu W,Wang J,Xing YM,Li CZ,Chen CW,Zhao H,et al.Cotransfection of sox9 and LMP1 genes in rabbit bone mesenchymal stem cells through lentivirus vectorsin vitro[J].Chin J Tissue Eng Res(中国组织工程研究),2014,18(50):8054-8060.
[13] Sato M,Maeda K,Koriyama M,Inada E,Saitoh I,Miura H,et al.The PB-based gene delivery sys⁃tem can confer successful production of cloned porcine blastocysts with multigene constructs[J/OL].Int J Mol Sci,2016,17(9):1424(2016-08-30).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5037703/
[14] Huang H,Hu GD,Kang J,Qing SZ ,Zhang Y.Construction of a general PB transposon inducible cell immortalization vector and verifica⁃tion of its basic properties[J].Chin J Biotech(生物工程学报).2014,30(8):1182-1192.
[15] Zhang Y,Dai Z,Wu G,Zhang R,Dai Y,Li N.Expression of threonine-biosynthetic genes in mamma⁃lian cells and transgenic mice[J].Amino Acids,2014,46(9):2177-2188.
[16] Su J,Zhang GL,Li PF,Yu HC.Effect of lipofectin and electroporation transfection method on cells transfection efficiency of K562 and HepG2 cells[J].J Xinxiang Med Univ(新乡医学院学报),2015,32(8):698-701.
[17] Kahlig KM,Saridey SK,Kaja A,Daniels MA,George AL Jr,Wilson MH.Multiplexed transposonmediated stable gene transfer in human cells[J].Proc Natl Acad Sci USA,2010,107(4):1343-1348.
[18] Balasubramanian S,Wurm FM,Hacker DL.Multi⁃gene expression in stable CHO cell pools generated with the PB transposon system[J].Biotechnol Prog,2016,32(5):1308-1317.
[19] Frederick DM,Jacinto EY,Patel NN,Rushmore TH,Tchao R,Harvison PJ.Cytotoxicity of 3-(3,5-dichlo⁃rophenyl)-2,4-thiazolidinedione(DCPT)and ana⁃logues in wild type and CYP3A4 stably transfected HepG2 cells[J].Toxicol In Vitro,2011,25(8):2113-2119.
[20] Yoshitomi S,Ikemoto K,Takahashi J,Miki H,Namba M,Asahi S.Establishment of the transfor⁃mants expressing human cytochrome P450 subtypes in HepG2,and their applications on drug metabo⁃lism and toxicology[J].Toxicol In Vitro,2001,15(3):245-256.
[21] Fayer JL, Petullo DM,Ring BJ,Wrighton SA,Ruterbories KJ.A novel testosterone 6 beta-hydroxy⁃lase activity assay for the study of CYP3A-mediated metabolism,inhibition,and inductionin vitro[J].J Pharmacol Toxicol Methods,2001,46(2):117-123.

