浓香型白酒酿造用新型窖泥的初步研究
谢圣凯 ,崔凤娇 ,高大禹,许长山,陈建新
(1.江南大学生物工程学院,江苏无锡214122; 2.粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
传统浓香型白酒酿造多在窖池中[1]进行,因为窖泥中存在着己酸菌等功能微生物,其对浓香型白酒风味物质的产生具有重要作用[2],同时窖泥也可向酒醅中传输其发酵过程中积累的挥发性风味物质[3],但是,窖池中白酒发酵属于天然发酵[4],难以实现发酵过程的精准控制。
贵州钓鱼台国宾酒业将换热器插入窖池酒醅中,对发酵温度进行控制,结果发现,温度变化对酵母菌繁殖影响显著,有利于发酵进行[5]。罗冰等[6]通过将U型换热管埋入酒醅中控制发酵温度变化,对比非控温窖池发现,控温发酵也能够酿造出优良的浓香型白酒,可见控温发酵对于白酒酿造具有积极作用。但是窖池中插入换热装置控温相对麻烦,且不利于白酒机械化程度的提升。
随着经济快速发展,我国白酒行业日益走上了机械化发展的道路[7]。苏占元等[7]在生物反应器中进行白酒固态发酵,酿造出了优质浓香型白酒。刘念等[8]开发出了一种浓香型白酒发酵容器,将窖泥装在窖壁和窖底的夹层中,提高了白酒酿造的空间利用率。范伟国等[9]研制出了白酒固态发酵罐,将窖泥以挂片的方式敷设在反应器内壁上使用,且其罐体外壁夹套上装有冷媒,可以准确调控罐内酒醅发酵温度,从而解决盛夏温度过高导致酒厂停产的问题。但是,上述浓香型白酒发酵反应器存在的缺点为:(1)窖泥容易脱落进入酒醅中,导致白酒具有泥臭味;(2)黄泥载体窖泥黏附性强,不易取出,导致退化窖泥养护困难[10];(3)窖泥附着在罐壁上影响传热效果。
鉴于生物反应器酿造浓香型白酒仍需窖泥微生物的参与,本文旨在研究一种新型窖泥,将其装入特定装置中埋入酒醅发酵,可实现反应器的四周和底部进行换热,便于控制酒醅温度。另外,采用人为控制的方法能够促进窖泥老熟,本文通过对比不同材料作载体培养的窖泥理化和微生物学指标,最终选定一种合适的材料培养窖泥,从而为生物反应器酿造浓香型白酒提供理论参考。
1 材料与方法
1.1 材料
1.1.1 实验原料
窖泥a、窖泥b和窖泥c,某酒厂提供;粉末活性炭、颗粒活性炭,国药集团化学试剂有限公司。
1.1.2 菌株来源
产己酸菌XS1分离自某酒厂的白酒车间的窖泥中。
1.2 仪器与试剂
生化培养箱(BSP-250),上海博讯实业有限公司;MGC 2.5 L厌氧产气袋、MGC 2.5 L厌氧培养袋、氧气指示剂C-22,日本三菱公司;洁净工作台(VS-1300),苏州净化设备有限公司。
制霉菌素,生工生物工程(上海)有限公司。
1.3 方法
1.3.1 检测方法
(1)铵态氮测定:连续流动分析仪测定[11];(2)有效磷测定:Olsen法[12];(3)窖泥pH值测定:参考沈怡方的方法[13]。
1.3.2 产己酸菌计数[14]
液体样品计数:取1 mL液体样品与9 mL无菌生理盐水混合,低温振荡均匀后进行梯度稀释,选取稀释液涂布于RCM平板,快速放入厌氧培养袋(内含厌氧产气袋和氧气指示剂,厌氧产气袋在耗尽氧气的同时会产生大量的CO2,适合厌氧菌培养)中,37℃培养至菌落长出并计数。固体样品计数:取10 g窖泥于装有玻璃珠的90 mL无菌生理盐水中,低温振荡10 min,吸取1 mL溶液与9 mL无菌生理盐水混合,其余操作与液体样品计数相同。
1.3.3 好氧细菌计数[14]
液体样品细菌计数:取1 mL样品与9 mL无菌生理盐水混合,振荡均匀后进行梯度稀释,选取稀释液涂布LB平板,37℃培养至菌落长出并计数。固体样品细菌计数:取10 g窖泥于装有90 mL加有玻璃珠的无菌生理盐水中,低温振荡30 min,吸取1 mL溶液与9 mL无菌生理盐水混合,其余操作与液体样品细菌计数相同。
1.3.4 产己酸菌培养液扩大培养
吸取150 μL XS1菌液接种到装液量90%[15]的含有RCM液体培养基的50 mL三角瓶中,快速放入厌氧培养袋中,于37℃下培养2 d,之后依此类推在500 mL三角瓶中进行扩大培养。
1.3.5 窖泥培养工艺流程[16]
产己酸菌菌种→扩大培养→加入种子窖泥、黄水、酒糟浸出液、乙醇、大曲→复合功能菌液→加入黄泥、种子窖泥、大曲粉、豆饼粉、乙醇、麸皮、乙酸钠、磷酸氢二钾、黄水、干酒糟、酒糟浸出液、水→拌匀→37℃下密封发酵60 d。
2 结果与分析
2.1 产己酸菌液在窖泥培养中的运用
2.1.1 产己酸菌在窖泥培养中的性能测定(表1)

表1 人工窖泥微生物检测结果
由表1可知,不加种子窖泥、只加产己酸菌液培养的黄泥载体窖泥产己酸菌数量与添加种子窖泥、产己酸菌液培养的黄泥窖泥较为接近,这说明该产己酸菌培养窖泥是可行的。
2.1.2 选定培养窖泥的种子窖泥(表2)
由表2可知,对比含水率、铵态氮、有效磷、好氧细菌和产己酸菌数量可知,窖泥b产己酸菌数量和好氧细菌数量皆最高,其他3项指标也与窖泥a和窖泥c较为接近,故选定窖泥b作为种子窖泥培养窖泥。
2.1.3 选定培养窖泥的载体(表3)

表2 窖泥的理化和微生物学指标检测结果

表3 各种载体窖泥检测结果
结合表3、表2,对比窖泥产己酸菌数量可知,粉末活性炭载体窖泥>颗粒活性炭载体窖泥>石英砂载体窖泥>黄泥载体窖泥,并且粉末活性炭载体窖泥和颗粒活性炭载体窖泥产己酸菌数量皆大于窖泥b。分析窖泥好氧细菌数量可知,颗粒活性炭载体窖泥>粉末活性炭载体窖泥>石英砂载体窖泥>黄泥载体窖泥,且颗粒活性炭载体窖泥、粉末活性炭载体窖泥和石英砂载体窖泥好氧细菌数量皆大于窖泥b。
另外,对比铵态氮含量发现,颗粒活性炭、粉末活性炭载体窖泥铵态氮含量与窖泥b、窖泥c较为接近,比黄泥、石英砂载体窖泥铵态氮含量高,从而可为窖泥微生物生长提供所需的主要氮源[17]。
对比有效磷含量可知,粉末活性炭和颗粒活性炭窖泥有效磷含量比石英砂、黄泥载体窖泥高,结合微生物数量分析,这与窖泥中适量的有效磷等无机盐可为微生物繁殖提供营养的结论相符合[17]。
鉴于窖泥中厌氧菌的数量能反映出窖泥的质量[17],综上所述,发现粉末活性炭更适合作窖泥载体,但是,鉴于黄泥作为传统窖泥的载体由来已久,故进一步探索粉末活性炭与黄泥混合作载体培养窖泥的可行性,跟踪发酵过程中理化、微生物指标变化,并与黄泥单独载体窖泥和粉末活性炭单独载体窖泥进行对比。
2.1.4 粉末活性炭和黄泥混合载体窖泥实验(培养期间定期取样)(图1)

图1 产己酸菌数量变化
(1)培养期间各载体窖泥产己酸菌数量变化
图1可知,观察窖泥产己酸菌数量变化,粉末活性炭载体窖泥产己酸菌数量由开始的1.89×106cfu/g在培养时间为2 d时上升到7.81×108cfu/g窖泥,之后至发酵结束,产己酸菌数量在7.81×108~1.12×108cfu/g窖泥之间波动。分析各窖泥产己酸菌数量可知,粉末活性炭载体窖泥>黄泥、粉末活性炭混合载体窖泥>黄泥、粉末活性炭、颗粒活性炭混合载体窖泥≈黄泥载体窖泥。
(2)窖泥培养期间好氧细菌数量变化(图2)
由图2可知,发酵后期各载体窖泥好氧细菌数量较为接近,各载体皆适合好氧细菌生长。
(3)各载体窖泥培养期间含水率和pH值的变化(图3、图4)

图2 好氧细菌数量变化
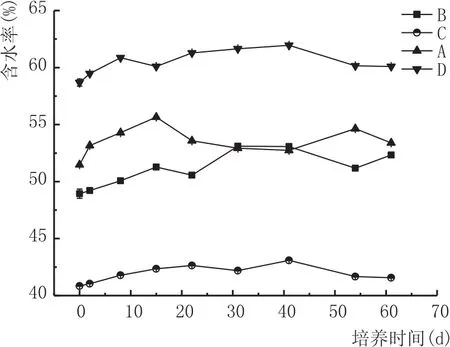
图3 窖泥含水率变化
由图3可知,各载体窖泥培养期间含水率波动不大,其中粉末活性炭载体窖泥含水率最高,黄泥载体含水率最低。由图4可知,黄泥载体窖泥在发酵22 d后pH值为4.4左右,之后至发酵结束基本波动不大;而其他3种载体窖泥发酵22 d后,pH值基为5.4以上,鉴于优质窖泥pH值一般处于5~7范围内[18],显然黄泥、粉末活性炭、颗粒活性炭混合载体,黄泥、粉末活性炭混合载体,粉末活性炭载体更适合微生物繁殖。综上所述,结合产己酸菌、好氧细菌、pH值指标分析,最终得出选择粉末活性炭作窖泥载体是合适的。
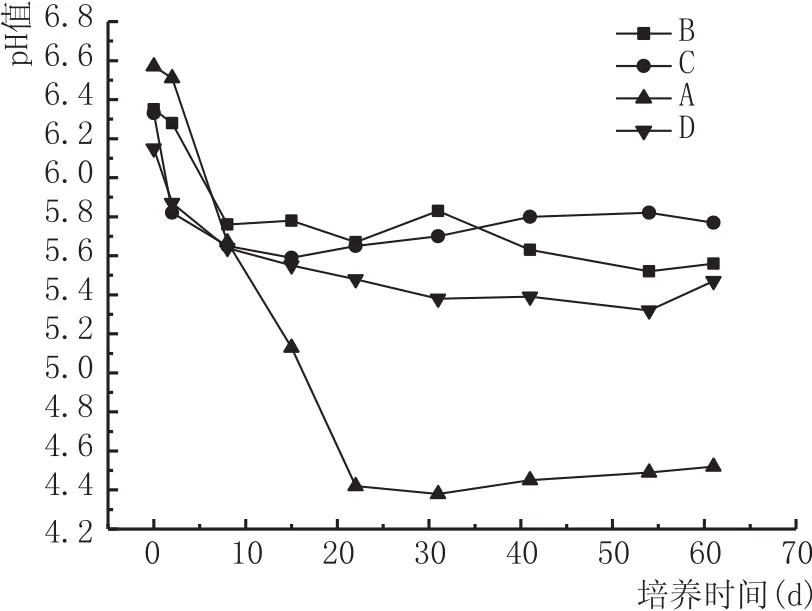
图4 窖泥pH值变化
2.1.5 粉末活性炭和黄泥混合载体窖泥实验(培养期间不取样)(表4)
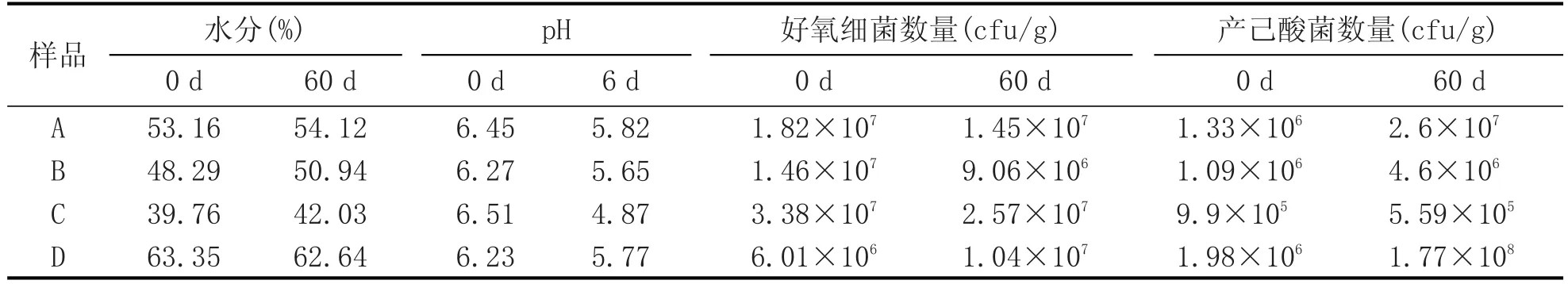
表4 各种载体窖泥检测结果
由表4可知,产己酸菌方面,只有黄泥载体窖泥培养60 d后产己酸菌数量低于初始水平,其他3种载体窖泥培养60 d后产己酸菌数量均高于初始值,尤以粉末活性炭载体窖泥产己酸菌数量增长幅度最大,结合表2可知,其比窖泥b产己酸菌数量更高。对比窖泥好氧细菌数量可得,发酵60 d后,黄泥载体窖泥>黄泥、粉末活性炭、颗粒活性炭混合载体窖泥>粉末活性炭载体窖泥>黄泥、粉末活性炭混合载体窖泥。观察pH值发现,发酵结束后的黄泥载体窖泥pH4.87,而其他3种窖泥pH值都处于5~7之间,更有利于微生物的繁殖。含水率方面,窖泥培养初始和培养60 d后含水率起伏不大,其中黄泥载体窖泥含水率最低,粉末活性炭窖泥含水率最高。另外,对比图1可知,取样操作确实对各种人工窖泥培养造成了不同影响,但是粉末活性炭载体窖泥产己酸菌数量受取样影响最小,可见粉末活性炭稳定性也较好。
另外,实验发现,黄泥载体窖泥、黄泥+粉末活性炭+颗粒活性炭混合载体窖泥和黄泥+粉末活性炭混合载体窖泥相比,粉末活性炭载体窖泥黏附性更强,不具有灵活的形状可塑性,综上所述,最终选择粉末活性炭作载体培养窖泥。
3 结论
将高产己酸的XS1菌株分别运用到黄泥、石英砂和活性炭载体窖泥的培养,发现粉末活性炭材料最适合作为窖泥培养的载体。其窖泥中产己酸菌数量相比黄泥载体窖泥、石英砂载体窖泥、颗粒活性炭载体窖泥、黄泥+粉末活性炭载体窖泥、黄泥+粉末活性炭+颗粒活性炭载体窖泥都要高,发酵时间为60 d的窖泥中产己酸菌数量能达到7.91×108cfu/g窖泥,且受外界因素影响波动小;窖泥发酵60 d后的好氧细菌数量能达到1.04×107cfu/g窖泥,其窖泥pH值基本处于5~7之间,符合优质窖泥的要求,有利于窖泥功能微生物的繁殖;其窖泥铵态氮含量、有效磷含量都与各酒厂窖泥接近,能够满足微生物的生长所需的氮源和无机盐成分。同时,粉末活性炭窖泥相比其他载体窖泥具有更好的形状可塑性,适合在固定装置中填装使用,这样窖泥不会脱落到酒醅中,窖泥养护较为便捷,也不会影响传热,同时,粉末活性炭材料成本低,耐酸碱,化学性质稳定,具有较大的比表面积,有利于固定微生物[19]。
鉴于窖泥和酒醅中微生物繁多,反应机制复杂,本文只是专注于窖泥中产己酸菌和好氧细菌的研究,这具有一定的局限性,故还需深入研究窖泥和白酒发酵相关机理。另外,粉末活性炭载体窖泥在生物反应器中使用的最佳方式、实际使用效果还有待深入研究。
[1]任剑波,姚万春,唐玉明,等.不同材质窖池的酒醅微生物分布差异[J].酿酒,2015,42(5):22-25.
[2]范文来,徐岩.白酒窖泥挥发性成分研究[J].酿酒,2010,37(3):24-31.
[3]蔡鹏飞,邵传贞,姚庆乐,等.窖泥在酿酒中的两个作用[J].酿酒,2011,38(5):59-61.
[4]郎召伟.泸型酒酿造过程中风味物质变化分析[D].无锡:江南大学,2015.
[5]邹明鑫,吴凤智,高文龙.温度控制下浓香型白酒窖池温度变化及酵母数量变化趋势研究[J].食品与发酵科技,2015,51(2):82-86.
[6]罗冰.控温发酵对浓香型白酒品质变化趋势的研究[J].酿酒科技,2014(1):108-114.
[7]苏占元,张良,张宿义,等.生物反应器中糟醅发酵动态的研究[J].酿酒科技,2015(6):61-64.
[8]刘念,王超凯,彭奎,等.浓香型白酒发酵容器:CN202401048U[P].2012-08-29.
[9]范伟国,乔新建,庞相国,等.白酒固态发酵罐:CN102586054A[P].2012-07-18.
[10]苏占元,张宿义,周海燕,等.新型动态固态生物发酵反应器的研究及应用进展[J].酿酒科技,2014(10):82-84.
[11]CROOKE W M,SIMPSON W.Determination of ammonium in Kjeldahl extracts of crops by an automated procedure[J].Journal of the science of food and agriculture,1971(22):9-10.
[12]OLSEN S R.Estimation of available phosphorus in soils by extraction with sodium bicarbonate[R].Washington:United States Department of Agriculture,1954.
[13]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:642.
[14]熊君燕,李小东,陈建新,等.清香型白酒中乳酸菌和酵母菌的相互作用[J].微生物学通报,2017,44(8):1767-1776.
[15]彭兵,祝熙,张部昌,等.窖泥高产己酸菌分离鉴定及培养条件优化的研究[J].中国酿造,2016,35(5):43-46.
[16]姚万春,唐玉明,刘淼,等.功能性人工窖泥培养配方筛选研究[J].中国酿造,2014,33(8):63-66.
[17]侯银.林分结构对杨树人工林土壤微生物多样性的影响[D].南京:南京林业大学,2013.
[18]景晓卫,唐玉明,姚万春,等.人工老窖发展及其研究现状[J].酿酒科技,2010(9):77-80.
[19]周仁忠,王建忠,刘宏媛,等.固定化窖泥功能微生物电镜表征观察及连续产酸性能的研究[J].酿酒,2012,39(2):79-84.

