补充碳酸氢钠对男子篮球运动员高强度间歇训练生理应激和运动能力的影响
范朋琦, 彭庆文
(1.天津天狮学院,天津 301700 ;2.怀化学院体育学院,湖南 怀化 418008)
高强度运动时机体以无氧代谢为主,体内氢离子(H+)堆积并造成代谢性酸中毒。H+浓度升高可降低糖酵解效率、破坏肌肉收缩功能,进而影响运动员的运动能力,其机制可能与抑制代谢酶、降低Ca2+敏感性或直接干扰肌动蛋白功能等因素有关。高强度运动诱导出现内环境稳态失衡后,机体可通过缓冲系统和通气反应进行调节。此外,通过长期运动适应可提高机体的缓冲能力以及对pH值的调节能力。近年来的研究发现,营养学手段亦可调节酸碱平衡,例如补充碳酸氢钠(sodium bicarbonate,NaHCO3)可增加机体碳酸氢盐(HCO3)(一种缓冲系统)储备,进而对运动诱导的酸中毒起缓解作用,其机制可能是通过缓冲无氧酵解产生的过量H+以及加速运动肌中H+和乳酸清除而降低代谢性酸中毒的程度。有证据显示,运动前摄入NaHCO3可改善田径、游泳、自行车、篮球等项目运动员以及部队战士的运动表现[1-4],这一效果在高强度间歇训练实验中也得到了印证[5, 6]。尽管大量研究证实NaHCO3具有抗酸效应,但仍有一些报道发现NaHCO3在升高体液pH值的同时并未改善运动员的运动能力[7-9],Peart等[10]综合了多项研究(Meta-分析)后对NaHCO3的作用提出质疑并指出运动员应谨慎使用。对于运动能力而言不同研究的结果存在矛盾,但所有实验均证实摄入NaHCO3可维持pH值接近稳态水平,并于运动后数分钟内恢复酸碱平衡稳态[11]。因此,仍有必要深入探讨补充NaHCO3对机体生理功能和运动能力的影响以及对运动诱导的机能紊乱是否具有积极作用。
最近的研究较多关注运动前补充NaHCO3与运动应激反应之间的关系。Peart等[12]发现,运动前碱中毒(摄入NaHCO3)能够下调细胞应激标志物——热休克蛋白72(heat shock protein 72,HSP72)的基因表达并同时降低脂质过氧化。由于酸中毒是造成细胞应激反应的重要诱因,因此推测HSP72下调可能与NaHCO3诱导的缓冲能力增强有关。此外,氧化应激能够上调HSP72表达,而肌肽(与NaHCO3均具有缓冲效应)具有抗氧化作用[13],因此推测NaHCO3下调HSP72表达很可能是通过加速清除活性氧(reactive oxygen species,ROS)介导的。上述研究通过硫巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)分析测定脂质过氧化并作为运动氧化应激的参数,但实验方法学研究指出,TBARS并不能完全代表脂质过氧化[14]。因此,采用更为精确的方法测定氧化应激标志物,如总抗氧化能力(total anti-oxidant capacity,TAC)和谷胱甘肽氧化还原状态(redox status of glutathione)等,对于重新审视NaHCO3与运动应激的关系显得尤为重要。Wahl等[15]报道,补充NaHCO3后进行高强度无氧运动时循环应激激素(皮质醇、生长激素等)水平显著下降,但该研究未对这一现象的相关机制进行进一步探索。此外,该研究并未设立对照组(即安慰剂组)、未涉及氧化应激参数的变化且主要目的是观察补充NaHCO3对运动能力的影响。鉴于此,有必要从多个层面探究应激反应(应激蛋白、应激激素、氧化应激和细胞因子等)的变化进而揭示运动前碱中毒对运动应激的影响及机制。因此,本研究的目的旨在观察运动前碱中毒(补充NaHCO3)对男子篮球运动员高强度间歇训练时单核细胞HSP72基因表达、血浆应激标志物以及运动能力的影响,探讨补充NaHCO3在运动员训练中的作用及机制。
1 对象和方法
1.1 研究对象
25名青年男子篮球运动员(年龄18~23岁,国家二级运动员)自愿参加本实验。所有受试者身体健康,无急慢性疾病,无烟酒嗜好,近期无运动性伤病、服用药物和营养补剂。测试前48 h嘱受试者清淡(低脂)饮食,禁止摄入引起pH值波动的食物和饮料,禁止剧烈运动。实验前告知其注意事项和运动风险并签订知情同意书。受试者一般特征见表1。
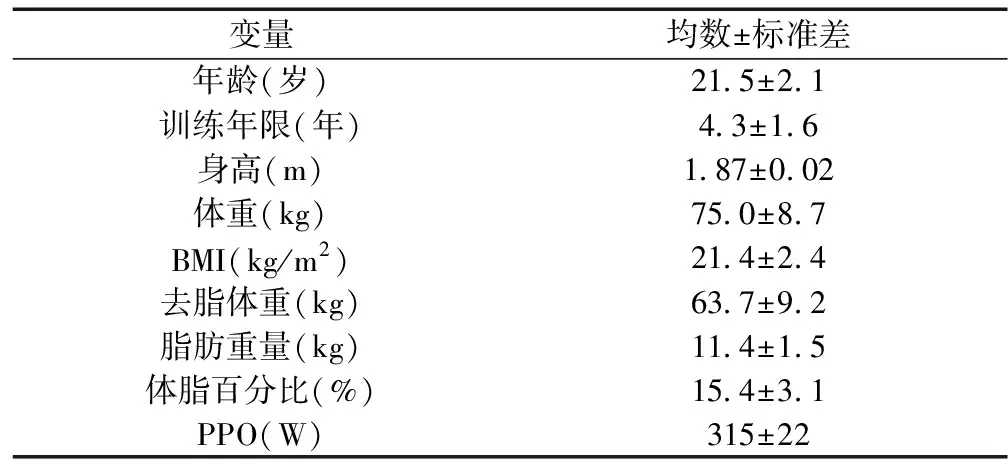
表1 受试者一般特征
注:PPO,峰值功率输出(peak power output)
1.2 实验设计
受试者分3次完成所有测试,每次间隔1周,测试时间均在上午7:00进行以避免生物节律的影响[16]。第1次:熟悉实验室环境、测试程序以及电动功率自行车的使用,利用递增负荷力竭运动实验测定受试者的峰值功率输出(peak power output,PPO)。第2~3次:以随即和双盲的方式分别摄入NaHCO3和安慰剂(Placebo)后进行一次高强度间歇训练。分别于摄入前、摄入后60 min(即训练前)、训练后即刻以及训练后10 min取动脉血测定酸碱平衡参数(pH值、HCO3、碱过量、[H+]和乳酸),用含有100 μl肝素的血气毛细管收集全血并迅速盖紧并用血气分析仪(ABL80,丹麦)进行血气分析;分别于训练前、训练后即刻、训练后90 min和180 min取肘前静脉血测定血浆应激标志物含量以及单核细胞HSP72表达量。
1.3 形态学测量
采用体质检测组件测定受试者身高、体重并计算身体质量指数(body mass index,BMI)。利用体成分仪(Inbody 570,韩国)测定身体成分,于清晨空腹状态下并排空大小便后测定,检测指标包括去脂体重、脂肪重量和体脂百分比。
1.4 PPO测试
正式开始实验前先利用电动功率车(Monark 839E,瑞典)进行递增负荷运动力竭实验测定受试者的PPO。先以50 W负荷热身5 min,随后每min递增30 W,保持60 转/分(revolutions per minute,RPM)蹬车速度,直至力竭。记录PPO并作为高强度间歇训练制定负荷的依据。
1.5 NaHCO3摄入实验
嘱受试者于实验前禁食至少8 h。补充NaHCO3时,剂量为0.3 g/kg体重(约15~20粒明胶胶囊),用500 mL水在10 min内摄入;补充Placebo时,将氯化钠(sodium chloride,NaCl)以0.045 g/kg体重(胶囊中加入面粉后与NaHCO3胶囊等重)摄入,摄入方式同NaHCO3实验。
1.6 一次高强度间歇训练
根据Siegler等[17]的建议,摄入实验结束后60 min进行一次高强度间歇训练,先以50 W负荷热身5 min,随后以120%PPO负荷蹬车至力竭,间歇2 min(间歇期进行积极性恢复,即以50 W负荷继续蹬车),重复4组。力竭标准:口头鼓励后仍不能维持60 RPM转速达10 s以上。记录力竭时间和做功量作为运动能力参数。
1.7 应激标志物测定
单核细胞HSP72表达量用流式细胞仪(EPICS-XLⅡMCL,美国)测定。血浆白细胞介素6(interleukin-6,IL-6)、IL-8和皮质醇用酶标仪(BIO-RAD Model 680,美国)以酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)测定。
氧化应激参数包括脂质过氧化、TAC和谷胱甘肽氧化还原状态,用血浆TBARS含量代表脂质过氧化,用Trolox当量反映TAC,测定总谷胱甘肽(total glutathione,TGSH)和氧化型谷胱甘肽(oxidised glutathione,GSSG)含量后以GSSG/TGSH比值代表谷胱甘肽氧化还原状态。严格按照试剂盒说明进行操作。
1.8 统计学处理
所有数据均以“均数±标准差”表示,用SPSS 20.0统计软件包对数据进行分析处理。补充Placebo与补充NaHCO3实验比较采用配对t检验;不同采血时间点的比较使用重复测量的方差分析,多重比较使用LSD检验。P<0.05定为具有统计学差异。
2 结果
2.1 运动能力的变化
与第1组比较,完成第2、3、4组运动时的做功量和力竭时间均显著性下降(P<0.05)。与补充Placebo比较,补充NaHCO3在各时间点做功量和力竭时间均无显著性差异(P>0.05)。将完成所有运动的做功量和力竭时间取均值后发现,补充Placebo和补充NaHCO3平均做功量和平均力竭时间均无显著性差异(P>0.05)。见图1~2。

图1 补充Placebo和补充NaHCO3做功量的比较注:与第1组比较;*P<0.05

图2 补充Placebo和补充NaHCO3力竭时间的比较注:与第1组比较;*P<0.05
2.2 酸碱平衡的变化
与摄入前比较,摄入后60 min,补充NaHCO3时pH值、HCO3和碱过量增加(P<0.05),而[H+]下降(P<0.05),补充Placebo时各指标均无显著性差异(P>0.05);摄入后60 min时与补充Placebo比较,补充NaHCO3时pH值、HCO3和碱过量增加(P<0.05),[H+]下降(P<0.05)。与训练前(即摄入后60 min)比较,训练后即刻和训练后10 min,补充Placebo和补充NaHCO3时pH值、HCO3和碱过量均降低(P<0.05),而[H+]和乳酸均升高(P<0.05);训练后即刻和训练后10 min与补充Placebo比较,补充NaHCO3时pH值、HCO3和碱过量升高(P<0.05),[H+]降低(P<0.05),乳酸则无显著性差异(P>0.05)。见表2。
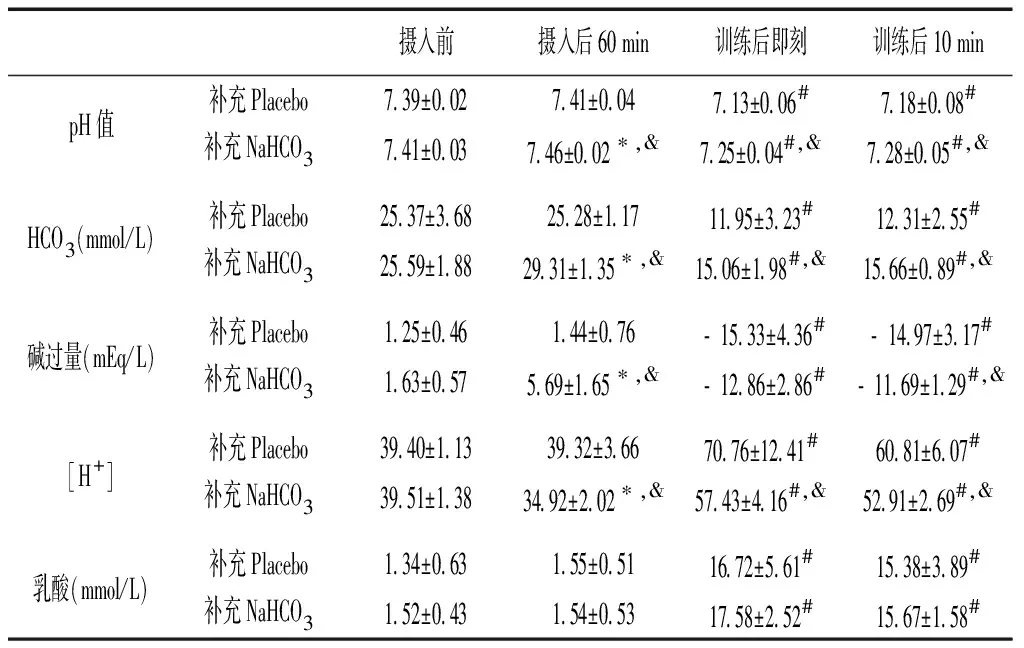
表2 补充Placebo和补充NaHCO3酸碱平衡的变化
注:与摄入前比较,*P<0.05;与摄入后60 min(即训练前)比较,#P<0.05;与补充Placebo比较,&P<0.05
2.3 氧化应激的变化
与训练前比较,补充Placebo血浆TBARS在训练后即刻、训练后90 min和训练后180 min均显著性升高(P<0.05),补充NaHCO3在训练后各时间点均无显著性变化(P>0.05)。与补充Placebo比较,补充NaHCO3时血浆TBARS在训练后各时间点均显著性降低(P<0.05)。组间与组内比较,血浆TAB和GSSG/TGSH均无显著性变化(P>0.05)。见图3~5。
2.4 单核细胞HSP72表达的变化
与训练前比较,补充Placebo单核细胞HSP72表达量在训练后即刻、训练后90 min和训练后180 min均显著性升高(P<0.05),补充NaHCO3在训练后各时间点均无显著性变化(P>0.05)。与补充Placebo比较,补充NaHCO3时单核细胞HSP72表达量在训练后各时间点均显著性降低(P<0.05)。见图6。
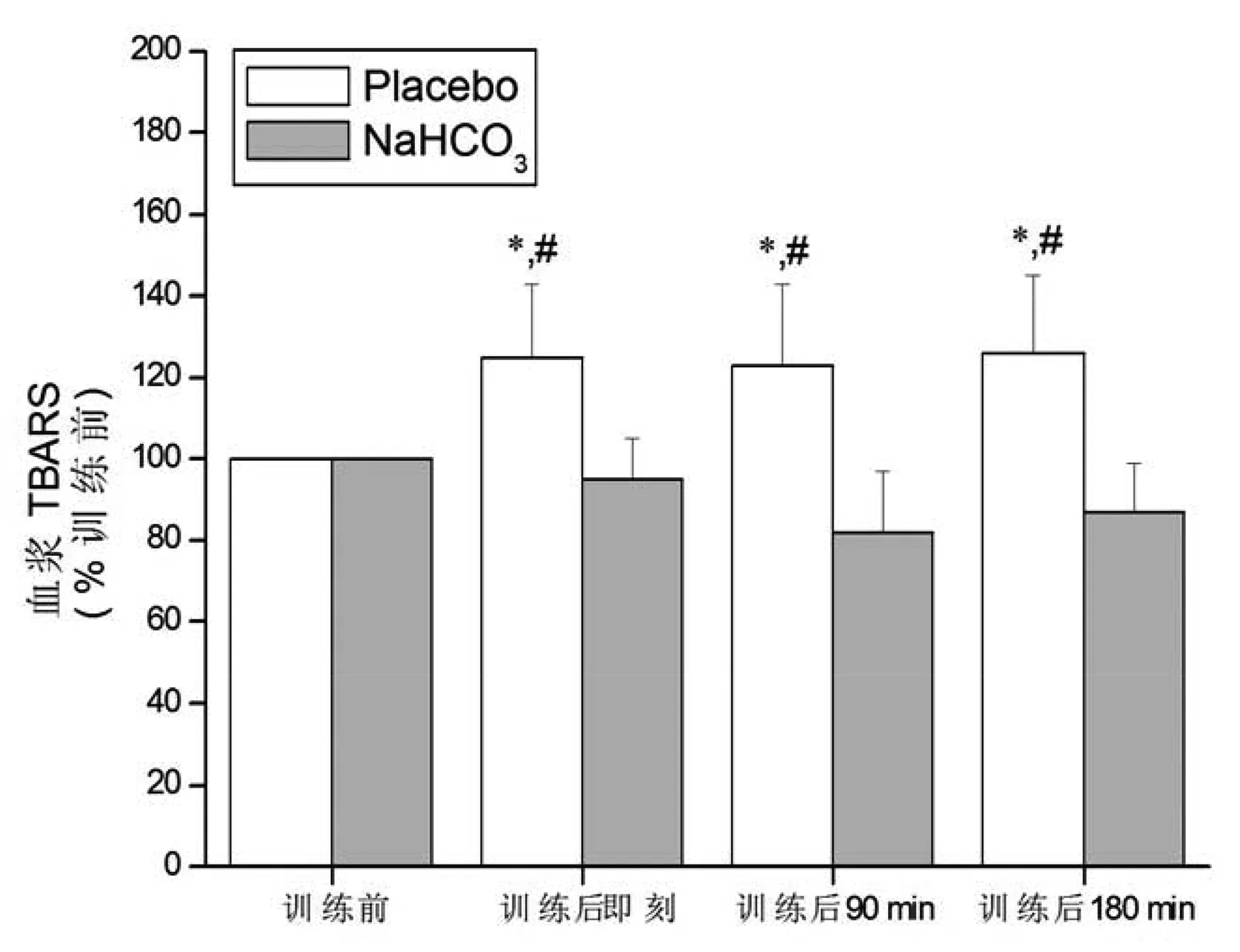
图3 补充Placebo和补充NaHCO3血浆TBARS的比较注:与训练前比较;*P<0.05;与补充NaHCO3比较;#P<0.05

图4 补充Placebo和补充NaHCO3血浆TAB的比较
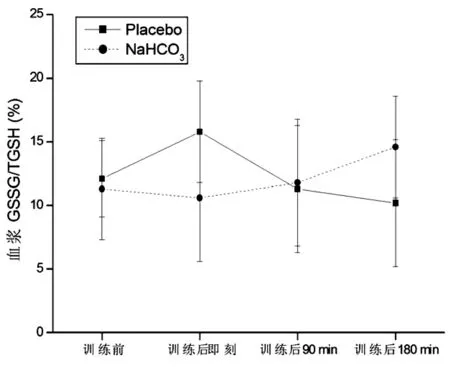
图5 补充Placebo和补充NaHCO3血浆GSSG/TGSH的比较

图6 补充Placebo和补充NaHCO3单核细胞HSP72表达的比较注:与训练前比较;*P<0.05;与补充NaHCO3比较;#P<0.05
2.5 血浆皮质醇和细胞因子的变化
与训练前比较,补充Placebo和补充NaHCO3时血浆皮质醇在训练后即刻和训练后90 min无显著性差异(P>0.05),训练后180 min显著性下降(P<0.05)。与补充Placebo比较,补充NaHCO3时血浆皮质醇在训练前后各时间点均无显著性差异(P>0.05)。见表3。
血浆IL-6含量只有5名受试者检出,血浆IL-8均未检出。与训练前比较,补充Placebo和补充NaHCO3时血浆IL-6在训练后90 min和训练后180 min升高(P<0.05)。与补充Placebo比较,补充NaHCO3时血浆IL-6在训练后90 min和训练后180 min降低(P<0.05)。见表3。

表3 补充Placebo和补充NaHCO3血浆皮质醇和IL-6的变化
注:@n=5;与训练后180 min比较;*P<0.05;与训练前比较;#P<0.05;与补充Placebo比较,&P<0.05
3 讨论
本研究的主要发现是,高强度间歇训练可上调细胞内HSP72表达并增加血浆TBARS含量,但血浆皮质醇、IL-6、IL-8及氧化应激标志物并未发生明显改变。摄入NaHCO3(0.3 g/kg体重)虽未改善运动能力,但显著下调细胞内HSP72表达量,其机制可能与维持训练前后的酸碱平衡状态有关。
运动诱导的氧化应激反应是一把双刃剑,即运动刺激产生适量的ROS可作为信号物质促进机体对训练的反应和适应,而过量的ROS则通过过氧化反应破坏细胞结构、损害细胞功能,甚至造成凋亡和坏死,从而对运动能力和身体健康造成负面影响。研究证实[18],高强度训练后脂质过氧化反应增强,这一过程可被运动前碱中毒抑制或缓解。本研究同样证实,补充placebo实验中血浆TBARS含量显著升高,而补充NaHCO3实验中血浆TBARS含量明显低于对照组(即补充placebo)。然而TAC以及GSSG/TGSH比值在高强度间歇训练后却均无显著性变化,Pingitore等[19]则发现运动后氧化应激标志物明显升高,研究结果不一致可能与不同研究采用的训练时间不同有关,本研究为7.5 min(不包括间歇时间),而Pingitore等则为45~90 min。TBARS和TAC、GSSG/TGSH比值变化不同步,提示TBARS可能过高估计了高强度训练后的氧化应激反应,Powers等[14]指出,血浆TBARS并不能完全代表脂质过氧化。
在本研究中,虽然训练后氧化应激参数无显著性升高,但在补充Placebo实验中细胞内HSP72表达增加。同时我们还发现,与Placebo比较,补充NaHCO3时训练诱导的HSP72表达上调幅度下降,其在单核细胞内的表达水平在整个实验过程中(180 min)与安静状态下无显著性差异,这与Taylor等[20, 21]利用240 min观测时间得到的实验结果基本一致。Peart等[12]推测,NaHCO3诱导的HSP72表达下调可能与氧化应激反应减弱有关,但在本研究中,TAC和GSSG/TGSH比值在训练后无显著性改变,提示NaHCO3下调HSP72可能并不是氧化应激介导的,其机制与维持酸碱平衡稳态有关(表2)。今后的研究应进一步确定NaHCO3是否通过减轻氧化应激而下调HSP72表达,此外尚需建立长时间力竭运动模型刺激ROS大量产生以探索特异性的应激蛋白(即蛋白质氧化)标志物。
Peart等[12]的研究与本研究结果基本一致,即与补充安慰剂组比较,高强度无氧训练前补充0.3 g/kg体重NaHCO3可下调细胞内HSP72表达量,同时伴随运动能力改善,但在本研究中,运动能力参数(即做功量和力竭时间)在补充NaHCO3后并未发生改变,提示尽管补充NaHCO3对于运动表现的效果尚不确定,但确实能够降低高强度训练时的细胞应激反应。应激反应下降有利于训练后的恢复过程,因此HSP72可作为运动员训练监控的标志物,利用各种手段降低HSP72表达对于运动员训练、比赛和恢复可能具有潜在益处,然而这一推论尚需进一步实验验证。
本研究中,应激激素皮质醇在运动后即刻稍有增加(但与运动前比较并无统计学差异),在运动后180 min显著性下降(表3)。这一结果与Stokes等[22]和Nemet等[23]的研究类似,即反复冲刺运动后60 min内血浆皮质醇无显著性改变,他们认为,运动时间相对较短是皮质醇无变化的主要原因,此外应激激素的生物节律性变异可能也是影响因素之一。研究发现[24],血浆皮质醇在清晨时达到峰值,随后呈线性下降并于夜间(约8:30 p.m.)达最低值,但Deschenes等[25]的实验结果指出,虽然血浆皮质醇存在日节律变化,但对运动的反应并不存在生物节律性,因此推测生物节律变异的影响可能并不大。关于补充NaHCO3对应激激素的影响,不同研究结论不一,Wahl等[15]发现NaHCO3能够降低血浆皮质醇水平,而Bracken等[26]的实验则得出阴性结果。由于本研究中运动并未诱导血浆皮质醇出现升高相,因此NaHCO3对皮质醇的作用尚不能确定。
Lira等[27]证实,高强度无氧训练可诱导免疫系统发生急性时相反应,例如反复冲刺训练后促炎症因子IL-6含量显著升高。在本研究中,运动后血浆IL-6升高的程度较Nemet等[23]的结果更为明显,且IL-6峰值水平在补充Placebo组高于NaHCO3组。值得注意的是,本研究只有5名受试者在各时间点检测到血浆IL-6水平,因此对于血浆IL-6变化的解释应当慎重。此外,由于IL-6参与了机体多种生理过程的调节包括促炎和抗炎、能量感受器、信号转导等[28],因此今后的研究应在多个层面探讨运动前碱中毒与IL-6表达的关系。我们同时检测了血浆IL-8含量的变化,但所有受试者各时间点均因低于检出下限而未检测出结果,这与Ostrowski等[29]的研究结果一致。据证实,运动时肌源性IL-6可释放入血并成为循环IL-6的主要来源,而肌肉只释放少量IL-8且主要在肌肉局部起作用,因此运动并不能上调血浆IL-8水平[30]。
4 结论
总之,高强度间歇训练可显著上调细胞内HSP72表达,但对血浆皮质醇、IL-6、IL-8、GSSG/TGSH和TAC无显著作用;补充NaHCO3对运动能力无显著影响,但可下调运动诱导的HSP72表达水平,其机制可能不是经由氧化应激介导的,而与维持酸碱平衡稳态有关;利用各种手段调控运动后的HSP72表达水平可增强细胞对运动应激的耐受能力,对于运动员训练、比赛和恢复可能具有潜在应用价值。
参考文献:
[1] 邵士元, 谷秀芳. 肌肽复合物、新剂型碳酸氢钠补充对人体无氧运动能力的影响[J]. 泰山医学院学报, 2008, 29(6): 406-409
[2]陈晋云, 郑宝成. 对服用碳酸氢钠来提高人体无氧代谢能力之初探[J]. 山西师大学报:自然科学版, 1994, 8(4): 69-73
[3]Afman G, Garside RM, Dinan N, et al. Effect of carbohydrate or sodium bicarbonate ingestion on performance during a validated basketball simulation test[J]. Int J Sport Nutr Exerc Metab, 2014, 24(6): 632-644
[4]Northgraves MJ, Peart DJ, Jordan CA, et al. Effect of lactate supplementation and sodium bicarbonate on 40-km cycling time trial performance[J]. J Strength Cond Res, 2014, 28(1): 273-280
[5]Krustrup P, Ermidis G, Mohr M. Sodium bicarbonate intake improves high-intensity intermittent exercise performance in trained young men[J]. J Int Soc Sports Nutr, 2015, 12(5): 25-30
[6]Saunders B, Sale C, Harris RC, et al. Effect of sodium bicarbonate and Beta-alanine on repeated sprints during intermittent exercise performed in hypoxia[J]. Int J Sport Nutr Exerc Metab, 2014, 24(2): 196-205
[7]Cameron SL, McLay-Cooke RT, Brown RC, et al. Increased blood pH but not performance with sodium bicarbonate supplementation in elite rugby union players[J]. Int J Sport Nutr Exerc Metab, 2010, 20(4): 307-321
[8]Carr AJ, Gore CJ, Dawson B. Induced alkalosis and caffeine supplementation: effects on 2,000-m rowing performance[J].Int J Sport Nutr Exerc Metab, 2011, 21(5): 357-364
[9]Zabala M, Peinado AB, Calderón FJ, et al. Bicarbonate ingestion has no ergogenic effect on consecutive all out sprint tests in BMX elite cyclists[J]. Eur J Appl Physiol, 2011, 111(12): 3127-3134
[10]Peart DJ, Siegler JC, Vince RV. Practical recommendations for coaches and athletes: a meta-analysis of sodium bicarbonate use for athletic performance[J]. J Strength Cond Res, 2012, 26(7): 1975-1983
[11]Siegler JC, Keatley S, Midgley AW, et al. Pre-exercise alkalosis and acid-base recovery[J]. Int J Sports Med, 2008, 29(7): 545-551
[12]Peart DJ, McNaughton LR, Midgley AW, et al. Pre-exercise alkalosis attenuates the heat shock protein 72 response to a single-bout of anaerobic exercise[J]. J Sci Med Sport, 2011, 14(5): 435-440
[13]Slowinska-Lisowska M, Zembron-Lacny A, Rynkiewicz M, et al. Influence of l-carnosine on pro-antioxidant status in elite kayakers and canoeists[J]. Acta Physiol Hung, 2014, 101(4): 461-470
[14]Powers SK, Smuder AJ, Kavazis AN, et al. Experimental guidelines for studies designed to investigate the impact of antioxidant supplementation on exercise performance[J]. Int J Sport Nutr Exerc Metab, 2010, 20(1): 2-14
[15]Wahl P, Zinner C, Achtzehn S, et al. Effect of high- and low-intensity exercise and metabolic acidosis on levels of GH, IGF-I, IGFBP-3 and cortisol[J]. Growth Horm IGF Res, 2010, 20(5): 380-385
[16]Sandstr?m ME, Madden LA, Taylor L, et al. Variation in basal heat shock protein 70 is correlated to core temperature in human subjects[J]. Amino Acids, 2009, 37(2): 279-284
[17]Siegler JC, Gleadall-Siddall DO. Sodium bicarbonate ingestion and repeated swim sprint performance[J]. J Strength Cond Res, 2010, 24(11): 3105-3111
[18]LeBlanc PJ, Parolin ML, Jones NL, et al. Effects of respiratory alkalosis on human skeletal muscle metabolism at the onset of submaximal exercise[J]. J Physiol, 2002, 544(1): 303-313
[19]Pingitore A, Lima GP, Mastorci F, et al. Exercise and oxidative stress: potential effects of antioxidant dietary strategies in sports[J]. Nutrition, 2015, 31(7-8): 916-922
[20]Taylor L, Midgley AW, Chrismas B, et al. The effect of acute hypoxia on heat shock protein 72 expression and oxidative stress in vivo[J]. Eur J Appl Physiol, 2010, 109(5): 849-855
[21]Taylor L, Midgley AW, Chrismas B, et al. Daily quadratic trend in basal monocyte expressed HSP72 in healthy human subjects[J]. Amino Acids, 2010, 38(5): 1483-1488
[22]Stokes KA, Nevill ME, Cherry PW, et al. Effect of 6 weeks of sprint training on growth hormone responses to sprinting[J].Eur J Appl Physiol, 2004, 92(1-2): 26-32
[23]Nemet D, Meckel Y, Bar-Sela S, et al. Effect of local cold-pack application on systemic anabolic and inflammatory response to sprint-interval training: a prospective comparative trial[J]. Eur J Appl Physiol, 2009, 107(4): 411-417
[24]Teo W, Newton MJ, McGuigan MR. Circadian rhythms in exercise performance: implications for hormonal and muscular adaptation[J]. J Sports Sci Med, 2011, 10(4): 600-606
[25]Deschenes MR, Sharma JV, Brittingham KT, et al. Chronobiological effects on exercise performance and selected physiological responses[J]. Eur J Appl Physiol Occup Physiol, 1998, 77(3): 249-256
[26]Bracken RM, Linnane DM, Brooks S. Alkalosis and the plasma catecholamine response to high-intensity exercise in man[J]. Med Sci Sports Exerc, 2005, 37(2): 227-233
[27]Lira FS, Panissa VL, Julio UF, et al. Differences in metabolic and inflammatory responses in lower and upper body high-intensity intermittent exercise[J]. Eur J Appl Physiol, 2015, 115(7): 1467-1474
[28]Reihmane D, Dela F. Interleukin-6: possible biological roles during exercise[J]. Eur J Sport Sci, 2014, 14(3): 242-250
[29]Ostrowski K, Hermann C, Bangash A, et al. A trauma-like elevation of plasma cytokines in humans in response to treadmill running[J]. J Physiol, 1998, 513 (3): 889-894
[30]Peake JM, Della GP, Suzuki K, et al. Cytokine expression and secretion by skeletal muscle cells: regulatory mechanisms and exercise effects[J]. Exerc Immunol Rev, 2015, 21(5): 8-25

