糖尿病肾病患者血清miR-200c与TGF-β1、FN的相关性分析
高志强,马云,崔玉彬(潍坊医学院附属益都中心医院,山东潍坊262500)
糖尿病肾病(DKD)是2型糖尿病(T2DM)的慢性并发症之一,是终末期肾病的主要病因[1]。目前对DKD的发病机制尚不完全明确,慢性低度炎性反应导致的肾纤维化被认为是导致DKD发生及进展的重要机制。转化生长因子-β1(TGF-β1)是目前公认的致器官纤维化作用最强的促纤维化始动因子,通过TGF-β1/Smads信号通路参与肾脏纤维化的调控,与DKD关系密切[2]。纤维黏连蛋白(FN)是一种主要的细胞外基质糖蛋白,研究表明,局部FN和胶原的堆积能够促进肾纤维化的形成[3]。微小RNA(miR)-200c是miRNA家族重要成员之一,研究证实其与器官纤维化密切相关[4]。近期研究发现,miR-200c在DKD小鼠肾小球中表达明显增高,并且肾小球系膜细胞中的TGF-β1受miR-200c的正向调控[5]。但目前有关miR-200c在DKD患者血清中的表达情况及其与TGF-β1、FN的关系尚不明确。本研究观察DKD患者miR-200c、TGF-β1及FN的表达水平,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选择2015年2月~2017年2月在我院治疗的218例DKD患者患者为DKD组,其中男119例、女99例,年龄(56.09±13.05)岁,糖尿病病程(10.01±6.83)年。纳入标准:①均符合糖尿病肾病防治专家共识(2014年版)DKD诊断标准[6];②近期未发生糖尿病酮症酸中毒;③无高血压病史;④未使用血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)类药物。排除标准:①伴心脏、肝脏及除DKD以外的其他肾脏疾病;②近期有各种感染性疾病。根据美国肾脏基金会-慢性肾脏病临床实践指南和糖尿病肾病防治专家共识(2014年版),参照患者尿白蛋白/尿肌酐(UACR)将DKD组患者分为两个水平,早期DKD(UACR为30~300 mg/g)120例和中晚期DKD(UACR>300 mg/g)98例。另随机选择同期性别、年龄相匹配的非DKD的T2DM患者142例作为单纯T2DM组(UACR<30 mg/g)。随机选择同期性别、年龄相匹配的健康查体志愿者100例作为正常对照组(NC组)。收集所有受试者BMI、糖化血红蛋白(HbA1c)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TC)、甘油三酯(TG)、血肌酐(SCr)、血尿素氮(BUN)等资料。本研究经医院医学伦理委员会批准,患者均签署知情同意书。
1.2 血清标本采集 患者于入院时、健康志愿者于体检时分别采集空腹外周血5 mL,室温静置30 min后,离心取血清,-80 ℃低温冰箱保存备用。
1.3 血清miR-200c水平检测 采用实时荧光定量PCR(qRT-PCR)法。严格按miRNeasy Serum/Plasma Kit(德国QIAGEN公司)试剂盒说明书提取血浆总RNA,利用分光光度计检测总RNA浓度与纯度,以D260/D280在1.8~2.1为合格标准。将提取的总RNA按照miScript Ⅱ RT Kit(德国QIAGEN公司)试剂盒说明书操作逆转录得到cDNA。应用miScript SYBR Green PCR Kit(德国QIAGEN公司)对合成的cDNA进行实时定量PCR反应。反应条件:95 ℃ 10 min,95 ℃ 10 min,60 ℃ 1 min,共45个循环。以U6作为内参基因,采用2-ΔΔCt法计算miR-200c的相对表达量。重复3次。
1.4 血清TGF-β1、FN水平检测 采用酶联免疫吸附(ELISA)法检测血清TGF-β1、FN水平。
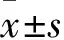
2 结果
2.1 各组血清miR-200c、TGF-β1、FN水平比较 单纯T2DM组和DKD组血清miR-200c、TGF-β1及FN水平均高于NC组(P均<0.05);DKD组血清miR-200c、TGF-β1及FN水平均高于单纯T2DM组(P均<0.05);中晚期DKD患者血清miR-200c、TGF-β1及FN水平均高于早期DKD患者(P均<0.05)。见表1。
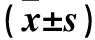
表1 各组血清miR-200c、TGF-β1、FN水平比较
注:与NC组比较,*P<0.05;与单纯T2DM组比较,﹟P<0.05;与早期DKD比较,△P<0.05。
2.2 血清miR-200c与TGF-β1、FN水平的相关性 Pearson相关分析显示,血清miR-200c与TGF-β1、FN水平均呈正相关(r分别为0.874、0.675,P均<0.01)。
2.3 血清miR-200c的影响因素 多元逐步回归分析显示,UACR及TGF-β1是影响DKD患者血清miR-200c的独立危险因素(P均<0.05),回归方程为YmiR-200c=12.984+2.187XTGF-β1+0.04XUACR。
3 讨论
随着T2DM发病率的不断增高,糖尿病相关并发症发生率也随之明显增高,其中DKD是糖尿病主要的微血管并发症之一,是终末期肾病最主要的原因,其发病率和病死率逐年升高[7],严重影响患者的生活质量。终末期肾病患者预后较差,5年生存率<20%[8]。DKD以持续性蛋白尿、进展性肾小球滤过率降低以及血压升高为特征,由于患者早期多无明显症状,出现蛋白尿后病情已不可逆转,因此寻找能够早期发现及判断DKD严重程度的血清生物学标志物意义重大。
miRNA可以稳定表达于血液或者其他体液中,在某些疾病状态下,血液中miRNA的表达水平可以发生特异性改变[9],可能为疾病的早期诊断提供新的方向。近年来越来越多证据表明,miRNA在DKD发生发展中起着重要的作用,起着促进或者抑制DKD发生发展的作用[10]。miR-200c是miR-200家族成员之一,其定位于染色体12p13.31[11]。miR-200c在肿瘤方面的研究较多,其在多种恶性肿瘤中表达减低,具有极强的抑癌基因活性,与上皮间质转化(EMT)、肿瘤细胞的生长、增殖、侵袭、转移及化疗药物敏感性密切相关[12]。近期研究表明,miRNAs参与DKD发病机制中的信号通路的调节,与慢性低度炎症反应及细胞外基质累积导致的肾脏纤维化有关[4]。动物实验证实,DKD小鼠模型miR-200c的表达明显增高[5,13],提示miR-200c可能与DKD的发生发展有关。本研究发现,单纯T2DM组和DKD组患者血清miR-200c水平高于NC组,并且DKD组血清miR-200c水平高于单纯T2DM组,提示患者血清miR-200c水平的增高与DKD的发生有关,并且在患者出现DKD前患者miR-200c已经升高,提示监测糖尿病患者血清miR-200c水平有助于早期发现DKD。我们进一步通过亚组分析还发现,中晚期DKD患者血清miR-200c水平高于早期DKD患者,提示患者血清miR-200c水平与DKD的进展有关,监测DKD患者血清miR-200c水平有助于早期判断DKD患者的严重程度。
DKD发病机制非常复杂,其具体发病机制尚未完全阐明。慢性持续低度炎症反应和细胞外基质累积是DKD发生进展的共同通路[14]。目前有关miR-200c在DKD发生发展中作用的具体机制尚不清楚。近期Kato等[5]发现,DKD小鼠肾小球系膜细胞中TGF-β1受miR-200c的正向调控。TGF-β1属于转化生长因子超家族成员,能够促进肾脏纤维化,增加肾小球系膜细胞数量,促进细胞外基质的积聚,并且TGF-β1mRNA在DKD患者肾小球中表达水平随肾小球硬化范围的增加而增高,在DKD的发生发展中起着重要的作用[15,16]。近期研究证实,高糖浓度能够刺激肾小球系膜细胞FN的合成,并且这种效应是由TGF-β1介导的[17]。FN是一种非胶原糖蛋白,是细胞外基质的主要组成部分,FN在DKD等肾小球疾病中含量增高,提示细胞外基质纤维化发生[18]。FN mRNA水平随着内源性TGF-β1活性的增加而增加[19]。本研究发现,单纯T2DM组和DKD组血清TGF-β1和FN水平均高于NC组,DKD组血清TGF-β1和FN水平均高于单纯T2DM组,并且中晚期DKD患者血清TGF-β1和FN水平均高于早期DKD患者,提示患者血清TGF-β1和FN水平与DKD的发生发展有关,血清中TGF-β1和FN水平能够反映DKD的严重程度,与Ma等[20]研究结果一致。本研究中我们进一步通过Pearson相关分析发现,血清miR-200c与TGF-β1、FN水平均呈正相关,并且多元逐步回归分析显示TGF-β1是影响血清miR-200c水平的独立危险因素,证明miR-200c参与DKD发生发展的机制,可能与对TGF-β1、FN的调控有关。
综上所述,miR-200c在DKD患者血清中表达增高,并且与血清TGF-β1、FN水平呈正相关。miR-200c可能通过对TGF-β1、FN的调控参与DKD的发生发展。
:
[1] Betz B, Conway BR. Recent advances in animal models of diabetic nephropathy[J].Nephron Exp Nephrol, 2014,126(4):191-195.
[2] Valladares SA, Angeles MJ, Rosas M, et al. Association of polymorphisms within the transforming growth factor-β1gene with diabetic nephropathy and serum cholesterol and triglyceride concentrations[J]. Nephrology (Carlton), 2010,15(6):644-648.
[3] 程红新,杨晓萍,蒋雅红,等. 纤维连接蛋白在肾间质纤维化大鼠肾组织中的表达[J].中国组织工程研究,2012,16(31):5837-5842.
[4] 陈珺,蔡晋宇,杜翠,等.MiR-200c与脏器纤维化的研究进展[J].中南大学学报(医学版), 2017,42(2):226-232.
[5] Kato M, Arce L, Wang M. A microRNA circuit mediates transforming growth factor-β1autoregulation in renal glomerular mesangial cells[J]. Kidney Int, 2011,80(4):358-368.
[6] 魏晓,欧三桃.综合防治,延缓进展——2014年版《中国糖尿病肾病防治专家共识》解读[J].实用医学杂志,2016,32(1):1-3.
[7] Wolf G. Diabetes and Kidney Disease[M]. Jena: Wiley Blackwell, 2013:127.
[8] 辛光大,周广宇.还原型谷胱甘肽对老年早期糖尿病肾病患者氧化应激和炎症反应的影响[J].中国老年学杂志,2014,34(11):1449-1503.
[9] Chen X, Ba Y, Ma L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008,18(10):997-1006.
[10] Wu H, Kong L, Zhou S, et al. The role of microRNAs in diabetic nephropathy[J]. J Diabetes Res, 2014,2014:920134.
[11] Bojmar L, Karlsson E, Elleqard S. The role of microRNA-200 in progression of human colorectal and breast cancer[ J]. PLoS One,2013,8(12):e84815.
[12] Djuranovic S, Nahvi A, Green R. A parsimonious model for gene regulation by miRNAs[J]. Science, 2011,331(6017):550-553.
[13] Park JT, Kato M, Yuan H, et al. FOG2 protein down-regulation by transforming growth factor-β1-induced microRNA-200b/c leads to Akt kinase activation and glomerular mesangial hypertrophy related to diabetic nephropathy[J]. J Biol Chem, 2013,288(31):22469-22480.
[14] Sawa Y, Takata S, Hatakeyama Y, et al. Expression of toll-like receptor 2 in glomerular endothelial cells and promotion of diabetic nephropathy by Porphyromonas gingivalis lipopolysaccharide[J]. PLoS One, 2014,9(5):e97165.
[15] Habib SL. Alterations in tubular epithelial cells in diabetic nephropathy[J]. J Nephrol, 2013,26(5):865-869.
[16] El Mesallamy HO, Ahmed HH, Bassyouni AA, et al. Clinical significance of inflammatory and fibrogenic cytokines in diabetic nephropathy[J]. Clin Biochem, 2012,12(9):646-650.
[17] van Det NF, Verhagen NA, Tamsma JT, et al.Regulation of glomerular epithelial cell production of fibronectin and transforming growth factor-beta by high glucose, not by angiotensin II[J]. Diabetes, 1997,46(5):834-840.
[18] Schena FP, Gesualdo L. Pathogenetic mechanisms of diabetic nephropathy[J]. J Am Soc Nephrol, 2005,16(Suppl 1):S30-S33.
[19] Sharma K, Jin Y, Guo J, et al. Neutralization of TGF-beta by anti-TGF-beta antibody attenuates kidney hypertrophy and the enhanced extracellular matrix gene expression in STZ-induced diabetic mice [J]. Diabetes, 1996,45(4):522-530.
[20] Ma X, Lu C, Lv C, et al. The Expression of miR-192 and its significance in diabetic nephropathy patients with different urine albumin creatinine ratio[J]. J Diabetes Res, 2016,2016:6789402.

